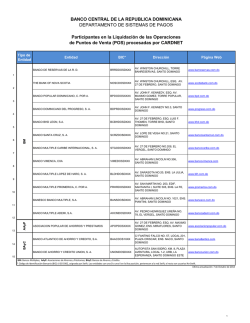
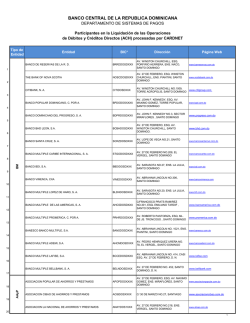
Documento de consenso sobre la espasticidad en
DOCUMENTO DE CONSENSO Documento de consenso sobre la espasticidad en pacientes con esclerosis múltiple Celia Oreja-Guevara, Xavier Montalban, Clara de Andrés, Bonaventura Casanova-Estruch, Delicias Muñoz-García, Inmaculada García, Óscar Fernández Introducción. La esclerosis múltiple es una enfermedad neurológica crónica, desmielinizante e inflamatoria. Los neurólogos implicados en el tratamiento sintomático de esta enfermedad tienden a aplicar criterios diagnósticos y de tratamiento heterogéneos. Objetivo. Elaborar un documento de consenso para establecer criterios homogéneos para el tratamiento de la espasticidad, basados en el conocimiento científico disponible que faciliten la toma de decisiones en la práctica clínica habitual. Desarrollo. Un grupo de expertos españoles en esclerosis múltiple del Grupo de Enfermedades Desmielinizantes de la Sociedad Española de Neurología (SEN) se reunieron para revisar los aspectos relacionados con la espasticidad en esta enfermedad y elaborar el consenso. Tras una búsqueda bibliográfica exhaustiva y siguiendo la metodología metaplán se establecieron unas recomendaciones preliminares para incorporar al documento. Finalmente, cada argumento se clasificó según su grado de recomendación, atendiendo a las categorías del sistema SIGN (Scottish Intercollegiate Guidelines Network). El texto resultante fue sometido a la revisión de los miembros del Grupo de Enfermedades Desmielinizantes de la SEN. Se ha alcanzado un consenso de expertos respecto a los factores desencadenantes de la espasticidad, la sintomatología relacionada, los criterios diagnósticos, los métodos de valoración de la espasticidad, la calidad de vida y los criterios en el manejo terapéutico (farmacológicos y no farmacológicos). Conclusión. Las recomendaciones contenidas en este consenso pueden ser una herramienta útil para el neurólogo para la práctica clínica del día a día y para mejorar la calidad de vida del paciente, ya que permiten un mejor diagnóstico y tratamiento de la espasticidad. Palabras clave. Espasticidad. Esclerosis múltiple. Diagnóstico. Nabiximol. Síntomas. Tratamiento. Introducción La esclerosis múltiple (EM) es una enfermedad neurológica crónica idiopática, desmielinizante, inflamatoria y es la segunda causa de discapacidad en adultos jóvenes [1] tras los accidentes de tráfico. La desmielinización difusa bien definida y la pérdida axonal progresiva en el sistema nervioso central (SNC) son el sustrato de las manifestaciones clínicas de la EM que están asociadas a síntomas tales como dolor, espasticidad, espasmos, disfunción vesical [2], fatiga, depresión, trastornos de la marcha, visión borrosa, disfagia y trastornos del sueño [3]. Los síntomas son muy variables en su localización y gravedad, por lo que puede verse afectado cualquier sistema y en diferentes grados, con la consiguiente afectación de la calidad de vida del paciente. En general, la EM afecta más a las mujeres que a los hombres (2:1 de los casos) [4]. Las referencias de estudios epidemiológicos fiables próximos a nuestro ámbito geográfico se limitan a algunos estudios de ámbito autonómico que, no obstante, proporcio- www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 nan información de interés. Así, la incidencia estimada en España oscila entre 1,2 casos por cada 100.000 habitantes y año (Cantabria) [4] y 5,3 casos por cada 100.000 habitantes y año (Santiago de Compostela) [5,6], en tanto que la prevalencia puede variar según múltiples factores, ya sean genéticos o ambientales [1]. Los datos españoles de prevalencia disponibles apuntan hacia una amplia variabilidad que oscila entre 50 y 125 casos por cada 100.000 habitantes y año [7-10]. Los avances actuales en el tratamiento modificador de la enfermedad a largo plazo de la esclerosis múltiple se reflejan en el aumento de la longevidad y de la disminución de la mortalidad de los pacientes afectados y, en consecuencia, un manejo adecuado de los síntomas asociados tiene cada vez mayor impacto en la calidad de vida de los pacientes [11]. La espasticidad es un síntoma común en la EM [12] que se expresa como consecuencia de una pérdida del control de los reflejos medulares y cuya evolución natural es hacia la cronicidad [13,14]. La espasticidad es un trastorno motor causado por le- Unidad de Esclerosis Múltiple; Servicio de Neurología; Hospital Clínico San Carlos; Madrid (C. Oreja-Guevara). Servicio de Neuroinmunología; Hospital Universitari Vall d’Hebron; Barcelona (X. Montalban). Servicio de Neurología; Hospital Gregorio Marañón; Madrid (C. de Andrés). Unidad de Esclerosis Múltiple; Hospital Universitario La Fe; Valencia (B. Casanova-Estruch). Servicio de Neurología; Hospital Xeral-Cies; Vigo, Pontevedra (D. Muñoz-García). Servicio de Medicina Física y Rehabilitación; Hospital Virgen de las Nieves; Granada (I. García). Servicio de Neurología; Unidad de Gestión Clínica de Neurociencias; Instituto de Biomedicina de Málaga; Hospital Universitario Carlos Haya; Málaga, España (O. Fernández). Correspondencia: Dra. Celia Oreja Guevara. Unidad de Esclerosis Múltiple. Servicio de Neurología. Hospital Clínico San Carlos. Profesor Martín Lagos, s/n. E-28040 Madrid. E-mail: [email protected] Financiación: Trabaja financiado por el laboratorio Almirall mediante una beca sin restricciones. Conflictos de interés: Los autores manifiestan la inexistencia de conflictos de interés en relación con este artículo. Agradecimientos: Sonia Pisa y Andreu Covas, de GOC Networking, por la dirección de la metodología utilizada para elaborar el documento de consenso. Aceptado tras revisión externa: 30.08.13. Cómo citar este artículo: Oreja-Guevara C, Montalban X, De Andrés C, Casanova-Estruch B, Muñoz-García D, García I, et al Documento de consenso sobre la espasticidad en pacientes con esclerosis múltiple. Rev Neurol 2013; 57: 359-73. © 2013 Revista de Neurología 359 C. Oreja-Guevara, et al siones del sistema nervioso central en el que participa la motoneurona superior. En condiciones fisiológicas, la actividad refleja medular se halla regulada por diferentes vías neuronales que intervienen en el complejo control motor. Precisamente, la participación de diferentes vías es la que condiciona una gran variabilidad en la expresión clínica. Por lo tanto, lo más probable es que el fenómeno de la espasticidad no sea consecuencia de un único mecanismo, sino de unas interacciones complejas entre redes y vías neuronales interconectadas entre sí [15]. La espasticidad se define como un aumento del tono/rigidez muscular, dependiente de la velocidad de los reflejos tónicos de estiramiento. Así el paciente percibe una rigidez continua a la que se pueden sobreañadir, con posibles exacerbaciones, espasmos en extensión o flexión, a veces dolorosos en la zona o zonas afectadas. Puede causar dolor, trastorno de la marcha, trastornos esfinterianos (que afectan notablemente la calidad de vida) y alteración de algunos movimientos y, por lo tanto, problemas en las actividades de la vida diaria del paciente [16-18], lo que puede implicar con el tiempo un grado de discapacidad considerable [12]. La espasticidad se puede localizar en un único grupo muscular o ser generalizada y afectar así a varios grupos musculares. Los grupos musculares más afectados suelen ser la musculatura antigravitatoria de las extremidades. Las posturas anómalas que se observan con mayor frecuencia implican a los miembros superiores en flexión y aducción, así como a los miembros inferiores en actitud de extensión, aducción y rotación interna [15,19,20]. La fisiopatología de la espasticidad no se conoce con precisión, pero es evidente que intervienen, entre otras estructuras, el tronco cerebral y la médula espinal [13]. En la formación reticular bulbar medial se localiza un centro cuya activación produce reducción en el tono muscular: es el centro inhibidor. En la misma área, pero localizada más en lateral, existe una zona más difusa cuya activación incrementa el tono muscular. La corteza, fundamentalmente el córtex premotor (área 6), activa el área inhibitoria reticular mediante fibras yuxtapiramidales, que son vitales para el mantenimiento del tono motor adecuado [21-24]. La destrucción de las áreas premotoras o de las vías yuxtapiramidales impide la activación del área reticular inhibidora del tono; en consecuencia, las áreas laterales activadoras actúan sin el control adecuado y así se incrementa el tono muscular [21,24,25]. La variabilidad de la sintomatología de la espasticidad se explica por la distinta localización de las áreas afectadas en el SNC [14] en esta enfermedad. 360 En relación con la evolución de la espasticidad, se valoran cuatro fases, que se han definido bien en la publicación de Vivancos-Matellano et al [14], y que son determinantes para establecer el tratamiento: – Fase (inicial) de la espasticidad. Se debe al aumento del tono muscular y se define en la exploración clínica como el estado de aumento de la tensión de un músculo cuando se alarga de forma pasiva por exageración del reflejo muscular de estiramiento. – Fase de actitud viciosa. Los pacientes presentan desequilibrio muscular por predominio de la espasticidad en determinados grupos musculares y es clásico el predominio de los flexores plantares y varizantes del pie, de los aductores y flexores en la cadera y de los flexores de codo, muñeca y dedos en la extremidad superior [26]. – Fase de retracción muscular. Al persistir la actitud viciosa se produce un crecimiento desigual entre grupos musculares agonistas y antagonistas que conduce a la estructuración de esta actitud, por falta de acomodación de los sarcómeros, que son incapaces de conseguir el crecimiento muscular normal. Se entiende por retracción muscular la resistencia opuesta por el músculo a la movilización cuando no está en contracción [27,28]. – Fase de deformidades osteoarticulares. Se observa con más frecuencia en niños (en espasticidades secundarias a parálisis infantiles), dado que se encuentran en una etapa de crecimiento óseo. En efecto, como consecuencia del fracaso del tratamiento de la espasticidad en las fases anteriores, se modifican las presiones y los estímulos de tracción de los cartílagos de crecimiento y, de acuerdo con la ley de Delpech [17], este hecho da lugar a deformidades osteoarticulares [29,30]. Se estima que el número total de personas con espasticidad asociada a cualquier etiología en España es de 300.000 a 400.000; es decir, 10 de cada 1.000 habitantes conviven con este problema de salud [13,26]. La prevalencia de la espasticidad en pacientes diagnosticados de EM es variable. Se estima que entre el 40 y el 84% de los pacientes con EM [31,32] presenta espasticidad de distintos grados de gravedad. En formas de EM moderada o grave la espasticidad se presenta hasta en un 54% de los pacientes [33], y un tercio de pacientes con espasticidad refieren no poder realizar, o tener que modificar, algunas actividades de su vida diaria a consecuencia de ella [34,35]. Para diagnosticar la espasticidad, se recomienda realizar una historia clínica detallada, preguntando al paciente sobre la presencia de rigidez y espasmos www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 Documento de consenso sobre la espasticidad en pacientes con esclerosis múltiple (por ejemplo nocturnos), y una exploración física neurológica que incluya la inspección de la marcha y que ponga en evidencia signos de relevancia diagnóstica, tales como resistencia al movimiento pasivo de los miembros afectados que aumenta con la veloc idad del mismo; espasmos flexores, extensores y aductores; hiperactividad de los reflejos tendinosos; reflejos cutaneoplantares en extensión o clono aquíleo, y cocontracción de los grupos musculares antagonistas [36]. Existen diferentes escalas para valorar el grado de espasticidad en la EM, como la escala de Ashworth modificada, que mide el tono muscular y el rango de movimiento de las extremidades, o la escala NRS (0-10), que valora la intensidad de la espasticidad experimentada por el paciente. Asimismo, se dispone de la escala de espasmos de Penn, que mide el número de espasmos que el paciente experimenta en un período de tiempo determinado. No hay un consenso sobre qué escala se debe utilizar y a veces se gradúa simplemente la espasticidad en leve, moderada y grave. Otras escalas valoran el efecto de la espasticidad sobre la calidad de vida, bien de forma genérica –EuroQol 5D (EQ-5D) y SF-36–, midiendo el impacto de la espasticidad en aspectos comunes de la vida de cualquier persona, como de forma específica (MusiQol), que son más sensibles en el corto plazo para evaluar el impacto de un tratamiento. En general, es complicado establecer protocolos para los tratamientos sintomáticos en la EM, pues los síntomas pueden ser fásicos y fluctuar según el momento. El tratamiento de la espasticidad comprende medidas farmacológicas y no farmacológicas. Respecto al tratamiento farmacológico, se recomienda establecer una pauta escalonada individualizada para cada paciente [12] diseñada por equipos multidisciplinares que, según las características de cada caso, pueden complementar con terapias no farmacológicas tales como fisioterapia, terapia ocupacional, ayudas técnicas, logopedia y ortesis. No obstante, pese a la importancia del tratamiento de la espasticidad en la EM, para preservar al máximo la capacidad funcional y la calidad de vida del paciente [34,37,38] y, en consecuencia, reducir los costes asociados a la enfermedad, en la actualidad hay pocas guías de práctica clínica específicas de espasticidad basadas en la evidencia en cuanto a su manejo óptimo [36]. De ahí surge la necesidad de este consenso de expertos cuyo objetivo principal es profundizar y actualizar en el conocimiento de este síntoma de la EM, así como en su diagnóstico y en el tratamiento farmacológico, rehabilitador y quirúrgico. www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 Figura 1. Fases para la elaboración del documento de consenso. Metodología El proceso metodológico de elaboración de este documento se describe en sus distintas fases en la figura 1. A partir de la lectura crítica de las publicaciones seleccionadas por la búsqueda bibliográfica llevada a cabo por el panel de expertos, se elaboró un documento de trabajo que ordenó y agregó los contenidos susceptibles de ser valorados por consenso co mo recomendaciones. A continuación, el panel de expertos celebró una sesión de consenso el 20 de marzo de 2012 para validar las recomendaciones siguiendo una técnica de tormenta de ideas (brainstorming) estructurada mediante el uso de tarjetas (técnica metaplán [39]). Tras la reunión, el equipo de apoyo metodológico del proyecto sintetizó las aportaciones realizadas por el grupo y categorizó los niveles de evidencia (NE) y el grado de recomendación (GR) durante el segundo y tercer trimestre del pasado año. De ello resultó una primera versión del documento de consenso. Para asegurar el rigor metodológico seguido en la categorización de las recomendaciones, se realizó una búsqueda sistemática de autor no exhaustiva de aquellas recomendaciones que no habían tenido la categorización de NE: 4, GR: D. Con posterioridad, primero, el coordinador del proceso de consenso y, después, el conjunto del pa- 361 C. Oreja-Guevara, et al Tabla I. Niveles de evidencia científica de SIGN modificado. 1++ Metaanálisis de alta calidad, revisiones sistemáticas de ensayos clínicos o ensayos clínicos de alta calidad con muy poco riesgo de sesgo 1+ Metaanálisis bien realizados, revisiones sistemáticas de ensayos clínicos o ensayos clínicos bien realizados con poco riesgo de sesgo 1– Metaanálisis, revisiones sistemáticas de ensayos clínicos o ensayos clínicos con alto riesgo de sesgo 2++ Revisiones sistemáticas de alta calidad de estudios de cohortes o de casos y controles. Estudios de cohortes o de casos y controles con riesgo muy bajo de sesgo y con alta probabilidad de establecer una relación causal 2+ Estudios de cohortes o de casos y controles bien realizados con bajo riesgo de sesgo y con una moderada probabilidad de establecer una relación causal 2– Estudios de cohortes o de casos y controles con alto riesgo de sesgo y riesgo significativo de que la relación no sea causal 3 Estudios no analíticos, como informes de casos y series de casos 4 Opinión de expertos Tabla II. Categorías de grados de recomendación según el sistema SIGN modificado. A Al menos un metaanálisis, revisión sistemática o ensayo clínico clasificado como 1++ y directamente aplicable a la población diana de la guía; o un volumen de evidencia científica compuesto por estudios clasificados como 1+ y con gran consistencia entre ellos B Un volumen de evidencia científica compuesta por estudios clasificados como 2++, directamente aplicable a la población diana de la guía y que demuestran gran consistencia entre ellos; o evidencia científica extrapolada desde estudios clasificados como 1++ o 1+ C Un volumen de evidencia científica compuesta por estudios clasificados como 2+ directamente aplicables a la población diana de la guía y que demuestran gran consistencia entre ellos; o evidencia científica extrapolada desde estudios clasificados como 2++ D Evidencia científica de nivel 3 o 4; o evidencia científica extrapolada desde estudios clasificados como 2+ Recomendaciones de consenso √ Práctica recomendada, basada en la experiencia clínica y el consenso del grupo de expertos Las afirmaciones de recomendación que pueden influir en la toma de decisiones se han validado con la correspondiente clasificación del nivel de evidencia de los argumentos en los que se basa una recomendación y del grado de recomendación correspondiente. Grados de recomendación Buena práctica clínica nel de expertos procedieron a revisar la primera versión de las recomendaciones hasta conseguir definir este documento final. El documento resultante fue enviado y validado en su fase final por el Grupo de Enfermedades Desmielinizantes de la Sociedad Española de Neurología. Para la categorización de las evidencias extraídas de la revisión de la bibliografía se utilizaron los criterios del sistema Scottish Intercollegiate Guidelines Network (SIGN) modificado, que se caracterizan por 362 permitir clasificar la calidad de la evidencia científica disponible y graduar la fuerza de las recomendaciones con sencillez y transparencia. El denominado SIGN modificado clasifica las evidencias científicas según los criterios que muestra la tabla I y los grados de recomendación que muestra la tabla II. El sistema SIGN pondera con solvencia los estudios experimentales (como los ensayos clínicos) y sus revisiones sistemáticas y metaanálisis, pero, en cambio, infravalora los estudios considerados como criterio de referencia para obtener las evidencias en hipótesis científicas de carácter diagnóstico, donde no son referentes los ensayos clínicos. Por esa razón, cuando se trata de evaluar evidencias en temas de diagnóstico, el SIGN modificado aconseja el uso de los criterios expuestos en la tabla III, correspondientes al sistema de categorización del Centro de Medicina Basada en la Evidencia (CMBE) de Oxford. Las recomendaciones que se muestran en el presente artículo se han clasificado siguiendo los criterios del sistema SIGN o CMBE según lo comentado previamente. Después de cada recomendación consensuada por el panel de expertos consultado, se incluye entre paréntesis su nivel de evidencia y grado de recomendación, siempre basado en si la recomendación se ha obtenido de la consulta de la bibliografía o si ha sido creada por los expertos participantes. En el primer caso, la clasificación va de 1++ a 3 en su NE y de A a C en su GR. En el segundo, se ha categorizado con el número 4 y D y el símbolo √, que hace referencia a que el enunciado en cuestión es consecuencia de la consideración como práctica recomendada, basada en la experiencia clínica de los expertos consultados. Factores desencadenantes de la espasticidad En pacientes con EM, se recomienda primero considerar aquellos factores que se han relacionado con la presencia de la espasticidad o con su empeoramiento, por las consecuencias que puedan tener sobre el paciente y su plan terapéutico. Entre estos factores estarían los brotes de la EM, la progresión de www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 Documento de consenso sobre la espasticidad en pacientes con esclerosis múltiple la enfermedad, cambios en la temperatura corporal (calor), estrés psicológico, ropa ajustada, menstruación, fatiga excesiva, estímulos dolorosos, infecciones, fecalomas, algunos tratamientos modificadores de la enfermedad (como el interferón β) y úlceras por presión (NE 4; GR D/√). Tabla III. Niveles de evidencia científica y formulación de recomendaciones para preguntas sobre diagnóstico según el CMBE. Niveles de evidencia Tipo de evidencia Ia Revisión sistemática con homogeneidad de estudios de nivel 1 Sintomatología relacionada con la espasticidad Ib Estudios de nivel 1 En los pacientes con EM pueden estar presentes numerosos síntomas (como espasticidad, alteraciones visuales, alteraciones motoras y sensitivas, trastornos vesicales, fatiga o temblor, entre otros) que pueden interactuar entre sí negativamente como consecuencia de su diferente fisiopatología o también como consecuencia de los mecanismos de acción y efectos adversos derivados de las intervenciones terapéuticas. Con el objetivo de mejorar o mantener el funcionamiento y la preservación de la calidad de vida de estos pacientes, se recomienda un cuidadoso seguimiento de los síntomas y una prescripción personalizada de los tratamientos farmacológicos y no farmacológicos (NE 4; GR D). II Estudios de nivel 2. Revisión sistemática de estudios de nivel 2 III Estudios de nivel 3. Revisión sistemática de estudios de nivel 3 IV Consenso, opiniones de expertos sin valoración crítica explícita Estudios de nivel 1 Cumplen: Espectro adecuado de pacientes Población no representativa (la muestra no refleja la población donde se aplicará la prueba) Estudios de nivel 2 Presentan sólo uno de estos sesgos: Diagnóstico de la espasticidad Para realizar el diagnóstico de espasticidad, se recomienda elaborar una historia clínica detallada, preguntando al paciente por la presencia de aspectos asociados a la espasticidad (como trastornos de la marcha, del sueño, vesicales, espasmos o factores que la acentúan), y mediante una exploración física de orientación neurológica que incluya la inspección de la marcha y que ponga en evidencia signos de relevancia diagnóstica como: – Resistencia al movimiento pasivo de los miembros afectados, que aumenta con la velocidad del mismo. – Espasmos flexores, extensores y aductores. – Hiperactividad de los reflejos tendinosos. – Reflejos cutaneoplantares en extensión o clono aquíleo. – Cocontracción de los grupos musculares antagonistas. (NE 4; GR D/√) Métodos de valoración de la espasticidad Para la valoración de la espasticidad y afectación neuromuscular del paciente con EM, se recomienda el uso de las tres escalas, ya que se complementan entre ellas: escala de Ashworth modificada, escala 0-10 de la Numeric Rating Scale (NRS) y escala de espasmos de Penn (NE 4; GR D/√): – Escala de Ashworth y versión modificada. La utilización del método de valoración de la espasti- www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 Comparación enmascarada con una prueba de referencia válida Comparación con el criterio de referencia inadecuado (la prueba que se evaluará forma parte del criterio de referencia o el resultado de la prueba influye en la realización del criterio de referencia) Comparación no enmascarada Estudios de casos y controles Estudios de nivel 3 Recomendación Presentan dos o más de los criterios descritos en los estudios de nivel 2 Evidencia Recomendación Evidencia A Ia o Ib C III B II D IV cidad, denominado escala de Ashworth modificada, versión modificada (MMAS), se recomienda en la evaluación de la espasticidad, en pacientes con esclerosis múltiple, ya que ha demostrado su utilidad en la práctica clínica [40-52] (NE 2+; GR C/√). – Escala NRS de 0-10. La escala paramétrica de espasticidad (NRS) ha demostrado ser una herramienta válida y fiable en la evaluación de la espasticidad de los pacientes con EM, con un nivel moderado a alto de correlación con otros instrumentos usados como referentes en la evaluación de la espasticidad [53,54] (NE 1++; GR A/√). – Escala de espasmos de Penn. Se ha recomendado como escala de valoración de la espasticidad y afectación neuromuscular del paciente con EM [55-62] (NE 2++; GR B/√). 363 C. Oreja-Guevara, et al Valoración de la calidad de vida – Escalas genéricas. Para la valoración de la calidad de vida genérica en los pacientes con EM, se recomienda el cuestionario EQ-5D y el SF-36 (NE 4; GR D/√). – Escala específica. Para la valoración de la calidad de vida específica en los pacientes con EM, se recomienda el cuestionario MusiQol (NE2++; GR B/√) [63,64]. Otros sistemas de valoración En casos especiales, pueden ser muy útiles las pruebas electrodiagnósticas, aunque no son necesarios para la clínica diaria. Se recomienda que se tenga en consideración que los registros electromiográficos pre y postratamiento pueden mostrar cambios diferentes a los esperados por la clínica que expresa el paciente (NE 4; GR D/√). Criterios en el manejo terapéutico de la espasticidad En el manejo de la espasticidad, deberíamos lograr un equilibrio entre la maximización de los efectos beneficiosos del tratamiento y la minimización de los riesgos que debemos asumir (NE 4; GR D). Es fundamental la implantación del plan terapéutico y educacional, tan pronto como sea posible, para prevenir y tratar los factores desencadenantes que pueden producir espasticidad o, en su caso, reducir la espasticidad y evitar sus consecuencias (NE 4; GR D). Resulta necesario un abordaje multidisciplinar de la patología, incluyendo a la persona que padece la EM, su familia o cuidadores y todas las especialidades médicas que puedan estar involucradas (NE 4; GR D). Debe realizarse una evaluación funcional del paciente antes de tomar cualquier decisión terapéutica, y definir los objetivos funcionales que deben alcanzar en conjunto el paciente y su cuidador (NE 4; GR D). Debemos tener en cuenta que en ocasiones la espasticidad leve nos puede ayudar a mantener la funcionalidad. Tratamiento de la espasticidad: generalidades Condiciones generales Se recomienda un diseño individualizado del plan terapéutico de la espasticidad en pacientes con EM, en función de las condiciones y necesidades de cada paciente y de sus cuidadores (NE 4; GR D). 364 La toma de decisiones en la elaboración de un plan terapéutico debe considerar una serie de factores individuales tales como antecedentes terapéuticos, preferencias (como medicamentos u otras terapias), complicaciones (dolor y contracturas, por ejemplo), condiciones sociales y económicas, así como otros síntomas como la movilidad, la fatiga o la depresión (NE 4; GR D). Objetivo terapéutico Ante los pacientes con EM, se recomienda considerar como objetivo terapéutico de la espasticidad mejorar la función (postura, marcha, movilidad) y el alivio de los síntomas relacionados (trastornos de la marcha, del sueño, vesicales, dolor, espasmos, entre otros) para favorecer las actividades de la vida diaria (higiene, vestido, alimentación), además de disminuir el dolor y prevenir complicaciones (úlceras por presión, contracturas-subluxaciones) (NE 4; GR D). Criterios previos al inicio de un tratamiento antiespástico Al considerar los tratamientos para la espasticidad, es importante reconocer que el efecto deseado puede cambiar con el tiempo a medida que progresa la enfermedad (NE 4; GR D). Se recomienda considerar que la espasticidad en sí misma puede ser útil para un paciente ambulatorio y, por lo tanto, el tratamiento sólo es necesario cuando la espasticidad se convierte en un problema (NE 4; GR D). Se recomienda que, una vez decidida la indicación de tratar la espasticidad de un paciente con EM, el plan de tratamiento debe ser de instauración precoz y debe incluir tanto la terapia farmacológica como el tratamiento rehabilitador (NE 4; GR D/√). Terapia farmacológica Se recomienda que, antes de iniciar un tratamiento antiespástico, se tenga en cuenta si existen otros síntomas y signos que puedan empeorar con el tratamiento, como son la debilidad, la ataxia y la fatiga, y si existen fármacos concomitantes como algunos tratamientos inmunomoduladores tipo interferón β y algunos inhibidores de la recaptación selectiva de serotonina (NE 4; GR D). La espasticidad se expresa con amplia variabilidad en cada paciente, por lo que se recomienda mantener la alerta sobre cualquier factor o factores que puedan desencadenar o agravar la espasticidad. El régimen terapéutico se deberá adaptar en consecuencia (NE 4; GR D/√). www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 Documento de consenso sobre la espasticidad en pacientes con esclerosis múltiple El abordaje terapéutico de la espasticidad se debe considerar en función de las condiciones que exprese el paciente de un modo multidisciplinar, por eso normalmente se requiere el empleo simultáneo del tratamiento farmacológico y rehabilitación (NE 4; GR D). Se ha de considerar la terapia coadyuvante del paciente por otras comorbilidades, dado que algunos fármacos tienen efecto sobre la espasticidad. La terapia con esteroides puede mejorar transitoriamente la espasticidad, del mismo modo que se puede empeorar transitoriamente por algunos tratamientos inmunomoduladores (por ejemplo, interferones) [65]. El tratamiento oral se utiliza en general en los estadios precoces de la enfermedad, mientras que los tratamientos invasivos suelen reservarse para los pacientes con mayor discapacidad [16] (NE 4; GR D). Opciones de tratamiento Baclofeno oral El baclofeno es un derivado del ácido γ-aminobu tírico (GABA). Se relaciona su efecto antiespástico con los mecanismos de inhibición de la neurotransmisión refleja en la médula espinal mediante su efecto sobre los receptores de GABA. Atraviesa la barrera hematoencefálica, aunque con limitaciones, de modo que, administrado por vía oral, las concentraciones que alcanza en la intratecal son bajas. La dosis útil habitual es muy variable y 75 mg/día constituye la dosis máxima. Conviene iniciar el tratamiento con una dosis baja nocturna y realizar el escalado de manera lenta, pues en un inicio puede generar sedación. En general, es efectivo en el control de los síntomas, en especial si se instaura en estadios incipientes de aparición de los síntomas, y puede ayudar a controlar también la presencia de espasmos nocturnos [3]. Tizanidina La tizanidina es un relajante muscular que actúa en el SNC interaccionando con los receptores noradrenérgicos y afecta a la liberación de neurotransmisores excitadores como el glutamato, actúa también en la médula espinal inhibiendo la sustancia P, lo que le confiere un cierto efecto analgésico y hace que actúe sobre los espasmos. Su metabolismo es hepático y renal, por lo que requiere llevar a cabo controles de ambas funciones. Ha demostrado un efecto significativo sobre el tono muscular, la frecuencia de espasmos y clonos, aunque los resultados no han mostrado efectos en www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 términos de capacidad funcional [66-68]. La dosis habitual es en un inicio muy baja, de 2-4 mg/día, para aumentarla de manera progresiva hasta un máximo de 36 mg/día. Diacepam El diacepam reduce el tono muscular mediante la potenciación de la acción inhibitoria gabérgica postsináptica y la inhibición de las vías descendentes excitatorias, lo que lleva a una supresión de los impulsos sensoriales provenientes de los receptores musculares y la piel. La dosis diaria máxima recomendada es de 60 mg. En todos los estudios de comparación contra tratamiento activo, el diacepam mostró reducir la espasticidad, si bien sin diferir significativamente de lo logrado con el tratamiento comparado, ya fuera baclofeno, dantroleno o tizanidina [15]. Debe tenerse en cuenta además que las benzodiacepinas utilizadas de manera crónica pueden crear dependencia y su supresión brusca, la presencia de un síndrome de abstinencia. Cannabinoides en espray (delta-9-tetrahidrocannabinol + cannabidiol) El combinado de fitocannabinoides, en concreto de delta-9-tetrahidrocannabinol (THC) y cannabidiol (CBD) en proporción de 1 a 1, para su administración mediante espray bucodispersable ejerce sus propiedades terapéuticas por medio de sus efectos directos sobre el sistema endocannabinoide. Así, el THC es un agonista parcial de los receptores CB1 y CB2, con un mayor efecto sobre los CB1; de ahí sus efectos psicoactivos. En cuanto al CBD, que es un análogo estructural del THC, muestra baja afinidad por ambos receptores y se comporta como antagonista de CB1, por lo tanto contrarresta los efectos psicoactivos del THC [69]. Hay tres ensayos clínicos de fase III considerados fundamentales, todos contra placebo y doble ciego [70]. En todos ellos, el combinado de THC + CBD mostró reducir de manera significativa la espasticidad debida a la EM y refractaria a los tratamientos convencionales (baclofeno, diacepam, tizanidina, gabapentina o combinaciones de ellos). Asimismo, también en los tres ECA se observó que THC + CBD mejoró de manera significativa la calidad del sueño de los pacientes, y en uno de ellos se registró una mejora, también significativa, de la percepción de bienestar (ya fuera por el propio paciente, el cuidador o el personal médico) y de la funcionalidad evaluada mediante la escala de Barthel. El tratamiento fue en general bien tolerado. 365 C. Oreja-Guevara, et al Por lo general, tras el análisis de datos disponibles podemos afirmar hoy en día que contamos con otra opción de tratamiento para la espasticidad y síntomas relacionados en la EM que puede administrarse sola o en combinación con otros fármacos antiespásticos. Aproximadamente el 50% de los pacientes afectos de espasticidad presenta respuesta a este tratamiento, con una buena tolerancia [15]. Otros estudios confirman el mantenimiento de la eficacia a largo plazo del compuesto vía espray, como terapia adicional en el tratamiento de la espasticidad de la EM, en pacientes que ya se han identificado como respondedores [71,72]. Toxina botulínica La expresión focalizada de la espasticidad a un solo grupo muscular se beneficia de terapias locales que permiten disminuir la espasticidad de los músculos hiperactivos sin debilitar otros no afectados. La terapia local de administración parenteral de elección es la toxina botulínica, al mostrarse segura cuando se usa en las dosis recomendadas y tener efectos secundarios limitados [13,14] La toxina botulínica A (la más habitual) y la B son las más utilizadas en clínica. En la espasticidad generalizada, puede ser terapia complementaria, ya que puede administrarse en aquellos músculos más afectados de forma selectiva y evitar efectos adversos de dosis dependientes de otros fármacos orales [65,68,73-75]. Además, es un tratamiento coadyuvante de otras medidas terapéuticas (tratamiento rehabilitador, cirugía, baclofeno intratecal). En el caso de la espasticidad infantil, la toxina botulínica puede prevenir o disminuir las deformidades óseas que se producen durante el crecimiento [76]. En la esclerosis múltiple, las principales áreas de aplicación de la toxina botulínica incluyen la espasticidad focal y la disfunción vesical como las más frecuentes. En menor medida, se utiliza también en el manejo del dolor y las complicaciones neurooftalmológicas. La mejoría clínica se manifiesta a los 5-7 días de la inyección intramuscular de la toxina botulínica, con un efecto máximo a las 5-6 semanas. Se debería tratar al paciente simultáneamente con fisioterapia para obtener el máximo beneficio con la toxina botulínica. La pérdida de efecto de la toxina se produce a medida que las terminales nerviosas se ramifican y conectan de nuevo con las placas terminales, hacia las 12 semanas tras la inyección. Baclofeno intratecal El baclofeno intratecal se utiliza en caso de espasticidad grave de larga evolución o generalizada resis- 366 tente a tratamientos orales. Consiste en la colocación de un catéter intratecal en la zona lumbar que va conectado a una bomba o reservorio que se ubica de manera subcutánea y que deberá recargarse periódicamente. Este dispositivo permite que el paciente reciba la dosis eficaz equivalente a la administración de cuatro veces la dosis oral, pero con una mínima parte de los efectos secundarios y sin que suponga un incremento notable de la concentración plasmática del fármaco. Pese a las complicaciones que pueda producir, son numerosas las publicaciones que apoyan que la colocación de una bomba de baclofeno intratecal implica una mejora de la espasticidad, de la calidad del sueño, de los trastornos esfinterianos y en general de la calidad de vida del paciente con EM afecto de espasticidad grave o generalizada [75,77]. Gabapentina Aunque la gabapentina es estructuralmente una molécula análoga al GABA, no se une a su receptor, motivo por el cual su mecanismo de acción en relación con la espasticidad no está establecido. Su utilización suele producirse en casos con dolor neuropático asociado. No se dispone de evidencia para su uso en el tratamiento de la espasticidad de los pacientes afectos de EM. Clonacepam El clonacepam debe utilizarse a dosis bajas debido a que presenta un efecto sedante intenso y, en general, precisa además del uso concomitante de otros fármacos antiespásticos. La dosis a la que suele utilizarse es de 2-8 mg/día. Recomendaciones del tratamiento farmacológico Estos fármacos antiespásticos pueden mejorar los síntomas de la espasticidad, pero pueden ser de beneficio limitado en términos de mejora funcional, en particular en pacientes con espasticidad resistente en la EM. – Se recomienda considerar que el extendido uso de medicamentos antiespasticidad oral convencionales no viene avalado por criterios de medicina basada en la evidencia, respecto a su eficacia, impacto en la calidad de vida y perfil de seguridad [66,78-80] (NE 1++; GR A/√). – La larga experiencia empírica existente sobre el uso de fármacos orales convencionales de efecto antiespástico sigue sosteniendo su utilización como una opción terapéutica en el tratamiento antiespástico (NE 4; GR D). www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 Documento de consenso sobre la espasticidad en pacientes con esclerosis múltiple Tabla IV. Recomendaciones de tratamiento farmacológico para la espasticidad. Vía Baclofeno Oral Recomendación NE GR El tratamiento oral con baclofeno ha demostrado ser eficaz como antiespástico y muestra su efecto en la disminución de la frecuencia y el número de espasmos en pacientes con esclerosis múltiple [3,80,82-96] 2++ B/√ 4 D/√ En el tratamiento oral con baclofeno, se recomienda una titulación muy lenta y un inicio nocturno del mismo Tizanidina Oral El tratamiento oral con tizanidina ha demostrado ser eficaz como antiespástico y se recomienda iniciar su administración con una dosificación en un inicio muy baja, de 2-4 mg/día, para aumentarla progresivamente hasta un máximo de 36 mg/día [3,74,78,80,87-91,97-99] 2++ B/√ Diacepam Oral El tratamiento oral con diacepam ha demostrado ser eficaz como antiespástico, de forma comparable al baclofeno y la tizanidina, aunque las preferencias de los pacientes se decantaran hacia estos últimos [3,68,80,82,99-103] 2++ B/√ 1+ A/√ 1+ B/√ 1+/1++ B/√ Se recomienda que una dosis máxima en adultos de 1.500 U de Dysport ® (400 U de Botox ®) por sesión de tratamiento y de 250 U de Dysport (50 U de Botox) por punto de inyección. La dosis máxima por músculos es de 6 U/kg en músculos grandes y de 2 U/kg en músculos pequeños, sin superar las 300-400 U totales de Dysport (80-100 de Botox) por músculo. 4 D/√ La inyección de la toxina lo más cerca posible de la unión neuromuscular es más efectiva que su administración a mayor distancia, por lo que se recomienda inyectar la toxina en la mitad del vientre muscular 4 D/√ En músculos grandes, se recomienda la infiltración en varios puntos y evitar inyectar volúmenes superiores a 1 mL en cada uno. De este modo, se evita la difusión de la toxina a los músculos adyacentes y su exposición al sistema inmunitario. En cambio, en los músculos de pequeño tamaño se infiltrará en un único punto, con volúmenes aproximados de 0,1-0,2 mL 4 D/√ 2++ B/√ El tratamiento combinado de THC + CBD (nabiximol) mostró reducir de forma significativa la espasticidad debida a la EM y refractaria a los tratamientos convencionales (baclofeno, diacepam, tizanidina, gabapentina o combinaciones de ellos) [104-106] Cannabinoides Pulverización en espray bucal (THC+ CBD) Asimismo, también se observó que THC + CBD mejoró significativamente la calidad del sueño de los pacientes [107] Se recomienda en el tratamiento de la espasticidad, combinado en espray de THC + CBD, que se evalúe la respuesta terapéutica a las cuatro semanas, y considerar su interrupción si la reducción de la espasticidad no alcanza el 20% de la presentada por el paciente al iniciar el tratamiento [108,109] En pacientes de EM que expresan una espasticidad focal, la terapia local de administración parenteral de elección es la toxina botulínica, al mostrarse segura cuando se usa en las dosis recomendadas y tiene efectos secundarios limitados [13,14,73,82,87, 110-137] Toxina botulínica Baclofeno intratecal Intramuscular Intratecal En pacientes de EM que expresan una espasticidad grave, con la movilidad limitada, de larga evolución o generalizada y resistente a tratamientos orales, se recomienda el tratamiento de la espasticidad mediante la colocación de una bomba de baclofeno intratecal [55,66,99,138-141] – La indicación de los fármacos orales en pacientes con espasticidad focal debe incluir una vigilancia en la incidencia de los efectos adversos relacionados con el aumento de la dosis, que puede limitar su indicación [79,80] (NE 1++; GR A/√). www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 – Las recomendaciones en la terapia de la espasticidad de los pacientes con EM coinciden en considerar el baclofeno y la tizanidina como los medicamentos orales de uso más común en primera línea para reducir la espasticidad (NE 4; GR D). 367 C. Oreja-Guevara, et al Figura 2. Algoritmo terapéutico consensuado por el grupo de expertos. Algoritmo terapéutico consensuado por el grupo de expertos Se ha consensuado un algoritmo (Fig. 2) para facilitar la decisión del tratamiento de la espasticidad. Primero, se debe analizar si hay factores desencadenantes de la espasticidad y si es necesario empezar con fisioterapia. Si ésta no fuera lo suficientemente útil, se pasaría al tratamiento farmacológico. Si la espasticidad es focal o regional, se miraría el tipo de contractura; si es dinámica se trataría con toxina botulínica y fisioterapia y si es fija, con yesos seriados. Si todo esto fallara, se plantearía la cirugía ortopédica. Si la espasticidad es generalizada, se empezará el tratamiento farmacológico usando baclofeno oral o tizanidina hasta llegar a la dosis que más efecto haga con efectos secundarios tolerables. Si el paciente, a pesar de todo, no responde a alguno de estos tratamientos, se plantean dos opciones posibles: añadir THC + CBD (Sativex ®) al fármaco que el paciente tiene en ese momento o hacer tratamiento combinado de baclofeno oral y tizanidina. Si una de estas opciones no funciona, se puede pasar a la otra (de Sativex a tratamiento combinado o a la inversa). Si todo lo anterior falla, habría que valorar otras combinaciones posibles con fármacos menos eficaces o valorar el baclofeno intratecal. Medicina física y rehabilitación – El Consejo Asesor de Esclerosis Múltiple en Estados Unidos recomienda un tratamiento escalonado, en el que los fármacos son probados individualmente de forma secuencial antes de proceder a una terapia combinada (NE 4; GR D). – Se recomienda que la elección de los fármacos sea individualizada a cada paciente y es aconsejable como terapia inicial baclofeno o tizanidina (NE 4; GR D). En la tabla IV, se muestran las recomendaciones de tratamiento farmacológico para la espasticidad. 368 Generalidades La rehabilitación es fundamental en el abordaje de la espasticidad en la EM, tanto focal como generalizada, desde su inicio y durante todas las etapas evolutivas de la enfermedad. Debe ser un tratamiento integrado y coordinado con los tratamientos farmacológicos de la EM y concebido por un equipo multidisciplinar. Debido a las características evolutivas de la enfermedad, encontraremos a lo largo de la vida del paciente el efecto acumulativo de múltiples lesiones a diferentes niveles que determinan una multiplicidad de déficit que variará el grado de discapacidad y minusvalía. En algún caso, la intervención sobre un déficit puede empeorar otro. El abordaje rehabilitador contempla varias áreas, como fisioterapia, terapia ocupacional, logopedia y la indicación y adaptación de varias ortesis y ayudas técnicas. No es un tratamiento estático, sino dinámico, y debe modificarse en función de los cambios conseguidos en cada paciente [13,81]. Se recomienda adaptar la rehabilitación a las distintas circunstancias que la evolución de la enfer- www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 Documento de consenso sobre la espasticidad en pacientes con esclerosis múltiple Tabla V. Resumen de tratamientos basados en medicina física y rehabilitación. Recomendación NE GR Se recomienda aplicar estrategias de rehabilitación con el objetivo de optimizar la función y minimizar la discapacidad secundaria debida a la espasticidad. En espasticidad focal, mediante un programa de rehabilitación especializada junto con bloqueos neuromusculares focales. En espasticidad generalizada, con un programa de rehabilitación especializada 4 D/√ Rango de movimiento Se recomienda iniciar técnicas de rango de movimiento, lo más pronto posible en el caso de articulaciones con riesgo de restricción completa. Estas movilizaciones articulares, mediante el empleo de una fuerza ajena al paciente, deben realizarse correctamente para no favorecer la aparición de osificaciones de partes blandas 4 D Estiramiento Debe mantenerse el estiramiento a fin de impactar en la espasticidad: con técnicas manuales podemos mantener el estiramiento durante más de un minuto, o bien podemos realizar un estiramiento prolongado (horas) mediante una férula. Los estiramientos de la musculatura espástica son la modalidad terapéutica más utilizada y su efecto en el tono muscular oscila entre los 30 minutos y las 6 horas [31] Fortalecimiento Se recomienda iniciar empezar de forma precoz con programas de fortalecimiento orientados a optimizar la fuerza de los músculos espásticos y evitar que el programa de fortalecimiento aumente la fatiga del paciente 4 D Presión/golpe suave La presión/golpe suave puede ser un complemento para mejorar el estiramiento de los músculos y el rango de movimiento de la articulación [31] Crioterapia Se recomienda la natación o la actividad física en piscinas frías (26,6-27,7 °C) para estirar activamente los músculos espásticos y mantener/aumentar la resistencia. Las aplicaciones locales de frío pueden recomendarse para obtener un alivio temporal en los espasmos y la espasticidad de músculos localizados. Los primeros estudios sobre el uso de prendas frías resultan prometedores en términos de la reducción a corto plazo de la espasticidad. Se utilizan distintos protocolos, pero básicamente los tiempos de aplicación de frío varían de 15 a 30 minutos, y el efecto antiespástico obtenido dura de 30 minutos a 2 horas tras su aplicación. En algunos pacientes, se puede observar la desaparición total de la espasticidad durante unas diez horas después de un baño frío. Siempre que sea posible, se efectuará una sesión de fisioterapia tras la sesión de crioterapia para permitir una rehabilitación más activa [11] Termoterapia No se recomienda el uso de calor para tratar la espasticidad en pacientes con EM 4 D/√ Vibroterapia Actúa por su efecto inhibidor sobre el reflejo miotático. Se utiliza en espasticidad muy precoz, muy localizada y muy molesta (flexores de muñeca y dedos o tríceps sural). Otros autores refieren que no se ha demostrado que el tratamiento de vibración del cuerpo aporte efectos sobre la espasticidad en pacientes con EM [2] Hidroterapia Hay evidencia de que el uso de la hidroterapia puede producir una disminución significante de la gravedad de los espasmos [17]. 4 D/√ 4 D/√ Técnicas de fisioterapia Técnicas de base Aplicación de agentes físicos Métodos neuromotores Se recomienda basar la indicación de estas técnicas neuromotoras en función de la destreza del fisioterapeuta y de la fase evolutiva del paciente Electroestimulación El uso de la electroestimulación es controvertido, aunque algunos estudios señalan que tiene una eficacia temporal (2-24 h). La estimulación, tanto de la musculatura agonista como de la antagonista, puede reducir la espasticidad [31] Terapia ocupacional Se recomienda la prescripción de entrenamiento y uso de tecnología asistencial de las extremidades superiores e inferiores para optimizar la función en individuos cuya espasticidad ha resultado en limitaciones y discapacidades tratables Ortesis y ayudas técnicas Las ortesis son útiles tanto en la prevención y en la corrección de limitaciones o deformidades articulares como para compensar la paresia. Con su uso, sobre todo nocturno, se pretende mantener una alineación articular correcta y el estiramiento de los músculos espásticos. La aplicación aislada de ortesis no está indicada en casos de espasticidad aguda o en aquellos pacientes con lesiones cutáneas [2] Tratamiento quirúrgico Se recomienda que estos procedimientos sólo se consideren en los individuos cuidadosamente seleccionados refractarios a otras estrategias de manejo www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 369 C. Oreja-Guevara, et al medad condiciona en cada paciente, considerando que en algún caso la intervención sobre un déficit puede empeorar otro (NE 4; GR D). Estrategias – Prevenir déficits secundarios: contracturas articulares derivadas de la espasticidad. – Entrenar nuevas habilidades para que el paciente pueda mantener una función (potenciar sistemas sanos o la capacidad funcional de los afectados). – Compensar con ayudas técnicas sistemas que no se pueden reeducar. – Instruir al cuidador para que realice el correcto manejo del paciente (estimulando la autonomía de éste). Tipos de intervenciones – Fisioterapia. – Terapia ocupacional. – Logopedia. – Ortesis y ayudas técnicas. En la tabla V se muestra un resumen de los tratamientos basados en medicina física y rehabilitación. Conclusiones La espasticidad es un síntoma crónico que puede causar dolor, espasmos, trastorno de la marcha, alteraciones urinarias y alteraciones del sueño que llevan a un empeoramiento de la calidad de vida del paciente. En la actualidad, su alcance global no está bien determinado y se dispone de pocos estudios con resultados muy diversos. Por eso, en este documento de consenso se incluye una gran cantidad de recomendaciones emitidas por los expertos participantes en el mismo y 13 de ellas se basan en referencias previamente categorizadas por un nivel de evidencia inferior a 4. Las recomendaciones contenidas en este consenso pueden ser una herramienta útil para la mejora de la calidad de vida del paciente con EM, ya que permiten un mejor diagnóstico y tratamiento de la espasticidad y los síntomas relacionados. Este consenso pone en evidencia la necesidad de continuar con el desarrollo de nuevos estudios para mejorar el manejo y el tratamiento de la patología. Bibliografía 1. Noseworthy JH, Lucchinetti C, Rodriguez M, Weinshenker BG. Multiple sclerosis. N Engl J Med 2000; 343: 938-52. 2. Samkoff LM GA. Symptomatic management in multiple sclerosis. Neurol Clin 2011; 29: 449-63. 370 3. De Sa JC, Airas L, Bartholome E, Grigoriadis N, Mattle H, Oreja-Guevara C, et al. Symptomatic therapy in multiple sclerosis: a review for a multimodal approach in clinical practice. Ther Adv Neurol Disord 2011; 4: 139-68. 4. Pugliatti M, Rosati G, Carton H, Riise T, Drulovic J, Vecsei L, et al. The epidemiology of multiple sclerosis in Europe. Eur J Neurol 2006; 13: 700-22. 5. Ares B PJ, Lema M, Dapena D, Arias M, Noya M. Prevalence of multiple sclerosis in Santiago de Compostela (Galicia, Spain). Mult Scler 2007; 13: 262-4. 6. Morís G, Berciano J, Miró J. A clinical longitudinal study of multiple sclerosis in Cantabria, Spain. Neurología 2003; 18: 723-30. 7. Modrego Pardo PJ, Latorre MA, Lopez A, Errea JM. Prevalence of multiple sclerosis in the province of Teruel, Spain. J Neurol 1997; 244: 182-5. 8. Aladro Y, Alemany MJ, Pérez-Vieitez MC, Amela R, Conde M, Reyes MP, et al. Prevalence and incidence of multiple sclerosis in Las Palmas, Canary Islands, Spain. Neuroepidemiology 2005; 24: 70-5. 9. Otero-Romero S, Roura P, Solà J, Altimiras J, Sastre-Garriga J, Nos C, et al. Increase in the prevalence of multiple sclerosis over a 17-year period in Osona, Catalonia, Spain. Mult Scler 2013; 19: 245-8. 10. Fernández O, Fernández V, Guerrero M, León A, LópezMadrona JC, Alonso A, et al. Multiple sclerosis prevalence in Malaga, Southern Spain estimated by the capture-recapture method. Mult Scler 2012; 18: 372-6. 11. Hartung HP. Advances in the management of multiple sclerosis-related spasticity. Expert Rev Neurother 2012; 12: 1. 12. Arroyo R, Vila C, Clissold S. Retrospective observational study of the management of multiple sclerosis patients with resistant spasticity in Spain: the ‘5E’ study. Expert Rev Pharmacoecon Outcomes Res 2011; 11: 205-13. 13. Garreta-Figuera R, Chaler-Vilaseca J, TorrequebradaGiménez A. Guía de práctica clínica del tratamiento de la espasticidad con toxina botulínica. Rev Neurol 2010; 50: 685-99. 14. Vivancos-Matellano F, Pascual-Pascual SI, Nardi-Vilardaga J, Miquel-Rodríguez F, De Miguel-León I, Martínez-Garre MC, et al. Guía del tratamiento integral de la espasticidad. Rev Neurol 2007; 45: 365-75. 15. Murie M, Moral E. Espasticidad en esclerosis múltiple. Madrid: Equalmás 5; 2011. 16. Paisley S, Beard S, Hunn A, Wight J. Clinical effectiveness of oral treatments for spasticity in multiple sclerosis: a systematic review. Mult Scler 2002; 8: 319-29. 17. Multiple Sclerosis Australia. Spasticity and multiple sclerosis. Practice for health professionals. URL: http://www.msaustralia. org.au. 18. Lance JW. The control of muscle tone, reflexes, and movement: Robert Wartenberg Lecture. Neurology 1980; 30: 1303-13. 19. Young RR. Spasticity: a review. Neurology 1994; 44: S12-20. 20. Elbasiouny SM, Moroz D, Bakr MM, Mushahwar VK. Management of spasticity after spinal cord injury: current techniques and future directions. Neurorehabil Neural Repair 2010; 24: 23-33. 21. Young RR, Delwaide PJ. Drug therapy: spasticity (first of two parts). N Engl J Med 1981; 304: 28-33. 22. Brown P. Pathophysiology of spasticity. J Neurol Neurosurg Psychiatry 1994; 57: 773-7. 23. Gracies JM. Pathophysiology of spastic paresis. II: Emergence of muscle overactivity. Muscle Nerve 2005; 31: 552-71. 24. Thompson PD. Rigidity and spasticity. In Jankovic J, Tolosa E, eds. Parkinson’s disease and movement disorders. Baltimore: Williams & Wilkins; 1998. p. 755-62. 25. Fahn S. Generalized dystonia: concept and treatment. Clin Neuropharmacol 1986; 9 (Suppl 2): S37-48. 26. Verplancke D, Snape S, Salisbury CF, Jones PW, Ward AB. A randomized controlled trial of botulinum toxin on lower limb spasticity following acute acquired severe brain injury. Clin Rehabil 2005; 19: 117-25. 27. Herring J. Disorders of the brain. In Herring J, ed. Tachdjian’s pediatric orthopaedics. Chicago: Saunders; 2002. p. 1122-242. www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 Documento de consenso sobre la espasticidad en pacientes con esclerosis múltiple 28. Miller F. Cerebral palsy. New York: Springer-Verlag; 2005. 29. Munuera L. Fisiopatología del aparato de crecimiento. In Munuera L, ed. Introducción a la traumatología y cirugía ortopédica. México: McGraw-Hill/Interamericana; 1997. p. 118-31. 30. Emery D, Wedge J. Orthopaedic management of children with total body involvement cerebral palsy. Mini symposium: cerebral palsy. Curr Orthop 2003; 17: 81-7. 31. Martín-Barriga ML, Martínez ML, De Andrés C. Tratamiento sintomático del dolor, los trastornos paroxísticos, los trastornos motores y la espasticidad en pacientes con esclerosis múltiple. In Prieto-González JM, Arbizu T, eds. Monografías en esclerosis múltiple. Madrid: Acción Médica; 2009. 32. Aguilar-Barberá M, Bori-Fortuny I, García-Aymerich V, García-Ruiz Espiga PJ, Garreta-Figuera R, Herrera-Galante A, et al. Guía terapéutica de la espasticidad del adulto con toxina botulínica. Rev Neurol 2004; 38: 971-8. 33. Hemmett L, Holmes J, Barnes M, Russell N. What drives quality of life in multiple sclerosis? QJM 2004; 97: 671-6. 34. Rizzo MA, Hadjimichael OC, Preiningerova J, Vollmer TL. Prevalence and treatment of spasticity reported by multiple sclerosis patients. Mult Scler 2004; 10: 589-95. 35. Oreja-Guevara C, Gonzalez-Segura D, Vila C. Spasticity in multiple sclerosis: results of a patient survey. Int J Neurosci 2013; 123: 400-8. 36. Haselkorn JK, Balsdon Richer C, Fry Welch D, Herndon RM, Johnson B, Little JW, et al. Overview of spasticity management in multiple sclerosis. Evidence-based management strategies for spasticity treatment in multiple sclerosis. J Spinal Cord Med 2005; 28: 167-99. 37. Bavikatte G, Gaber T. Approach to spasticity in general practice. Br J Med Pract 2009; 2: 29-34. 38. Zwibel HL. Contribution of impaired mobility and general symptoms to the burden of multiple sclerosis. Adv Ther 2009; 26: 1043-57. 39. UNICEF. VIPP: Visualisation in Participatory Planning. Dhaka: UNICEF; 1993. 40. Ashworth B. Preliminary trial of carisoprodol in multiple sclerosis. Practitioner 1964; 192: 540-2. 41. Bohannon RW, Smith MB. Interrater reliability of a modified Ashworth scale of muscle spasticity. Phys Ther 1987; 67: 206-7. 42. Pandyan AD, Johnson GR, Price CI, Curless RH, Barnes MP, Rodgers H. A review of the properties and limitations of the Ashworth and modified Ashworth Scales as measures of spasticity. Clin Rehabil 1999; 13: 373-83. 43. Pandyan AD, Price CI, Barnes MP, Johnson GR. A biomechanical investigation into the validity of the modified Ashworth Scale as a measure of elbow spasticity. Clin Rehabil 2003; 17: 290-3. 44. Fleuren JF, Voerman GE, Erren-Wolters CV, Snoek GJ, Rietman JS, Hermens HJ, et al. Stop using the Ashworth Scale for the assessment of spasticity. J Neurol Neurosurg Psychiatry 2010; 81: 46-52. 45. Ghotbi N, Ansari NN, Naghdi S, Hasson S, Jamshidpour B, Amiri S. Inter-rater reliability of the Modified Ashworth Scale in assessing lower limb muscle spasticity. Brain Inj 2009; 23: 815-9. 46. Ghotbi N, Nakhostin Ansari N, Naghdi S, Hasson S. Measurement of lower-limb muscle spasticity: intrarater reliability of Modified Ashworth Scale. J Rehabil Res Dev 2011; 48: 83-8. 47. Ansari NN, Naghdi S, Arab TK, Jalaie S. The interrater and intrarater reliability of the Modified Ashworth Scale in the assessment of muscle spasticity: limb and muscle group effect. NeuroRehabilitation 2008; 23: 231-7. 48. Sloan RL, Sinclair E, Thompson J, Taylor S, Pentland B. Inter-rater reliability of the modified Ashworth Scale for spasticity in hemiplegic patients. Int J Rehabil Res 1992; 15: 158-61. 49. Platz T, Eickhof C, Nuyens G, Vuadens P. Clinical scales for the assessment of spasticity, associated phenomena, and function: a systematic review of the literature. Disabil Rehabil 2005; 27: 7-18. 50. Blackburn M, Van Vliet P, Mockett SP. Reliability of www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 51. 52. 53. 54. 55. 56. 57. 58. 59. 60. 61. 62. 63. 64. 65. 66. 67. 68. 69. 70. 71. measurements obtained with the modified Ashworth scale in the lower extremities of people with stroke. Phys Ther 2002; 82: 25-34. Haas BM, Bergstrom E, Jamous A, Bennie A. The inter rater reliability of the original and of the modified Ashworth scale for the assessment of spasticity in patients with spinal cord injury. Spinal Cord 1996; 34: 560-4. Craven BC, Morris AR. Modified Ashworth scale reliability for measurement of lower extremity spasticity among patients with SCI. Spinal Cord 2010; 48: 207-13. Farrar JT, Troxel AB, Stott C, Duncombe P, Jensen MP. Validity, reliability, and clinical importance of change in a 0-10 numeric rating scale measure of spasticity: a post hoc analysis of a randomized, double-blind, placebo-controlled trial. Clin Ther 2008; 30: 974-85. Anwar K, Barnes MP. A pilot study of a comparison between a patient scored numeric rating scale and clinician scored measures of spasticity in multiple sclerosis. NeuroRehabilitation 2009; 24: 333-40. Penn RD, Savoy SM, Corcos D, Latash M, Gottlieb G, Parke B, et al. Intrathecal baclofen for severe spinal spasticity. N Engl J Med 1989; 320: 1517-21. Biering-Sorensen F, Nielsen JB, Klinge K. Spasticity-assessment: a review. Spinal Cord 2006; 44: 708-22. Snow BJ, Tsui JK, Bhatt MH, Varelas M, Hashimoto SA, Calne DB. Treatment of spasticity with botulinum toxin: a double-blind study. Ann Neurol 1990; 28: 512-5. Laessoe L, Nielsen JB, Biering-Sorensen F, Sonksen J. Antispastic effect of penile vibration in men with spinal cord lesion. Arch Phys Med Rehabil 2004; 85: 919-24. Boviatsis EJ, Kouyialis AT, Korfias S, Sakas DE. Functional outcome of intrathecal baclofen administration for severe spasticity. Clin Neurol Neurosurg 2005; 107: 289-95. Gianino JM, York MM, Paice JA, Shott S. Quality of life: effect of reduced spasticity from intrathecal baclofen. J Neurosci Nurs 1998; 30: 47-54. Gómez-Soriano J, Cano-de-la-Cuerda R, Muñoz-Hellín E, Ortiz-Gutiérrez R, Taylor JS. Valoración y cuantificación de la espasticidad: revisión de los métodos clínicos, biomecánicos y neurofisiológicos. Rev Neurol 2012; 55: 217-26. Priebe MM, Sherwood AM, Thornby JI, Kharas NF, Markowski J. Clinical assessment of spasticity in spinal cord injury: a multidimensional problem. Arch Phys Med Rehabil 1996; 77: 713-6. Simeoni M, Auquier P, Fernández O, Flachenecker P, Stecchi S, Constantinescu C, et al; MusiQol study group. Validation of the Multiple Sclerosis International Quality of Life questionnaire. Mult Scler 2008; 14: 219-30. Fernández O, Fernández V, Baumstarck-Barrau K, Muñoz L, González-Álvarez MM, Arrabal JC, et al. Validation of the Spanish version of the Multiple Sclerosis International Quality of Life (Musiqol) questionnaire. BMC Neurol 2011; 11: 127. Kabus C, Hecht M, Japp G, Jost WH, Pohlau D, StuckradBarre S, et al. Botulinum toxin in patients with multiple sclerosis. J Neurol 2006; 253 (Suppl 1): I26-8. Beard S, Hunn A, Wight J. Treatments for spasticity and pain in multiple sclerosis: a systematic review. Health Technol Assess 2003; 7: 1-111. Pappalardo F. Pharmacologic management of spasticity in multiple sclerosis. Neurol Sci 2006; 27: S310-5. Dones I, Nazzi V, Broggi G. The guidelines for the diagnosis and treatment of spasticity. J Neurosurg Sci 2006; 50: 101-5. Oreja-Guevara C. Tratamiento de la espasticidad en la esclerosis múltiple: nuevas perspectivas con el uso de cannabinoides. Rev Neurol 2012; 55: 421-30. Oreja-Guevara C. Clinical efficacy and effectiveness of Sativex, a combined cannabinoid medicine, in multiple sclerosisrelated spasticity. Expert Rev Neurother 2012; 12: 3-8. Notcutt W, Langford R, Davies P, Ratcliffe S, Potts R. A placebo-controlled, parallel-group, randomised withdrawal study of subjects with symptoms of spasticity due to multiple sclerosis who are receiving long-term Sativex (nabiximols). Mult Scler 2012; 18: 219-28. 371 C. Oreja-Guevara, et al 72. Robson P. Abuse potential and psychoactive effects of delta-9-tetrahydrocannabinol and cannabidiol oromucosal spray (Sativex), a new cannabinoid medicine. Expert Opin Drug Saf 2011; 10: 675-85. 73. Young R DP. Drug therapy, spasticity. N Engl J Med 1981; 304. 74. Brashear A, Lambeth K. Spasticity. Curr Treat Options Neurol 2009; 11: 153-61. 75. Brin MF AR. Botulinum toxin type A: pharmacology. In Mayer MH, Simpson DM, eds. Spasticity: etiology, evaluation, management and the role of botulinum toxin. New York: We Move; 2002. p. 110-24. 76. Ryll U, Bastiaenen C, De Bie R, Staal B. Effects of leg muscle botulinum toxin A injections on walking in children with spasticity-related cerebral palsy: a systematic review. Dev Med Child Neurol 2011; 53: 210-6. 77. Mueller ME, Gruenthal M, Olson WL, Olson WH. Gabapentin for relief of upper motor neuron symptoms in multiple sclerosis. Arch Phys Rehabil 1997; 78: 521-4. 78. Montane E, Vallano A, Laporte JR. Oral antispastic drugs in nonprogressive neurologic diseases: a systematic review. Neurology 2004; 63: 1357-63. 79. Shakespeare DT, Boggild M, Young C. Anti-spasticity agents for multiple sclerosis. Cochrane Database Syst Rev 2003; 4: CD001332. 80. Rekand T. Clinical assessment and management of spasticity: a review. Acta Neurol Scand Suppl 2010; 190: 62-6. 81. Kushner S. Spasticity. Clinical bulletin information for health professionals. New York: National Multiple Sclerosis Society; 2012. 82. Dario A, Tomei G. A benefit-risk assessment of baclofen in severe spinal spasticity. Drug Saf 2004; 27: 799-818. 83. Pedersen E, Arlien-Soborg P, Grynderup V, Henriksen O. GABA derivative in spasticity. (Beta-(4-chlorophenyl)-gammaaminobutyric acid, Ciba 34.647-Ba). Acta Neurol Scand 1970; 46: 257-66. 84. Dietrichson P. Lioresal ‘Ciba’ (baclofen). A new antispasmodic drug. Tidsskr Nor Laegeforen 1972; 92: 2352-3. 85. Pinto Ode S, Polikar M, Debono G. Results of international clinical trials with Lioresal. Postgrad Med J 1972; 48 (Suppl 5): 18-25. 86. Jones RF, Lance JW. Bacloffen (Lioresal) in the long-term management of spasticity. Med J Aust 1976; 1: 654-7. 87. Simon O, Yelnik AP. Managing spasticity with drugs. Eur J Phys Rehabil Med 2010; 46: 401-10. 88. United Kingdom Tizanidine Trial Group. A double-blind, placebo-controlled trial of tizanidine in the treatment of spasticity caused by multiple sclerosis. Neurology 1994; 44: S70-8. 89. Smith MB, Brar SP, Nelson LM, Franklin GM, Cobble ND. Baclofen effect on quadriceps strength in multiple sclerosis. Arch Phys Med Rehabil 1992; 73: 237-40. 90. Jerusalem F. Double-blind study on the antispastic effect of beta-94-chlorphenyl)-gamma aminobutyric acid (CIBA) in multiple sclerosis. Nervenarzt 1968; 39: 515-7. 91. Smith C, Birnbaum G, Carter JL, Greenstein J, Lublin FD. Tizanidine treatment of spasticity caused by multiple sclerosis: results of a double-blind, placebo-controlled trial. US Tizanidine Study Group. Neurology 1994; 44: S34-43. 92. Sawa GM, Paty DW. The use of baclofen in treatment of spasticity in multiple sclerosis. Can J Neurol Sci 1979; 6: 351-4. 93. Sachais BA, Logue JN, Carey MS. Baclofen, a new antispastic drug. A controlled, multicenter trial in patients with multiple sclerosis. Arch Neurol 1977; 34: 422-8. 94. Duncan GW, Shahani BT, Young RR. An evaluation of baclofen treatment for certain symptoms in patients with spinal cord lesions. A double-blind, cross-over study. Neurology 1976; 26: 441-6. 95. Feldman RG, Kelly-Hayes M, Conomy JP, Foley JM. Baclofen for spasticity in multiple sclerosis. Double-blind crossover and three-year study. Neurology 1978; 28: 1094-8. 96. Hudgson P, Weightman D. Baclofen in the treatment of spasticity. Br Med J 1971; 4: 15-7. 97. Milanov I, Georgiev D. Mechanisms of tizanidine action on spasticity. Acta Neurol Scand 1994; 89: 274-9. 372 98. Kamen L, Henney HR 3rd, Runyan JD. A practical overview of tizanidine use for spasticity secondary to multiple sclerosis, stroke, and spinal cord injury. Curr Med Res Opin 2008; 24: 425-39. 99. Lapeyre E, Kuks JB, Meijler WJ. Spasticity: revisiting the role and the individual value of several pharmacological treatments. NeuroRehabilitation 2010; 27: 193-200. 100.Groves L, Shellenberger MK, Davis CS. Tizanidine treatment of spasticity: a meta-analysis of controlled, double-blind, comparative studies with baclofen and diazepam. Adv Ther 1998; 15: 241-51. 101.Chou R, Peterson K, Helfand M. Comparative efficacy and safety of skeletal muscle relaxants for spasticity and musculoskeletal conditions: a systematic review. J Pain Symptom Manage 2004; 28: 140-75. 102.Bes A, Eyssette M, Pierrot-Deseilligny E, Rohmer F, Warter JM. A multi-centre, double-blind trial of tizanidine, a new antispastic agent, in spasticity associated with hemiplegia. Curr Med Res Opin 1988; 10: 709-18. 103.Schmidt RT, Lee RH, Spehlmann R. Comparison of dantrolene sodium and diazepam in the treatment of spasticity. J Neurol Neurosurg Psychiatry 1976; 39: 350-6. 104.Wade DT, Makela P, Robson P, House H, Bateman C. Do cannabis-based medicinal extracts have general or specific effects on symptoms in multiple sclerosis? A double-blind, randomized, placebo-controlled study on 160 patients. Mult Scler 2004; 10: 434-41. 105.Lakhan SE, Rowland M. Whole plant cannabis extracts in the treatment of spasticity in multiple sclerosis: a systematic review. BMC Neurol 2009; 9: 59. 106.Wade DT, Collin C, Stott C, Duncombe P. Meta-analysis of the efficacy and safety of Sativex (nabiximols), on spasticity in people with multiple sclerosis. Mult Scler 2010; 16: 707-14. 107.Ambler Z, Davies P, Gasperini C. A two-phase study of Sativex in the relief of spasticity due to multiple sclerosis: phase A single-blind response assessment followed by phase B double-blind, randomised, placebo-controlled, parallel-group study. Mult Scler 2009; 15: S258. 108.Montalban X, Wright S. Trial period for new symptomatic treatments: lessons learnt from a Sativex in MS spasticity clinical trial [abstract]. 25th Congress of the European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS). Dusseldorf, Alemania, septiembre de 2009. 109.Novotna A, Mares J, Ratcliffe S, Novakova I, Vachova M, Zapletalova O, et al. A randomized, double-blind, placebocontrolled, parallel-group, enriched-design study of nabiximols (Sativex), as add-on therapy, in subjects with refractory spasticity caused by multiple sclerosis. Eur J Neurol 2011; 18: 1122-31. 110.Burchiel KJ, Hsu FP. Pain and spasticity after spinal cord injury: mechanisms and treatment. Spine 2001; 26: S146-60. 111.Kita M, Goodkin DE. Drugs used to treat spasticity. Drugs 2000; 59: 487-95. 112.Francisco GE, Yablon SA, Schiess MC, Wiggs L, Cavalier S, Grissom S. Consensus panel guidelines for the use of intrathecal baclofen therapy in poststroke spastic hypertonia. Topics Stroke Rehabil 2006; 13: 74-85. 113.Simpson DM, Alexander DN, O’Brien CF, Tagliati M, Aswad AS, Leon JM, et al. Botulinum toxin type A in the treatment of upper extremity spasticity: a randomized, double-blind, placebo-controlled trial. Neurology 1996; 46: 1306-10. 114.Brashear A, Gordon MF, Elovic E, Kassicieh VD, Marciniak C, Do M, et al. Intramuscular injection of botulinum toxin for the treatment of wrist and finger spasticity after a stroke. N Engl J Med 2002; 347: 395-400. 115.Brin M, Aoki R. Botulinum toxin type A: pharmacology. In Mayer MH, Simpson DM, eds. Spasticity: etiology, evaluation, management and the role of botulinum toxin. New York: We Move; 2002. p. 110-24. 116.Brin MF. Botulinum toxin: chemistry, pharmacology, toxicity and immunology. Muscle Nerve 1997; 6: S146-68. 117.Yelnik AP, Simon O, Bensmail D, Chaleat-Valayer E, Decq P, Dehail P, et al. Drug treatments for spasticity. Ann Phys Rehabil Med 2009; 52: 746-56. www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 Documento de consenso sobre la espasticidad en pacientes con esclerosis múltiple 118.Simpson DM, Gracies JM, Yablon SA, Barbano R, Brashear A; BoNT/TZD Study Team. Botulinum neurotoxin versus tizanidine in upper limb spasticity: a placebo-controlled study. J Neurol Neurosurg Psychiatry 2009; 80: 380-5. 119.Bakheit AM, Pittock S, Moore AP, Wurker M, Otto S, Erbguth F, et al. A randomized, double-blind, placebo-controlled study of the efficacy and safety of botulinum toxin type A in upper limb spasticity in patients with stroke. Eur J Neurol 2001; 8: 559-65. 120.Bakheit AM, Thilmann AF, Ward AB, Poewe W, Wissel J, Muller J, et al. A randomized, double-blind, placebo-controlled, dose-ranging study to compare the efficacy and safety of three doses of botulinum toxin type A (Dysport) with placebo in upper limb spasticity after stroke. Stroke 2000; 31: 2402-6. 121.Bhakta BB, Cozens JA, Chamberlain MA, Bamford JM. Impact of botulinum toxin type A on disability and career burden due to arm spasticity after stroke: a randomised double blind placebo controlled trial. J Neurol Neurosurg Psychiatry 2000; 69: 217-21. 122.Bhakta BB, O’Connor RJ, Cozens JA. Associated reactions after stroke: a randomized controlled trial of the effect of botulinum toxin type A. J Rehabil Med 2008; 40: 36-41. 123.Elovic EP, Brashear A, Kaelin D, Liu J, Millis SR, Barron R, et al. Repeated treatments with botulinum toxin type a produce sustained decreases in the limitations associated with focal upper-limb poststroke spasticity for caregivers and patients. Arch Phys Med Rehabil 2008; 89: 799-806. 124.Francisco GE, Boake C, Vaughn A. Botulinum toxin in upper limb spasticity after acquired brain injury: a randomized trial comparing dilution techniques. Am J Phys Med Rehabil 2002; 81: 355-63. 125.Gordon MF, Brashear A, Elovic E, Kassicieh D, Marciniak C, Liu J, et al. Repeated dosing of botulinum toxin type A for upper limb spasticity following stroke. Neurology 2004; 63: 1971-3. 126.Hesse S, Reiter F, Konrad M, Jahnke MT. Botulinum toxin type A and short-term electrical stimulation in the treatment of upper limb flexor spasticity after stroke: a randomized, doubleblind, placebo-controlled trial. Clin Rehabil 1998; 12: 381-8. 127.Kong KH, Neo JJ, Chua KS. A randomized controlled study of botulinum toxin A in the treatment of hemiplegic shoulder pain associated with spasticity. Clin Rehabil 2007; 21: 28-35. 128.Lim JY, Koh JH, Paik NJ. Intramuscular botulinum toxin-A reduces hemiplegic shoulder pain: a randomized, double-blind, comparative study versus intraarticular triamcinolone acetonide. Stroke 2008; 39: 126-31. 129.Marco E, Duarte E, Vila J, Tejero M, Guillén A, Boza R, et al. Is botulinum toxin type A effective in the treatment of spastic shoulder pain in patients after stroke? A double-blind randomized clinical trial. J Rehabil Med 2007; 39: 440-7. 130.Rousseaux M, Kozlowski O, Froger J. Efficacy of botulinum toxin A in upper limb function of hemiplegic patients. J Neurol 2002; 249: 76-84. 131.Smith SJ, Ellis E, White S, Moore AP. A double-blind placebocontrolled study of botulinum toxin in upper limb spasticity after stroke or head injury. Clin Rehabil 2000; 14: 5-13. 132.Yelnik AP, Colle FM, Bonan IV, Vicaut E. Treatment of shoulder pain in spastic hemiplegia by reducing spasticity of the subscapular muscle: a randomised, double blind, placebo controlled study of botulinum toxin A. J Neurol Neurosurg Psychiatry 2007; 78: 845-8. 133.Rosales RL, Chua-Yap AS. Evidence-based systematic review on the efficacy and safety of botulinum toxin-A therapy in post-stroke spasticity. J Neural Transm 2008; 115: 617-23. 134.Burbaud P, Wiart L, Dubos JL, Gaujard E, Debelleix X, Joseph PA, et al. A randomised, double blind, placebo controlled trial of botulinum toxin in the treatment of spastic foot in hemiparetic patients. J Neurol Neurosurg Psychiatry 1996; 61: 265-9. 135.Hyman N, Barnes M, Bhakta B, Cozens A, Bakheit M, Kreczy-Kleedorfer B, et al. Botulinum toxin (Dysport) treatment of hip adductor spasticity in multiple sclerosis: a prospective, randomised, double blind, placebo controlled, dose ranging study. J Neurol Neurosurg Psychiatry 2000; 68: 707-12. 136.Rousseaux M, Compere S, Launay MJ, Kozlowski O. Variability and predictability of functional efficacy of botulinum toxin injection in leg spastic muscles. J Neurol Sci 2005; 232: 51-7. 137.Yelnik A, Colle F, Bonan I, Bradai N. Efficacy at six months of the botulinum toxin A in the post-stroke lower limb’s muscular overactivity. Ann Readapt Med Phys 2002; 45: 159-65. 138.Porter B. A review of intrathecal baclofen in the management of spasticity. Br J Nurs 1997; 6: 253-60, 62. 139.Sadiq SA, Wang GC. Long-term intrathecal baclofen therapy in ambulatory patients with spasticity. J Neurol 2006; 253: 563-9. 140.Hsieh JC, Penn RD. Intrathecal baclofen in the treatment of adult spasticity. Neurosurg Focus 2006; 21: e5. 141.Erwin A, Gudesblatt M, Bethoux F, Bennett SE, Koelbel S, Plunkett R, et al. Intrathecal baclofen in multiple sclerosis: too little, too late? Mult Scler 2011; 17: 623-9. Consensus document on spasticity in patients with multiple sclerosis Introduction. Multiple sclerosis is a chronic neurological inflammatory demyelinating disease. Specialists involved in the symptomatic treatment of this disease tend to apply heterogeneous diagnostic and treatment criteria. Aim. To establish homogeneous criteria for treating spasticity based on available scientific knowledge, facilitating decisionmaking in regular clinical practice. Development. A group of multiple sclerosis specialists from the Spanish Neurological Society demyelinating diseases working group met to review aspects related to spasticity in this disease and draw up the consensus. After an exhaustive bibliographic search and following a metaplan technique, a number of preliminary recommendations were established to incorporate into the document. Finally, each argument was classified depending on the degree of recommendation according to the SIGN (Scottish Intercollegiate Guidelines Network) system. The resulting text was submitted for review by the demyelinating disease group. An experts’ consensus was reached regarding spasticity triggering factors, related symptoms, diagnostic criteria, assessment methods, quality of life and therapeutic management (drug and non-drug) criteria. Conclusion. The recommendations included in this consensus can be a useful tool for improving the quality of life of multiple sclerosis patients, as they enable improved diagnosis and treatment of spasticity. Key words. Diagnosis. Multiple sclerosis. Nabiximols. Spasticity. Symptoms. Treatment. www.neurologia.com Rev Neurol 2013; 57 (8): 359-373 373
© Copyright 2026