Modelo atómico actualizado
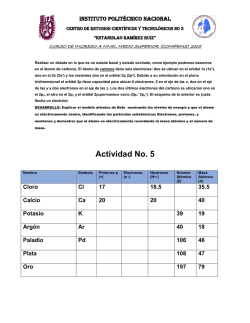
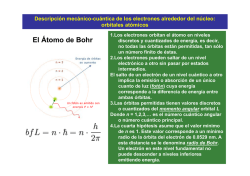
Modelo atómico actual • El modelo atómico de Bohr puede explicar perfectamente la composición del átomo de hidrógeno ya que tiene sólo 1 e-, pero no sirve para la demostración de los demás átomos. • El modelo atómico actual se basa en la mecánica cuántica y es conocido como el modelo atómico de orbitales. Ha sido expuesto por las ideas de científicos como: E. Schrödinger y Heisenberg. Este modelo establece una serie de postulados, de los que cabe recalcar los siguientes: 1. El electrón se comporta como una onda* en su movimiento alrededor del núcleo. *Al topar con el borde de un obstáculo deja de ir en línea recta para rodearlo 2. No es posible predecir la trayectoria exacta del electrón alrededor del núcleo. 3. Existen varias clases de orbitales que se diferencian por su forma y orientación en el espacio. Así decimos que hay orbitales: s, p, d y f 4. En cada nivel energético hay un número determinado de orbitales de cada clase. El orbital s puede tomar 1 sola posición por lo que tiene sólo 1 orbital. El orbital p puede tomar 3 posiciones, por lo que tiene 3 orbitales. El orbital d puede tomar 5 posiciones, por lo que tiene 5 orbitales. El orbital f puede tomar 7 posiciones, por lo que tiene 7 orbitales. 5. Un orbital atómico es la región del espacio donde existe una probabilidad aceptable de que se encuentre un electrón. En cada orbital no puede encontrarse más de dos electrones. Diferencia entre órbita y orbitales. • Órbita: describe una trayectoria, por lo que se puede predecir dónde se encontrará un cuerpo en un tiempo determinado. • Orbitales: no representan una trayectoria definida, sino que sólo muestran donde es más probable encontrar un e- Representemos el átomo de sodio: • Na: 11 p+, 11e-, 12n° MATERIALES PARA MIÉRCOLES 1 DE ABRIL. • Información sobre la descripción de los modelos atómicos de Dalton, Thomson, Rutherford, Bohr y Schrödinger. • Una imagen de cada uno de los personajes nombrados. • 1 pliego de cartulina blanca. • Papeles lustres de colores. • Pegamento. • Tijeras. • Plumones o lápices scripto. Estructura atómica y tabla periódica • Los átomos contienen partículas en cantidades determinadas. • La cantidad de estas partículas nos darán la información sobre su el tipo de carga que tiene y sobre el elemento químico a que corresponde. Ahora… ¿cómo sabremos la cantidad específica de partículas que posee un átomo? • La cantidad de partículas (e-, p+, n°) que posee un átomo, la sabremos con los datos que están estipulados en la tabla periódica. De manera que…. • Z nos indicará la cantidad de p+ • A nos presenta el número atómico (peso atómico o número másico), es decir, a los p+ + los n° que se encuentran en el núcleo. • Y la cantidad de e- será igual que la cantidad de p+ si el átomo es neutro. Es decir que… p+ = Z n° = A – Z e- = p+ (en átomo neutro) Por ejemplo: p+ = n° = e- = • Si el átomo no es neutro, estará indicado por q de la siguiente manera: q : carga eléctrica • De esta manera la cantidad de ecalculará de la siguiente manera: E- = (p+ - (q)) • Z= • A= • q= • Entonces tenemos: p+= e-= n°= Iones • Si la cantidad de e- y p+ es igual, el átomo será de carga neutra. • Si la cantidad de e- es mayor que los p+, el átomo tendrá carga negativa (-) y se llamará anión. • Si la cantidad de e- es menor que los p+, el átomo tendrá carga positiva (+) y se llamará catión. Tenemos entonces que… Átomo neutro e- = p+ ión anión catión e- > p+ e- < p+ Actividad: • Determina la cantidad de partículas de los siguientes átomos y señala si es átomo neutro, anión o catión. Ne: Z= 10 A= 22 C: Z= 6 A= 12 Ga: Z=31 A= 69 q= +3 N: Z=7 A= 14 q= -1 • En la tabla periódica, los elementos químicos están ordenados en relación al z (de menor a mayor), en períodos (filas horizontales) y en grupos (columnas verticales). • Los elementos químicos pueden combinarse de distintas maneras, constituyendo así compuestos químicos. Por ejemplo: H2O Enlaces químicos • Los átomos de los diferentes elementos químicos, forman enlaces a partir de los electrones de sus orbitales. • De esta manera se originan 3 tipos de enlaces: Enlace iónico: • Ocurre por la ganancia o pérdida de electrones entre iones (cationes y aniones). Enlace covalente • Los e- son más bien compartidos que transferidos. • Comparten 2 o más e- de su capa más externa para formar una molécula estable. • Se da entre dos átomos de alta Electronegatividad. Enlace metálico • Ocurre entre metales. • Se da entre dos átomos con baja electronegatividad. Objetivo: • Describir las propiedades a nivel atómico de la materia. Propiedades de la materia a escala atómica. • Conductividad térmica. • Conductividad eléctrica. • Emisión y absorción de luz. Conducción térmica. • Los átomos tienen la capacidad de conducir energía en forma de calor. Esto lo hacen a través del movimiento de sus partículas. • La conducción térmica se da mediante el contacto entre los cuerpos, por ejemplo: • Observemos el sgte. video: Conducción eléctrica • Los enlaces de tipo metálico permiten que los electrones que quedan «sueltos» puedan transferir la electricidad más fácilmente. Veamos el siguiente video:
© Copyright 2026