obtención de cultivos iniciadores productores de bacteriocinas de
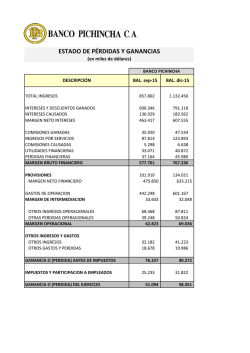
OBTENCIÓN DE CULTIVOS INICIADORES PRODUCTORES DE BACTERIOCINAS DE APLICACIÓN EN LA INDUSTRIA LÁCTEA Armida Zúñiga Estrada1, Eva María Santos López 1, Javier Castro Rosas 1, Humberto Hernández Sánchez 2, Aide Neria Pérez 1 e Irais Sánchez Ortega1. 1 Laboratorio de Biotecnología. Centro de Investigaciones Químicas. Universidad Autónoma del Estado de Hidalgo. 2 Escuela Nacional de Ciencias Biológicas. Instituto Politécnico Nacional. Email: [email protected] RESUMEN Las bacterias ácido lácticas (BAL) son utilizadas en la obtención de alimentos fermentados. Generalmente las BAL se adquieren en forma de cultivos iniciadores liofilizados y de importación. Esto hace que sus costos se eleven y que en ocasiones, debido a las malas condiciones de almacenamiento y transporte, al momento de utilizarse se encuentren inactivos. En este trabajo se integrará una colección de cepas de BAL aisladas de diversos productos fermentados, que se caracterizarán por métodos bioquímicos y moleculares. Paralelamente se efectuará el escrutinio de cepas productoras de bacteriocinas así como el aislamiento e identificación de las bacteriocinas mediante ensayos como detección de actividad bacteriocinogénica, cinéticas de crecimiento y producción de bacteriocinas, purificación parcial y caracterización bioquímica de las bacteriocinas y ensayos de actividad contra bacterias patógenas y deterioradoras en alimentos. La integración de un banco de cepas de BAL productoras de bacteriocinas permitirá a los productores de alimentos fermentados la obtención de cultivos iniciadores de calidad controlada, a bajo costo, que presenten actividad inhibitoria contra microorganismos patógenos o deterioradores. En el estado de Hidalgo se ubican más de un centenar de pequeños productores de lácteos donde la mayoría elaboran su producto de forma artesanal con los riesgos que esto implica como posible presencia de patógenos, fermentaciones anómalas y por lo tanto pérdidas económicas. SUMMARY Lactic acid bacteria are widely used as starter cultures in food industry fermented products. They are usually acquired as imported lyophilised starter cultures. Because of that reason their costs are pretty high and they are frequently inactivated when conditions during transportation and storage are inadequate. The objective of this work is to create a collection of LAB strains, isolated from different fermented products and characterized by biochemical and molecular methods. Also strains which produce bacteriocins will be selected and the bacteriocins will be examined by different tests like detection of bacteriocinogenic activity, growth and bacteriocin production kinetics, partial purification and biochemical characterization of the bacteriocins produced, lyophilization and inhibition activity against different pathogenic and spoilage microorganisms. The formation of a bacteriocin producing LAB collection will allow the producers to obtain starters cultures with inhibitory activity against pathogens and spoilage microorganisms at less costs and high quality. In Hidalgo State there are more than one hundred of dairy producers at small scale which elaborate their products in a traditional way with some associated risks like presence of pathogens in the product, anomalous fermentations, defective products and therefore economical losses. Also the project will be focussed on the consolidation of a research team specialised in Food Microbiology as well as the formation of human resources. INTRODUCCIÓN Durante cientos de años las bacterias ácido lácticas (BAL) han desempeñado un papel importante en la obtención y producción de la mayor parte de los alimentos fermentados. Las BAL son de interés en la industria alimentaria por inducir características organolépticas y estructurales favorables, así como por inhibir el desarrollo de microorganismos no deseables, alterantes y patógenos, lo que sugiere la posibilidad de utilizarlos para extender la vida de anaquel e incrementar la calidad higiénica de los alimentos (Piard y Desmazeud, 1992). Actualmente las BAL son utilizadas como cultivos iniciadores para la obtención de productos lácteos, cárnicos, panadería, vegetales y bebidas alcohólicas; así también son utilizadas como probióticos, (Haveenar y Huist in´t Veld, 1992; Leroy y col., 2002). El grupo de las BAL está conformado por bacterias Gram positivas ya sean cocos, cocobacilos o bacilos, cuyo principal producto de fermentación de los carbohidratos es el ácido láctico. Incluye los géneros: Carnobacteri um, Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Oenococcus, Pediococcus, Streptococcus, Tetragenococcus, Vagococcus y Weissella (Axelsson, 1998). De éstos, las especies que tienen mayor aplicación como cultivos iniciadores son L. lactis, S. thermophilus, L. delbrueckii, L. helveticus, Leuconostoc, L. fermentum, L. plantarum, L. casei, L. bavaricus, L. sakei, L.curvatus y P. pentosaceus, (Johnson y Steele, 2000). Para la identificación de las BAL por lo general se emplean los métodos fenotípicos clásicos, ya que son econó micos y fáciles de realizar. Sin embargo, para alcanzar una correcta clasificación es necesario conjugar diferentes métodos e incluir técnicas moleculares. En relación a técnicas moleculares dirigidas a las BAL, el empleo de sondas ya sean específicas para hibridación in situ (Nissen y Dainty, 1995) o universales (ribotipificación) ha demostrado ser una buena herramienta (Satokari et al., 2000; Björkroth et al., 2000). En los alimentos las BAL propician un ambiente hostil para el crecimiento y la sobrevivencia de otras bacterias, tanto patógenas como de las responsables del deterioro. El efecto inhibitorio no sólo es el resultado de una acidificación del medio, sino también de la producción de ácidos orgánicos, metabolitos del oxígeno, compuestos orgánicos, antibióticos y bacteriocinas (Piard y Desmazeud,1992). Las bacteriocinas, son compuestos de naturaleza proteica producidas por diversas bacterias, que tienen actividad bactericida o bacteriostática contra bacterias sensibles (Klaenhammer, 1988). Numerosas cepas de BAL han sido estudiadas por su bacteriocinogenicidad, principalmente las que se asocian con productos lácteos, ya que son capaces de producir bacteriocinas con actividad contra patógenos transmitidos por los alimentos, tales como Listeria monocytogenes, Staphylococcus aureus, Salmonella typhimurium , Escherichia coli y Clostridium botulinum, así como contra hongos y levaduras (Barefoot y Nettles, 1993; Cutter y Siragusa, 1995). Recientemente se ha puesto mayor énfasis en la identificación de las bacteriocinas y de sus propiedades bioquímicas (espectro de actividad, condiciones de producción, métodos de purificación, estabilidad al pH y a la temperatura, secuencia de aminoácidos, peso molecular y modo de acción) y genéticas (localización del gen de p roducción y parámetros de clonación). Las bacteriocinas producidas por BAL pueden considerarse como conservadores naturales en alimentos, o bien, las cepas productoras pueden emplearse como cultivos iniciadores. Actualmente , el uso de aditivos químicos sintéticos es visto con reticencia por los consumidores que prefieren opciones más naturales. Es por eso que se considera que se tendría mayor confianza con el uso de conservadores naturales como las bacteriocinas (bioconservadores). La nisina, una bacteriocina producida por Lactococcus lactis, ostenta el status de GRAS otorgado por la FDA desde 1988 y se ha probado exitosamente como inhibidor de diferentes especies de Clostridium sp. en quesos. Se considera que otras bacteriocinas y/o las cepas BAL que las producen, como las que se pretenden aislar en este trabajo darían otras alternativas a la industria alimentaria (Gardiner et al., 1998). De ahí el interés por crear un cepario de BAL nativas perfectamente identificadas y caracterizadas que puedan ser utilizadas en productos fermentados como cultivos iniciadores, especialmente aquellas con características antimicrobianas, disponibles para los pequeños productores de alimentos fermentados. Lo anterior permitirá tener un mayor control sobre los procesos de fermentación, incrementar la vida de anaquel del producto terminado, favorecer la calidad microbiológica del producto termi nado y reducir los riesgos a la salud del consumidor. Así también, se contribuye al conocimiento sobre los métodos de conservación y distribución de dichas cepas en forma de cultivos iniciadores, desde el laboratorio hasta la planta de producción. De esta manera, se podrán identificar las cepas BAL nativas desde un punto de vista tecnológico, así como de sus propiedades bacteriocinogénicas. MATERIALES Y MÉTODOS Aislamiento: Las cepas de BAL se aislaron a partir de 33 muestras de productos lácteos: quesos tipo panela, Oaxaca, canasto, manchego, ranchero, botadero, doble crema, cotija, molido, requesón y leche, que fueron adquiridos de diversos lugares del estado de Hidalgo. Para el aislamiento de las BAL se pesaron 10 g de muestra, los cuales se adicionaron a 90 ml de solución diluyente (solución salina al 0.85%), se licuaron durante 30 a 60 seg y se realizaron diluciones 10-1 a 10-3 con solución diluyente. Se inoculó 0.1 ml de cada dilución en placas con agar APN sembrando por el método de siembra en superficie y se incubaron a 30°C durante 72 hr en atmósfera parcial de CO2. Posteriormente, se contaron las colonias presuntivas, se selecciona ron 3 y se resembraron en agar MRS. Se incubaron 24 hr a 30°C en atmósfera parcial de CO2. Se consideraron colonias sospechosas de BAL aquellas que fueron cocos o bacilos Gram positivos, catalasa y oxidasa negativas. Las cepas aisladas se conservaron en congelación, en viales con caldo MRS y 20% de glicerol, hasta su uso. Identificación: La identificación bioquímica de las cepas se realizó mediante el sistema API 50 CHL de bioMérieux. Este es un sistema miniaturizado y semiautomatizado enfocado a la identificación del género Lactobacillus y microorganismos relacionados, en el cual se identifica la capacidad de la bacteria para fermentar los 49 carbohidratos contenidos en la galería. El llenado de los microtubos con el medio 50 CHL, adición del inóculo, incubación, lectura e interpretación de las pruebas se realizó de acuerdo con la metodología que se indica en la ficha técnica correpondiente. Prueba de actividad inhibitoria Antes de realizar estos ensayos, se llevaron a cabo pruebas para verificar la viabilidad y la pureza de las cepas. Las pruebas de actividad antimicrobiana se realizaron con cada una de las cepas BAL aisladas, utilizando la técnica de la doble capa (Montville y Winkowski, 1997). Las cepas viables y puras, fueron sembradas en agar MRS. De cada cepa se seleccionó una colonia y se sembró en un tubo conteniendo 5 mL de caldo MRS modificado y se incubó por 18 h a 25°C Se seleccionó una colonia y se sembró en un tubo conteniendo 5 mL de caldo MRS modificado y se incubó por 18 h a 25°C . Transcurrido este tiempo, se vaciaron 15 mL de agar MRS modificado en cajas Petri, una vez solidificado se dividió el fondo de la placa en cinco segmentos iguales y se depositó cuidadosamente en cada segmento una gota de 1.5 µL de cada caldo de cultivo de la BAL a ensayar, a una distancia suficiente para evitar su confluencia. Se dejó secar unos minutos en campana de flujo laminar y se incubaron a 25°C por 24 h. Una vez crecidas las colonias, en la superficie central del agar se colocó un sensidisco con 7 µL de antibiótico como testigo positivo de la prueba inhibición y toda la superficie del agar se cubrió con una sobre capa de 10 mL de agar Soya Tripticaseína suave (1%), que fue previamente inoculado con 20 µL del microorganismo patógeno y se dejó solidificar durante 20 minutos. Las placas se incubaron por 24 h a 37°C. El efecto antibacteriano se detectó por la presencia de halos de inhibición mayores a 1 mm alrededor de las colonias de BAL. RESULTADOS Y DISCUSIÓN A partir de los 33 productos lácteos descritos en la tabla 1, se aislaron 332 cepas, de las cuales 293 correspondieron a cepas de BAL y 39 se identificaron morfológicamente como levaduras. Una vez purificadas las cepas de BAL por siembra en estría , se seleccionó una colonia cuyas características microscópicas, macroscópicas así como pruebas bioquímicas presuntivas fueron examinadas. Producto lácteo Queso Panela Origen - Mercado deTulancingo - San Miguel Regla - Huehutla - Mercado de Actopan - Mercado de Singuilucan Número de muestras No. de cepas de BAL No. de cepas de levaduras 5 45 5 Queso Oaxaca - Mercado deTulancingo - Mercado de Actopan - Tienda Richis, Tulancingo - Mercado deTulancingo - Mercado de Actopan - Mercado deTulancingo - En una tienda en Actopan - Mercado de Actopan - En una tienda en Singuilucan - Mercado en Tezontepec - En una tienda en Tezontepec - Jaltepec - Mercado deTulancingo - Acatlán - Mercado de Pachuca - Acatlán - Ciudad de México - Central de Abastos de Pachuca 14 132 8 4 30 10 - Mercado de Pachuca 1 12 0 - Mercado de Atotonilco 1 10 0 Queso Ranchero - Pachuca 1 7 3 Queso Botanero - Pachuca 1 7 3 2 17 3 1 5 5 1 9 1 1 9 1 1 10 0 33 293 39 Queso Canasto Queso Doble Crema Leche Queso Manchego Queso Cotija Queso Molido Requesón Queso Blanco - Pachuca - Jaltepec - Tehuacan Puebla - Central de Abastos de Pachuca - Mercado de Tulancingo - Central de abastos de Pachuca Tabla 1. Número de cepas aisladas a partir de productos lácteos Se observó la pureza de las cepas de BAL por la presencia de colonias de color blanco o cremoso, forma redonda, puntiforme, con bordes enteros y con superficie convexa, además de ser cocos o bacilos Gram positivos, catalasa y oxidasa negativas (figura 1). Figura 1. Morfología macroscópica carácterística de las BAL en agar MRS. Se seleccionó el agar MRS (Man-Rogosa-Sharpe) para la purificación de las BAL, debido a que este medio se caracteriza por la presencia de sales en cantidades relativamente importantes, especialmente de magnesio, ya que se ha comprobado que este metal estimula el crecimiento de algunas estreptobacterias como son las BAL (Charles, 1998). Con respecto a la identificación bioquímica de las cepas aisladas, en las figuras 2 y 3 se observa que los géneros identificados fueron Lactobacillus, Leuconostoc, Pediococcus y Carnobacterium; que en general corresponde a los géneros y especies que se asocian con la obtención de productos lácteos. Las especies Lactobacillus plantarum, Leconostoc mesenteroides subesp. mesenteroides y Lactobacillus pentosus son las que se identificaron con mayor frecuencia, con porcentajes del 31%, 27% y 14%, respectivamente . Lactococcus, 11% Leuconostoc, 27% Otras, 1% Sin identificar, 4% Lacobacillus, 57% Figura 2. Distribución de cepas BAL en estudio por género. Lactobacillus curvatus, 2% Lactobacillus rhamnosus, 3% Lactobacillus paracasei subesp. paracasei, Lactococcus lactis subesp. lactis, Lactobacillus brevis, 4% Otras, 1% Sin identificar, Lactobacillus plantarum, 31% Lactococcus raffinolactis, 8% Lactobacillus pentosus, 14% Leuconostoc mesenteroides subesp. mesneteroides, 27% Figura 3. Especies de BAL identificadas bioquímicamente. Para las pruebas de actividad antimicrobiana se eliminó la glucosa de la fórmula del caldo y agar MRS para evitar la producción de ácido láctico, el cual tiene amplio espectro de inhibición cuando se encuentra disociado; sin embargo, la eliminación de este metabolito no impide la formación de otros compuestos inhibitorios. Por lo tanto, puede suponerse que la inhibición de las BAL no se debió a producción del ácido láctico sino a la acción de una bacteriocina u otro metabolito (González y col., 2004). De acuerdo a los resultados de actividad inhibitoria, el 33.2% de las cepas BAL aisladas e identificadas bioquímicamente mostraron actividad en agar MRS modificado, contra al menos uno de los microorganismos de prueba, lo cual se observó mediante la formación de halos de inhibición que variaron de tamaño entre 1 y 8 mm (tabla 2 ). No de cepas con actividad % Lactobacillus plantarum 35 12,5 Leuconostos mesenteroidessubesp mesenteroides 22 7,9 Lactobacillus pentosus 17 6,1 Lactococcus raffinolactis 6 2,1 Lactobacillus brevis 5 1,8 Género y especie Lactococcis lactis subesp lactis 3 1,1 Lactobacillus rhamnosus 3 1,1 Lactobacillus paracasei subesp paracasei 1 0,4 Lactobacillus curvatus 1 0,4 93 33,2 Total Tabla 2. Cepas de BAL que mostraron actividad inhibitoria contra una o màs bacterias patógenas. Los resultados muestran mayor efecto inhibitorio contra los microorganismos Gram negativos, siendo las cepas de Vibrio cholerae las más sensible mientras que E. coli y S. aureus presentaron mayor resistencia al no ser inhibidas por ninguna de las BAL probadas, como se observa en la tabla 3. Existen reportes que presentan estudios sobre la sensibilidad de microorganismos patógenos y/o deterioradores ante las BAL (Yang, 2000; Savadogo y col., 2004; Santillán, 2004). Gonzalez y col., (2004) mostraron la actividad inhibitoria de cepas probióticas, donde la inhibición fue dirigida a 8 microorganismos patógenos (S. typhimurium, S. paratyphi, S. enteritidis, Bacillus cereus, S. aureus, L. monocytogenes, E. coli O157:H7 y Yersinia enterocolitica). Bacterias No. de cepas BAL que produjeron Inhibición % Vibrio cholerae No. O1 Vibrio cholerae O1 Inaba Vibrio parahaemolyticus Vibrio cholerae O1 Ogawa Proteus vulgaris Klebsiella pneumoniae Listeria monocytogenes Scott A Enterobacter aerogenes Salmonella typhimurium ATCC14028 Shigella sonnei Shigella flexneri ATCC9199 Klebsiella pneumoniae ATCC Salmonella thyphi ATCC 6539 Citrobacter freundi Bacillus subtilis Listeria monocytogenes LCDC 81-860 Escherichia coli ATCC11229 39 35 26 22 10 8 7 4 4 2 2 2 2 2 2 2 1 13.9 12.5 8,9 7,5 3,4 2,7 2,4 1,4 1,4 0,7 0,7 0,7 0,7 0,7 0,7 0,7 0,3 Proteus mirabilis Sataphylococcus aureus Escherichia coli 0 0 0 0,0 0,0 0,0 Tabla 3. Bacterias inhibidas por las BAL. Al igual que los resultados de este trabajo, la actividad inhibitoria analizada por González y col., (2004), se inclinó hacia las bacterias Gram negativas, lo que hace sospechar que el mecanismo de acción antimicrobiana no esta relacionado únicamente con la producción de bacteriocinas, ya que posiblemente se originan otros metabolitos de bajo peso molecular los cuales pueden penetrar con mayor facilidad la membrana exterior de la bacteria Gram negativa a diferencia de las bacteriocinas. Estos resultados se atribuyen a las diferencias estructurales que existen entre las bacterias Gram positivas y negativas, ya que las Gram negativas contienen aparte de la pared celular una membrana externa que actúa como barrera selectiva al paso de algunas sustancias (como las bacteriocinas o enzimas). Esta membrana consiste en una bicapa lipídica que contiene fosfolípidos, lipopolisacáridos y proteínas que la atraviesan en todo su espesor y que delimitan poros hidrófilos (porinas) que permiten el paso de sustancias de bajo peso molecular (Prescott y col., 1999). Con respecto a las cepas aisladas por tipo de producto que mostraron mayor actividad inhibitoria, todas las que fueron aisladas del queso botanero mostraron actividad contra de los microorganismos en estudio. Sin embargo con respecto al total de las cepas de BAL estudiadas sólo el 2.39% presentaron el espectro de inhibición. De igual importancia fueron los datos mostrados por el queso blanco y el queso manchego, ya que el 60% y el 52.94% respectivamente de cepas de BAL aisladas, presentaron inhibición antimicrobiana. Siendo el 3.07% para el queso manchego y el 2.05% para el queso blanco del total de las cepas de BAL las que presentaron inhibición (Tabla 4 ). Producto Queso Oaxaca Queso Panela Total de cepas BAL aisladas 132 45 Total de cepas BAL que mostraron actividad inhibitoria 45 15 Porcentaje de cepas BAL que mostraron actividad inhibitoria 34,1 33,3 Queso Canasto 30 3 10,0 Queso Manchego 17 9 52,9 Queso Doble Crema 12 4 33,3 Queso Blanco 10 6 60,0 Leche 10 6 60,0 Queso Molido 9 1 11,1 Requesón 9 1 11,1 Queso Ranchero 7 1 14,3 Queso Botanero 7 7 100,0 Queso Cotija 5 1 20,0 Total 293 99 33,8 Tabla 4 . Cepas de BAL aisladas de productos lácteos que mostraron actividad inhibitoria. Estos resultados son importantes ya que se trata de quesos frescos, los cuales se fermentan de manera natural, sin la adición de cultivos iniciadores. Además los quesos son elaborados artesanalmente por lo que probablemente las condiciones para su fabricación no son las adecuadas ya que la leche utilizada no se pasteuriza sino que solo se calienta, lo que no destruye a las BAL presentes; en algunos casos se elabora el producto con leche cruda, permitiendo que las BAL se encuentren activas durante todo el proceso de fabricación del queso. El desarrollo de las BAL en el queso también es favorecido debido a que generalmente no se refrigera durante su venta. De manera similar a los resultados obtenidos en este trabajo, otros reportes han descrito que las BAL aisladas de diferentes alimentos fermentados, del 10 al 30% muestran actividad inhibitoria contra otras bacterias, mediante la producción de compuestos antimicrobianos como las bacteriocinas (Santillán, 2004). De las BAL aisladas de los productos lácteos, sólo las cepas 1607, 2509 y 1801 aisladas del queso Oaxaca fueron las que presentaron mayor porcentaje de inhibición contra las cepas probadas. Como se menciona en otros ensayos enfocados en la actividad antimicrobiana (De Martinis y col., 2001; Savadogo y col., 2004; Santillán, 2004), en el reporte de Santillán (2004), la cepa de Lactobacillus acidophilus fue capaz de inhibir a las bacterias Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 25923, Klebsiella pneumoniae ATCC 10031 y Escherichia coli ATCC 8739. Las cepas 1607 y 2509 inhibieron a cuatro microorganismos de prueba. Así la cepa 1607 inhibió a V. cholerae no O1, V. cholerae O1 Inaba, P. vulgaris y L. monocytogenes Scott A, mientras que la cepa 2509 mostró actividad antimicrobiana frente a V. cholerae no O1, C. freundii, K. pneumoniae y P. vulgaris, y la cepa 1801 sólo inhibió a V. cholerae no O1, V. cholerae O1 Inaba y P. vulgaris. El resto de las cepas, sólo inhibieron una o dos de las diferentes cepas de los microorganismos estudiados. L. monocytogenes Scott A fue inhibida por las cepas 0103, 0503, 0603, 0606, 1509, 1607 y 2108; el grado de inhibición que se generó contra esta cepa fue de 1 a 6 mm (figura 4) lo cual es interesante, puesto que es una bacteria de particular interés en la salud pública, debido a que es un microorganismo patógeno para el hombre y puede transmitirse a través del consumo alimentos contaminados generando diversos brotes y que tiene la capacidad de sobrevivir y desarrollarse a temperaturas de refrigeración. Figura 4. Inhibición de L. monocytogenes Scott A. CONCLUSIONES Se cuenta con un banco de 280 cepas autóctonas, aisladas de productos lácteos obtenidos artesanalmente, las cuales están identificadas bioquímicamente y ha comenzado su caracterización mediante ribotipificación. Los resultados muestran que el el 33.2% de las cepas BAL aisladas e identificadas bioquímicamente mostraron actividad antibacteriana, contra al menos uno de los microorganismos de prueba. Las muestras de productos lácteos estudiadas contenían BAL capaces de inhibir microorganismos patógenos, como Vibrio cholerae y Listeria monocytogenes, lográndose así la recopilación de un grupo de cepas, las cuales posteriormente podrán ser debidamente caracterizadas en cuanto a su potencial para producir bacteriocinas. Esto permitirá a los productores de alimentos fermentados del Estado de Hidalgo, la obtención de cultivos iniciadores a bajo costo, además de que se podrían utilizar dichas cepas en alimentos contra microorganismos patógenos o deterioradores, disminuyendo el riesgo que implica la presencia de estos tanto en la salud de los consumidores como en los costos de producción. LITERATURA CITADA Axelsson, L. T. (1998). Lactic acid bacteria: classification and physiology. En: Lactic Acid Bacteria, Salminen, S. y von Wrigt, A. (Eds) Marcel Dekker, Nueva York pp. 1-53. Barefoot, S.F. y C.G.Nettles. (1993). Antibiosis revisited: bacteriocins produced by dairy starter cultures. J. Dairy Sci. 76: 2366-2379. Björkroth, K.J., Geisen, R., Schillinger, U., Weiss, N., De Vos, P., Holzapfel, W.H., Korkeala, H.J.,y Vandamme, P., (2000). Characterization of Leuconostoc gasicomitatum sp. nov., associated with spoiled raw tomato-marinated broiler meat strips packaged under modifiedatmosphere conditions. Appl. Envirom. Microbiol. 66, 3764-3772. Cutter, C.N. y G.R. Siragusa. (1995). Population reductions of Gram-negative pathogens following treatments with nisin and under various conditions. J. Food Prot. 58: 977-983. De Martinis, E. C. P., Públio M. R. P., Santarosa P. R. y Freitas F. Z. (2001). Antilisterial activity of lactic acid bacteria isolated from vacuum-packaged brazilian meat and meat products. Brazilian Journal of Microbiology 32(1). Gardiner, G., K. Collins, y C. Stanton. (1998). Development of a probiotic cheddar cheese containing human-derived Lactobacillus paracasei strains. Appl Environ. Microbiol. 64: 21922199. González, M. B. E., Gómez, T. M. y Jiménez, S. Z. (2003). Bacteriocinas de probióticos. Revista Salud Publica y Nutrición 4: 10-20. González, M. B. E., Gómez, t. M. y Jiménez, S. Z. (2004). Actividad antimicrobiana in vitro de cepas de probióticos aisladas de alimentos. Revista Salud Pública y Nutrición. Edición Especial No. 4-2005. Haveenar, R. y J.H.J Huist in´t Veld. (1992). Probiotics, the scientific basis. (R. Fuller, ed.). Chapmann & Hall, London. Johnson, M.E. y Steele J.L., 2000. Producto lácteos fermentados. En: Doyle, M.P., Beuchat, L.R., Montville, T.J., (Ed), Microbiología de los alimentos. Fundamentos y fronteras, Acribia, Zaragoza, pp. 343-353. Klaenhammer, T.R. (1988). Bacteriocins of lactic acid bacteria. Biochimie 70:337-349. Leroy, F., Degeest, B. y De Vuyst, L. (2002). A novel area of predictive modeling: describing the functionality of benefical microorganisms in foods. International Journal of Food Microbiology 73; 251-259. Montville, T.J. y Winkowski, K. (1997). Biologically based preservation systems and probiotic bacteria. En: Food microbiology, fundaments and frontiers. Doyle, M.P., Beuchat, L.R. y Montiville, T.J. (Eds). ASM Press, Washington, D.C. pp. 557-577. Nissen, H.y Dainty, R. (1995). Comparison of the use of rRNA probes and conventional methods in identifying strains of Lactobacillus sake and L. curvatus isolated from meat. Int. J. Food Microbiol. 25, 311-315. Piard, J. C. y Desmazeud, M. (1992). Inhibiting factors produced by Lactic acid bacteria 2. Bacteriocins and other antibacterial substances. Lait 72:113-142. Prescott, L. M., Harley, J. P. y Klein, D. A. (1999). Microbiología, Cuarta edición. (Eds). Mc Graw Hill Interamericana, Zaragoza España pp. 955-957. Santillán, M. A. (2004). Aislamiento y caracterización de cepas bacterias ácido lácticas productoras de bacteriocinas. Tesis de Licenciatura. Universidad Autónoma del Estado de Hidalgo pp. 1-11. Satokari, R., Mattila-Sandholm, T. y Suihko, M.L. (2000). Identification of pediococci by ribotyping. J. Appl. Microbiol. 88, 260-265. Savadogo. A., Ouattara C. A. T., Bassole I. H. N. y Traore A. S. (2004). Antimicrobial activities of lactic acid bacteria strains isolated from burkina faso fermented milk. Pakistan Journal of Nutrition 3 (3):174-179. Schillinger, U., Geisen, R. y Holzapfel, W. H. (1996). Potential of antagonistic microorganisms and bacteriocinas for the biological preservation of foods. Trends in Food Science & Technology May 7;158-164. Soomro, A.H., Masud T., y Anwaar K. (2002). Role of lactic acid bacteria (LAB) in food preservation and human health. Pakistan Journal of Nutrition 1(1): 20-24. Yang, Z. (2000). Antimicrobial compounds and extracellular polysaccharides produced by lactic acid bacteria: Structures and properties University of Helsinki. Department of Food Technology pp. 9-13.
© Copyright 2026