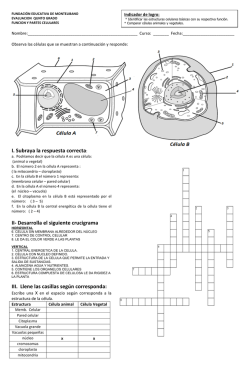
quimica mod 1 - ATE Bahia Blanca
Material de distribución gratuita 3 MODALIDAD SEMIPRESENCIAL Te rc e r C i c l o d e E d u c a c i ó n G e n e ra l B á s i c a p a ra Ad u l t o s Ciencias Naturales 3 Ciencias Naturales 3 Ciencias Naturales Tercer Ciclo de Educación General Básica para Adultos MODALIDAD SEMIPRESENCIAL 3 Ministro de Educación de la Nación Prof. Dr. Hugo Oscar Juri Secretario de Educación Básica Lic. Andrés Delich Subsecretario de Educación Básica Lic. Gustavo Iaies [email protected] Material elaborado por los Equipos Técnicos del Programa de Acciones Compensatorias en Educación del Ministerio de Educación. Ministerio de Educación de la Nación. Santa Fe 1548. Buenos Aires. Hecho el depósito que marca la ley 11.723. Libro de edición argentina. ISBN 950-00-0257-4. Primera Edición. Primera Reimpresión. Índice Introducción . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . A la ciencia lo que es de la ciencia . . . . . . . . . . . . . . . . . . . . . . . . . . . ¿Cómo organiza la realidad la ciencia? . . . . . . . . . . . . . . . . . . . . . . . . . . . . La química: un arte que fue ciencia ......................... Análisis de sustancias . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . El aire . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Algunas características de los materiales . . . . . . . . . . . . . . . . . . . . . . . . . . La masa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . El volumen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Medir el volumen . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La densidad . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Un modelo material . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . El modelo atómico de la materia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Los elementos químicos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Metal o no metal . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Moléculas y compuestos químicos . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . “Fuerzas vitales” en las sustancias . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La química y la industria . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Un ejemplo: la siderurgia . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5 5 8 11 17 20 23 23 24 25 27 29 29 34 37 39 41 44 44 Las unidades de la vida . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49 La célula y su teoría . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Alquimia y enfermedad . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Parecidas y diferentes, pero todas células . . . . . . . . . . . . . . . . . . . . . . . . . . Bioelementos y biomoléculas . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La organización celular . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La fábrica celular . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La energía de la célula . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Toda célula viene de otra célula . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . La tercera edad en las células . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Micromundo . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . Los virus . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . El ABC de la gripe . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 50 55 57 58 61 64 66 67 69 69 74 76 Introducción A ntes de comenzar con el desarrollo de los temas específicos de Ciencias Naturales que se abordarán en este libro se analizarán algunas de las características distintivas del saber científico en general y, particularmente, el de las ciencias naturales. A la ciencia lo que es de la ciencia L a ciencia es -al igual que la religión, las artes, la filosofía, entre otras formas del conocimiento- uno de los modos que el hombre ha desarrollado para comprender la realidad en la que vive. La ciencia tiene en la sociedad actual una importancia indiscutible, debido a los conocimientos que ella aporta y que pueden hacer posible el mejoramiento de la calidad de vida del hombre. 5 ¿En qué se funda la efectividad de la ciencia? E l principal elemento que hace de la ciencia una forma de saber respetada prácticamente por todas las personas, es el tipo de conocimiento que procura alcanzar. Las descripciones y explicaciones científicas de la realidad llevan en sí mismas la pretensión de ser universales y convertirse en leyes científicas. Los enunciados que la ciencia produce tratan de explicar las relaciones esenciales existentes entre los componentes de alguna porción de la realidad que sean válidas para todos los hombres. Así por ejemplo, las explicaciones que da la física sobre el movimiento de los cuerpos o la propagación de radiaciones, son leyes. La biología enuncia leyes que dan cuenta de los mecanismos de la herencia de caracteres, y la química lo hace sobre las combinaciones de las sustancias. Pero los científicos procuran ir "un paso más allá" de la enunciación de leyes aisladas e intentan establecer conexiones entre éstas. Así se construyen las teorías científicas, que son conjuntos articulados de leyes que procuran dar cuenta de un amplio campo de fenómenos. Teoría x Ley 4 Ley 1 Ley 5 Ley 3 6 Ley 2 Las leyes y teorías de la ciencia no son definitivas. El conocimiento científico puede ser modificado o sustituido a partir de nuevos descubrimientos. De manera que todo conocimiento científico, es siempre provisorio o hipotético. Siempre estará sujeto a verificaciones o refutaciones por parte de los miembros de la comunidad. Por ello, el conocimiento científico debe ser público. No sólo deben ser públicos sus resultados. También deben darse a conocer los medios y los métodos utilizados para producirlos. Sólo así quien pretenda verificar o refutar dicho conocimiento dispondrá de las herramientas necesarias. Actividad N…1 Vuelva a leer las páginas anteriores y enuncie por escrito las características del conocimiento científico. Actividad N…2 Trate de identificar en los módulos anteriores o en otros libros de texto diferentes leyes, teorías o simplemente enunciados provisorios propios de la ciencia. Escriba un listado con todas las que haya encontrado. 7 ¿Cómo organiza la realidad la ciencia? E l objeto de estudio de la ciencia es la realidad misma. Pero "la realidad" como conjunto es por demás extensa y compleja; intentar abordarla de una sola vez es imposible. Por ello, en la práctica existen diferentes "ciencias", diferentes disciplinas científicas. Se distinguen dos grandes grupos de disciplinas científicas: las ciencias formales y las ciencias fácticas. 1 Las ciencias formales -matemática y lógica- se dedican al estudio de objetos que no existen en la realidad espacial ni temporal. Los números y las operaciones que con ellos se realizan carecen de toda significación en sí mismos. Los productos de la matemática y la lógica son solamente formas, pero formas que pueden ser utilizadas para aplicarlas a la descripción y comprensión de la realidad. ¿Puede imaginar a un ingeniero sin la "herramienta matemática" para proyectar y ejecutar la construcción de un puente? 2 Las ciencias fácticas son las que efectivamente se encargan de estudiar la realidad experiencial. Construyen modelos teóricos sobre cómo es la realidad, valiéndose de la lógica y de la matemática. Luego estos modelos construidos se confrontan con la realidad misma. Entre las ciencias fácticas se pueden distinguir dos grandes grupos: 8 1 Las ciencias naturales: que incluyen a la física, la química y la biología. Sus esfuerzos están dirigidos a estudiar las cuestiones de la naturaleza. 2 Las ciencias sociales que comprenden disciplinas como psicología, sociología, economía, antropología, geografía, etcétera. Estas disciplinas científicas estudian el amplio campo de las cuestiones de la cultura, de la sociedad y del hombre en tanto persona. Actividad N…3 En el siguiente esquema complete cada uno de los espacios con los conceptos correspondientes. Ciencias Formales Disciplinas Científicas Ciencias Fácticas El esquema está destinado a representar precisamente el orden clasificatorio de las disciplinas científicas tal como lo hemos reseñado aquí. En este libro se analizarán algunas cuestiones que corresponden más específicamente al campo de la química y la biología. 9 La química: Un arte que fue ciencia S i pudiéramos encontrar alguna característica del Universo conocido que permanezca inalterable a lo largo del tiempo seguramente deberíamos fijar nuestra atención en el cambio. Es decir, la única propiedad que, presumiblemente, podemos reconocer como denominador común de lo que ocurre en el Universo es el cambio. Los materiales que existen en el Universo sufren cambios continuos. Por ejemplo, en el planeta Tierra, el agua de los ríos y mares se evapora al calentarse por la acción del Sol; luego se condensa formando nubes. Puede precipitarse en forma líquida -lluvia- o sólida -nieve o granizo-. Otras modificaciones: los incendios queman la vegetación y la transforman en cenizas; un minero extrae carbón que luego es partido en trozos más pequeños y transportado; el café se mezcla con un poco de leche cuando tomamos un “cortado”; el hierro se oxida; una lamparita se enciende. Los seres vivos, por su parte, sufren cambios en forma continua cuando se relacionan con los factores ambientales, o entre sí, o con otros organismos. Por ejemplo, cuando un virus o una bacteria ingresa en nuestro cuerpo se producen modificaciones tanto en nuestras células como en los propios microorganismos invasores. La química forma parte de las ciencias naturales. La primera pregunta que podemos plantearnos es qué significa la palabra química. Como muchos términos que usamos habitualmente, la palabra química viene del griego chymeia a través del árabe al-kimiyá y significaba, en su origen, un conjunto de ideas y experiencias, muchas veces esotéricas -ocultas-, relacionadas con los cambios en la naturaleza de la materia. Es decir, se vinculaba con todas aquellas transformaciones que sufren los materiales, por ejemplo cambios de color, de estado, de composición y cambios de otras propiedades. 11 Algunos autores consideran que la historia de la química tuvo una primera etapa, conocida con el nombre de alquimia, que fue valorada negativamente y asociada a prácticas de brujería. La alquimia se difundió desde Alejandría por todo el mundo árabe. Su principal actividad estaba dedicada a lograr la llamada “transmutación de todos los metales” y el “elixir de la salud inmortal”. Regiones donde se desarrolló la alquimia Ambos objetivos eran perseguidos al mismo tiempo. Debido a que se conocía la existencia de metales más nobles que otros (algunos no se oxidan y no se deterioran fácilmente, otros no se descomponen con facilidad, hay metales que mantienen su brillo y por lo tanto su valor comercial, etc.), se buscaba la “piedra filosofal” que sería capaz de transformar a todos los metales en oro, considerado el metal perfecto. Asimismo, si dicha piedra tocaba el cuerpo humano le otorgaría la salud eterna y al alma la perfección espiritual. 12 Una definición que se construye: En 1755, la química era considerada como el arte mediante el cual, con el auxilio de determinados instrumentos y fundamentalmente en contacto con el fuego, se provocaban cambios en los cuerpos visibles, contenidos en recipientes con el fin de descubrir sus poderes y virtudes. En 1794, se decía que la finalidad de la química era descubrir e informar sobre la naturaleza de los cuerpos y sobre la acción de unos sobre otros. En 1893 se definía la química como “la rama de la ciencia e investigación física que se ocupa de las distintas sustancias elementales, o formas de la materia, de las que todos los cuerpos se componen, y de las leyes que regulan la combinación de dichos elementos en la formación de cuerpos compuestos, así como de los distintos fenómenos que acompañan a su exposición de diversas condiciones físicas”. En 1971, en el Penguin Dictionary of Science, figuraba que “la química se dedica al estudio de la composición de sustancias y del efecto de unas sobre otras”. A pesar de que fue prohibida en el siglo II, la alquimia siguió prosperando a lo largo de los quince siglos siguientes. Sin embargo, su práctica -como casi toda actividad humana- contaba con adhesiones y rechazos. El desprecio existente en el ámbito del saber académico era casi unánime; sin embargo varios relatos muestran que muchos alquimistas eran investigadores profesionales. Más aún, sus técnicas, desarrolladas durante siglos, constituyen la base de la química moderna. Algunos eran “farmacéuticos”, que preparaban líquidos y polvos y los vendían, en tanto que otros trabajaban cuidando la salud de reyes y aristócratas. Durante el Renacimiento (siglo XVIII) el objeto de estudio de la alquimia se trasladó a temas tales como las propiedades de los gases, es decir el estudio relacionado con las características de los elementos y no el uso inmediato del producto de los experimentos. El término ”químico” empezó a perder parcialmente su sentido peyorativo y despectivo hasta acercarse al que le damos hoy. Aproximadamente desde esta época, el sentido que tiene la ciencia química se ha mantenido más o menos constante. 13 Actividad N…4 a Compare las definiciones originarias de la alquimia con las de la química actual. Indique semejanzas y diferencias, si las hubiera. b Uno de los objetivos básicos de la alquimia era lograr “el elixir de la salud inmortal”. Analice si en la sociedad actual es posible reconocer prácticas que, de un modo u otro persisten en dicha búsqueda. Como usted habrá analizado, la práctica de la química actual ha mantenido algunos objetivos que provienen de la alquimia. También se mantienen muchos elementos utilizados tradicionalmente por los alquimistas. Las balanzas, los aparatos de vidrio, los tubos, que se emplean actualmente, tienen sus antecedentes en los que usaban los alquimistas. Sin embargo, han sido incorporados otros instrumentos eléctricos y ópticos que han modificado gran parte de las rutinas del trabajo en el laboratorio. Laboratorio químico actual Laboratorio alquímico 14 La vida cotidiana de los químicos Además de las necesidades básicas de cualquier persona, los costos de los materiales y los equipos de laboratorio hacen imposible, en la actualidad, que los químicos profesionales sean autosuficientes para investigar. La realidad muestra que los científicos deben buscar algún tipo de subvención, ya sea de la industria, del Estado o de las universidades. Por lo tanto no siempre pueden decidir sobre qué investigar. Así, por ejemplo, los químicos que trabajan para una industria reciben pedidos para que fabriquen un plástico que sea menos costoso que los existentes, con menos olor y más transparente, fácil de teñir y apto para fabricar peines. Otros pueden dedicarse a producir objetos superfluos que se venden a precios altos, como por ejemplo las siliconas, sustancias muy codiciadas entre otras, para la llamada “gente del espectáculo”. Pero quizá la decisión de mayor trascendencia a la que se enfrenta un químico sea la de si debe o no trabajar en “cuestiones de defensa”. Algunos sostienen que la producción de armas cada vez más peligrosas es el modo más seguro de fomentar la paz y que, por lo tanto, están obligados a participar en esas investigaciones. Es decir, que en su actividad cotidiana, los químicos se enfrentan a decisiones: ¿sobre qué tipo de problemas trabajar? y ¿para quién? Sobre las cuestiones éticas vinculadas con la investigación científica volveremos en el último módulo. Aún hoy la química sigue conservando algo de su dudosa fama del pasado y la palabra “químico” se usa habitualmente en forma peyorativa. Frases tales como “cultivado sin fertilizantes químicos”, “no contiene químicos” son percibidas en forma positiva por la población. En tanto que palabras como “sintético” en lugar de designar simplemente “fabricado por el hombre”, sugiere algo “fraudulento” o poco confiable. Queda claro, luego de analizar el significado de la palabra, que la ciencia química se ocupa tanto de los materiales que forman los fertilizantes naturales (elementos de la naturaleza) como los “químicos” (elementos sintéticos o artificiales). Es posible realizar estudios químicos en el agua considerada “más pura” y en las mezclas más artificiales (producidas por el hombre). En cierto sentido, toda la materia existente en el Universo puede ser analizada desde el punto de vista químico. Y esto no está ni bien, ni mal. Es una posibilidad de estudio científico. 15 Actividad N…5 a Realice una encuesta entre aproximadamente diez personas conocidas. Pregúnteles qué significa para ellos el término “química”. b Clasifique las respuestas y elabore por escrito una primera conclusión a partir de las respuestas obtenidas. c Compare su conclusión con las de sus compañeros. Si los químicos se dedican a estudiar los materiales (usaremos en el libro indistintamente materia o materiales como términos que significan lo mismo), ¿corresponde al químico interesarse por todas las clases de sustancias? El estudio de los materiales como elemento de la corteza terrestre, parte de un organismo vivo, o de una estructura artificial, corresponde respectivamente al geólogo, al biólogo, al ingeniero. Pero las rocas, los animales, los edificios o los autos no se pueden comprender sin un conocimiento detallado de los materiales que los forman. Por eso, han surgido disciplinas que integran saberes de diferentes ciencias, como la geoquímica, la bioquímica y la ciencia de los materiales, que son llamadas ciencias interdisciplinarias. Estas disciplinas, desde la base común de la ciencia química, profundizan los conocimientos específicos necesarios para su desarrollo. Actividad N…6 Dibuje un esquema como el que se presentó en la Actividad N…3. Incluya los campos interdisciplinares. De todos modos, los químicos no tienen el monopolio del estudio de los materiales. Los físicos sostienen que su actividad propia incluye no sólo a los materiales, sino también a la energía. 16 Algunos investigadores afirman que la línea que separa a la química de la física nunca ha sido muy clara y, en los últimos años, casi ha desaparecido. En las disciplinas científicas los límites no siempre están claros, puesto que hay numerosos temas que pueden ser estudiados por varias ciencias. Análisis de sustancias F rente a una sustancia presente en la naturaleza podemos iniciar una búsqueda de información con preguntas bastante simples: ¿Esta sustancia es visible? ¿Todas las sustancias son visibles? Si un rayo de luz llega a un medio material distinto de aquel por el que se desplazaba, pueden ocurrir tres cosas: que el rayo de luz atraviese el nuevo material, que sea absorbido por el material o que rebote en la superficie. Los materiales opacos como la madera o el metal no transmiten la luz, en cambio al llegar a un vidrio o a un celofán, la luz es capaz de atravesar tales sustancias en línea recta. Pero en el caso de vidrio opacado, la luz no puede pasar en línea recta. a- que lo atraviese b- que sea absorbido c- que rebote Cualquier rayo de luz que penetre en una nueva sustancia, como en los casos a y b, cambia ligeramente su dirección. ¿Qué sucede con la llegada de un rayo de luz a un medio líquido? Si el líquido está inmóvil, una buena parte se refleja desde la superficie. Como todos los líquidos tienen un aspecto más o menos brillante, parte de la luz se refleja. El resto de la luz puede ser transmitida a través del material -por ejemplo en el caso de agua pura-; puede ser absorbida -alquitrán líquido-; o puede ser parcialmente absorbida -vaso de whisky-. Actividad N…7 a ¿Es posible distinguir solamente con la vista un vaso con agua de otro que contiene ginebra? ¿Por qué? b Analice qué ocurre con la luz en el caso de las mezclas que contienen gases: humo, niebla y gas natural. 17 Un comentario habitual en los libros de texto que Ud. puede encontrar en una biblioteca enuncia que resulta sencillo reconocer cuándo una sustancia es líquida, sólida o gaseosa. Suele decirrse que un sólido tiene un volumen determinado y una forma determinada, que un líquido tiene también un volumen fijo, pero no una forma precisa (se amolda al recipiente que lo contiene), finalmente, que un gas no tiene un volumen fijo, ni una forma determinada. Pero, ¿son correctas estas afirmaciones para cualquier situación? Pensemos en los siguientes ejemplos. Hay sólidos que fluyen, aunque lentamente. El chocolate en un día caluroso o el betún se “ablandan” y cambian su forma. Un polvo como la sal también fluye si se la vuelca sobre la mesa, formando un cono y no una superficie horizontal. Una gota de agua que está sobre el pétalo de una flor, es casi esférica, ni se dirige hacia el centro de la flor, ni toma la forma del espacio entre los pétalos y no puede decirse que la superficie sea horizontal. Por otra parte, no siempre la vista nos permite conocer ciertas características de los materiales. En efecto, es simple elegir el más largo de dos alambres de hierro. Pero muy a menudo, nuestros ojos pueden reflejar situaciones equívocas. 18 Actividad N…8 a ¿Cuál de estas dos líneas es más larga? b Observe las figuras e identifique dos imágenes. ¿Cuáles son? ¿Puede ver ambas al mismo tiempo? c ¿Qué reflexión le surge acerca de las percepciones que tenemos por medio del sentido de la vista? ¿Qué es A? Sobre un fondo de patos, B es un pato, pero A sobre un fondo de antílopes, C se convierte en un antílope. ¿Es así como vemos los hechos contrastados en una teoría? (Hanson 1958) B C Como vemos, a través de los sentidos puede conocerse algo sobre los cuerpos sin haber realizado experimento alguno. Pero también podemos confundirnos. 19 El aire C uesta creer que el aire sea realmente algo. No se puede ver y normalmente tampoco se deja sentir y, sin embargo, está ahí. Cuando cobra suficiente velocidad sopla un viento que puede hacer naufragar barcos y derribar árboles. Recién entonces su presencia no se discute. ¿Es el aire la única sustancia invisible? Los alquimistas de la Edad Media pensaban que sí, ya que todos los vapores que emanaban producto de las reacciones que llevaban a cabo en sus talleres eran designados como “aires”. Un brillante alquimista fue el médico Jan Baptiste van Helmont. Alrededor del año 1630 llevó a cabo una serie de experimentos para analizar los “aires” que salían de las reacciones que producía en su laboratorio. Al mezclar trocitos de plata en ácido nítrico, la plata se disolvía y un vapor de color rojo salía del recipiente. ¿Era aquello aire? En otros ensayos echó caliza sobre vinagre y observó una serie de pompas que llegaban a la superficie del líquido. Pero al acercar al líquido una vela encendida, la llama se apagaba. ¿Qué clase de aire era aquel que apagaba una llama? Estos mismos vapores los obtuvo a partir del jugo de fruta fermentado. Luego de verificar ciertas diferencias con el aire común y corriente, Van Helmont conjeturó que existían otras sustancias bastante difíciles de estudiar. Este nuevo grupo de sustancias necesitaba un nombre. Recurriendo a los griegos apeló a un mito sobre el origen del universo que proclamaba que en el principio todo era “caos”. Eligió esa palabra para todos esos aires extraños, pero escribió la palabra tal como la pronunciaba: “gas”. 20 El aire era uno más entre otros gases. El gas rojo hoy se llama dióxido de nitrógeno, y el gas que apagaba la vela, dióxido de carbono. Estudiar los gases no era fácil. Apenas producida la reacción, se escapaban. Cien años más tarde un pastor protestante Stephen Hales, inventó un método para evitar el escape de gases. A través de él, las burbujas que se formaban en un recipiente eran conducidas por una única salida hacia la boca de otro recipiente. Este estaba en posición invertida y lleno de agua. De este modo, las burbujas salían por un tubo acodado y subían, desplazando al agua, al otro recipiente. En 1770, Joseph Priestley, otro pastor protestante, sustituyó el agua por mercurio, ya que los gases no se disuelven en mercurio. Este método le permitió recoger cualquier gas. El gas que más le interesó fue el dióxido de carbono. Lo obtuvo con mercurio y luego lo mezcló con un poco de agua. De esta manera inventó la soda. Priestley descubrió el oxígeno y obtuvo también amoníaco y dióxido de azufre, entre otros. Había muchos más gases que aire. Por la misma época, en Francia, el químico Antoine Laurent Lavoisier estaba estudiando la combustión. Antes de que una sustancia ardiera, la pesaba cuidadosamente y, luego de la combustión, la volvía a pesar. Sin embargo, los resultados no aclaraban, oscurecían. La madera ardía y las cenizas obtenidas pesaban mucho menos. Una vela se consumía y no dejaba rastros. Lavoisier sabía que un metal oxidado, pesaba más que otro no oxidado. Era como si otro metal llegara no se sabe de dónde y se agregara al metal original. La pregunta que se hizo era: ¿por qué la oxidación agregaba materia y la combustión la quitaba? ¿No sería que el material quemado se mezclaba con el aire? Lavoisier conjeturó que una sustancia al arder perdía peso porque liberaba un gas. Por el contrario, los metales al oxidarse ganaban peso porque se mezclaban con el oxígeno. Pero, ¿cómo probar estas hipótesis? Ideó varias experiencias. En una de ellas comenzó por pesar con todo cuidado el recipiente junto con la sustancia sólida y el aire retenido adentro. Luego, mediante una lupa calentó al sol la sustancia y esta se quemó. Volvió a pesar el recipiente sellado herméticamente y comprobó que el peso no había variado. Las conclusiones de Lavoisier sobre esta experiencia se formularon en el “Principio de conservación de la materia” -modificado parcialmente en el siglo XX- que constituyó una de las bases de la química moderna. 21 Actividad N…9 Jan Baptiste van Helmont hizo en el siglo XVII, un experimento que marcó época. Transcribimos parte de su relato: “Tomé una maceta, en la cual coloqué 90,7 kilos de tierra que había sido secada en un horno, la humedecí con agua de lluvia y sembré en ella el tronco o tallo de un árbol de sauce que pesaba 2,30 kilos. Finalmente, después de 5 años de cuidados, el árbol había crecido y pesaba 76,74 kilos. Cuando era necesario, siempre humedecía la tierra de la maceta con agua de lluvia o agua destilada; la maceta era grande y estaba implantada en la tierra. Para que el polvo de los alrededores no se entremezclara con la tierra, cubrí los bordes de la maceta con una placa de hierro cubierta con plomo y con muchos huecos. No calculé el peso de las hojas que cayeron durante cuatro otoños. Al final, sequé de nuevo la tierra que había en la maceta y encontré los mismos 90,7 kilos, faltando solamente 56,7 gramos. Por lo tanto, los 74,5 kilos de madera, corteza y raíces se formaron solamente de agua.” Vuelva a leer el relato y trate de responder a las siguientes preguntas: a ¿Las conclusiones de van Helmont son correctas? ¿Por qué? b ¿Qué variables no tuvo en cuenta van Helmont en su experiencia? c ¿Qué cambiaría en ese experimento para que se pueda demostrar qué otras variables pudieron haber incidido en el aumento del peso del árbol? Como hemos visto, existen otras formas de obtener información sobre las sustancias además de estudiarlas utilizando los sentidos. Es posible actuar sobre ellas provocando modificaciones. Gran parte del conocimiento acumulado por las ciencias naturales corresponde justamente a intervenciones que los investigadores realizan sobre el objeto que desean conocer. De esta manera pueden analizarse fenómenos que de otro modo no ocurrirían. Por ejemplo, muchos de nosotros nunca hemos visto hierro líquido, pero sabemos que puede fundirse y volverse líquido. Una gran 22 herramienta con la que han contado y cuentan los químicos para producir cambios y estudiarlos, es el fuego como la fuente más eficaz para producir transformaciones. Pero también hay otros caminos. Si miramos alrededor los objetos que nos rodean observamos que son diversos: piedras, árboles, perros, papeles, montañas, nubes. Todos estos objetos están formados por materiales. Las distintas clases de materiales se conocen con el nombre de sustancias. Consideremos ahora las características de los materiales que pueden ser medidas, es decir, que pueden ser cuantificadas, transformadas en cantidades numéricas. Ellas son: la masa, el volumen y la densidad. Algunas características de los materiales La masa Habitualmente, se considera a la masa como la cantidad de materia que tiene un cuerpo. Muchas veces se confunde la masa con el peso que corresponde a la fuerza que ejerce la Tierra sobre el cuerpo en cuestión. La fuerza gravitatoria de un astro es uno de los factores que determina el peso de los objetos cercanos a su superficie. Así, un mismo cuerpo pesará más si se halla cerca de la superficie terrestre que si estuviera cerca de la superficie lunar, donde la gravedad es menor. Sin embargo, como se trata del mismo cuerpo, la masa, es decir la cantidad de materia que lo compone, será la misma. La Ley de Gravedad Isaac Newton estimó que, por ejemplo, la Luna no salía disparada en línea recta y seguía con su movimiento, aparentemente repetitivo y perpetuo, debido a la acción de una fuerza que la empujaba en dirección a la Tierra y que desviaba continuamente su trayectoria convirtiéndola en circular. Newton llamó gravedad a esa fuerza y consideró que podía actuar a distancia. Asimismo, dedujo que es la gravedad de la Tierra la fuerza que hace que los objetos se mantengan cerca de su superficie o que caigan sobre ella. En el Universo todos los cuerpos se atraen entre sí con esta fuerza. La atracción gravitatoria es mayor en aquellos cuerpos que tienen mayor cantidad de materia, es decir mayor masa. Esta atracción también será mayor entre aquellos cuerpos separados por una distancia menor. Isaac Newton El volumen El volumen es el lugar que ocupa un cuerpo en el espacio. Esto vale tanto para cuerpos líquidos como para cuerpos sólidos. En el caso de gases, la cuestión se complica. Estos ocupan todo el volumen del recipiente que los contiene. Si luego introducimos otro gas, éste ocupará también el mismo volumen. Los cambios en la presión y/o en la temperatura modifican el volumen de los cuerpos. 24 Actividad N…10 a ¿Que ocurre si introducimos en el congelador un cubo lleno hasta el tope con agua? Le sugerimos que realice la experiencia. ¿Pesará más, menos o lo mismo que en estado líquido?¿Su volumen será mayor o menor? b ¿Qué pasa si colocamos un globo inflado en el congelador? ¿Por qué sucede esto? Anote una primera respuesta tentativa y luego verifíquela. Identifique las semejanzas y diferencias entre su primera anotación y la segunda. Medir el volumen Para medir el volumen de los líquidos, se utilizan recipientes graduados. En el caso de los sólidos, según sea la forma, podemos conocer su volumen. Para medir el volumen de líquidos en los laboratorios se emplean diferentes tipos de recipientes graduados. La probeta se usa para medir con bastante exactitud volúmenes de distintos líquidos, la pipeta para medir pequeños volúmenes. El volumen de un sólido es posible calcularlo teniendo en cuenta su forma geométrica, utilizando algunas fórmulas matemáticas sencillas. Existen otras posibilidades para medir el volumen de un sólido, especialmente cuando presenta una forma irregular. Para analizarlo, le proponemos la siguiente actividad. 25 Actividad N…11 Trataremos de medir el volumen de cuatro sólidos diferentes. Para ello, le sugerimos seleccionar cuerpos con distintas formas (pueden ser de plastilina). a Llene una probeta con 50 cm3 de agua y a continuación introduzca cada uno de los sólidos elegidos. b Determine el volumen de cada uno a partir del aumento en el nivel de líquido de la probeta. c Desafío adicional: ¿Cómo mediría el volumen de cuerpos que no se sumergen fácilmente, por ejemplo, un trozo de madera? Arquímedes El matemático y filósofo griego Arquímedes postuló que todo cuerpo sumergido en un fluido experimenta una fuerza hacia arriba igual que el peso del fluido desplazado por dicho cuerpo. El principio de Arquímedes permite determinar así el volumen de un objeto cuya forma es tan irregular que no puede medirse directamente. Si el objeto se pesa primero en aire y luego en agua, la diferencia de peso será igual al peso del volumen de agua desplazada, y este volumen es igual al volumen del objeto, si éste está totalmente sumergido. Si se necesita una precisión elevada, hay que tener en cuenta el peso del aire desplazado para obtener el volumen correcto. 26 La densidad ¿Dónde hay más masa, en un kilo de plomo o en un kilo de corcho? La diferencia entre un kilo de plomo y un kilo de corcho no es su masa, sino algo característico de cada sustancia que conocemos con el nombre de densidad. Si bien las masas son equivalentes, el plomo es más denso que el corcho, pues las partículas que lo constituyen están más apretadas, tal como se observa en el siguiente dibujo. Se llama densidad a la cantidad de materia (masa) de un cuerpo que hay en cada unidad de volumen. Puede decirse entonces que el plomo es más denso que el corcho pues, por ejemplo, en un volumen de 1cm3, la masa de plomo es mayor que la de corcho. La flotabilidad de los sólidos en los líquidos depende de la densidad de ambos tipos de sustancias. Un sólido flota si su densidad es menor que la del líquido en el que se sumerge y se hunde si su densidad es mayor. Así, el plomo es más denso que el agua, se hunde. El corcho, en cambio, tiene una densidad menor que la del agua y, por lo tanto, flota. 27 Actividad N…12 Le proponemos resolver las tres experiencias: Se necesitan dos vasos. Uno sólo con agua y otro con agua y mucha sal fina bien revuelta. a Elabore una predicción sobre qué ocurrirá si en cada vaso introducimos un huevo de gallina. Fundamente su predicción. b Describa lo que ocurrió efectivamente cuando usted introdujo en cada vaso un huevo de gallina. c Confronte lo que observa con lo usted había dicho antes de hacer el experimento. d A partir de lo estudiado sobre densidad, elabore una explicación del fenómeno observado. Completando la experiencia anterior, en otro recipiente más grande (de ser posible, el doble de tamaño) introduzca igual cantidad de agua (de la canilla) y agua salada (muy concentrada, como la anterior). Si equilibra la mezcla de aguas con cuidado, es posible obtener un líquido de idéntica densidad a la del huevo. Logrará entonces que el huevo quede suspendido en el líquido en la mitad del recipiente. e Si luego agrega agua de la canilla ¿qué sucede? y ¿si agrega agua salada? Ahora necesita un melón y una aceituna (verde o negra) y un recipiente grande de plástico del tipo de un fuentón. f Formule una hipótesis sobre qué ocurrirá si introducimos en el recipiente con agua el melón y la aceituna. g Luego, introduzca el melón y la aceituna en el recipiente. Describa lo observado y confronte con su hipótesis original. 28 Un modelo material ¿C ómo está formada la materia? Hemos visto que en los cuerpos, podemos reconocer su masa, volumen, densidad, color, forma, etc. Sabemos también que la materia está formada por infinidad de partículas que no pueden identificarse a simple vista. Habitualmente los científicos elaboran modelos para comprender las observaciones que realizan en forma indirecta. Le proponemos analizar ahora uno de los modelos más eficaces con que cuentan los químicos para estudiar qué son los materiales. ¿Qué es un modelo? Podemos decir que toda la actividad científica consiste en última instancia en una constante elaboración de modelos. Se trata de esquemas simplificados que representan algún aspecto de la realidad. Podemos comparar el trabajo de los científicos con el que realizan los ingenieros cuando proyectan y diseñan una obra. Antes de comenzarla, construyen modelos -maquetas y planos- que orientarán la construcción. En ciencia también se construyen modelos -que pueden ser hipótesis y experimentos- que permiten comprender aspectos de la realidad que se quiere estudiar. El modelo atómico de la materia E n el siglo XIX ya se sabía que las sustancias podían agruparse en dos tipos: las que se descomponen en otras sustancias distintas y que se llaman compuestos químicos y aquellas que no se descomponen en otras sustancias, y se denominan sustancias simples o elementos químicos. Según el investigador Robert Boyle (1627-1691), considerado el creador de la química moderna, “un elemento es una sustancia básica que se puede combinar con otros elementos para formar compuestos, pero que no puede ser ‘rota’ para dar otras sustancias más simples”. Varios siglos antes de Cristo, los filósofos griegos discutían la naturaleza de la materia. Si se trataba de algo continuo o de algo discontinuo. Es decir, si la materia era algo que se podía dividir indefinidamente, o bien se trataba de algo que llegado un punto, no era posible seguir dividiendo, habiéndose llegado a la unidad de la materia, el átomo. 29 Aire, Agua, Fuego y Tierra. Una cuestión que inquietó a la mayoría de los pensadores griegos fue cuál era el componente último de la materia. El filósofo Tales de Mileto, por ejemplo, consideraba que el último límite de la materia era el agua. Es decir, que si se descomponía indefinidamente una estructura material, se llegaría a un punto más allá del cuál no se podría seguir. Allí habría agua. Pero la mayoría de los filósofos griegos de la época se opuso a la teoría de Tales. Otro pensador, Heráclito afirmó que el elemento último que constituía las cosas era el fuego. Basaba su idea en que el fuego cambia de forma, resplandece y luego se apaga. Es decir, cambia continuamente hasta apagarse. Otros filósofos consideraron que el Universo era mucho más complicado y no podía ser entendido a partir de un único elemento. Empédocles sostuvo que existían cuatro elementos: aire, agua, fuego y tierra, que conformaban a todas las cosas que existen. Artistóteles, tomando la concepción de Empédocles, completó los elementos con algunas propiedades que reconoció en los materiales. Frío, caliente, húmedo, seco, parecen ser cualidades propias de los materiales que además pueden cambiar. Lo frío volverse caliente, lo seco, húmedo. Esto según Aristóteles, permitía que un elemento se transformara en otro. Actividad N…13 a Analice el componente último de: • una hoja de papel de diario • un trozo de madera • una puerta de chapa • un aparato de televisión • un vaso de vidrio b Fundamente su respuesta. Actividad N…14 a Analice el componente último de: • el aire que repiramos • una hormiga • una flor • una célula humana b Fundamente su respuesta. 30 Demócrito acuñó el nombre de átomo, para designar a las partículas extremadamente pequeñas que constituían a los materiales, ya fueran componentes de estructuras vivas o no. Sustancias simples y compuestos químicos. Átomos y moléculas. La primera aproximación moderna a la Teoría Atómica tuvo lugar a principios del siglo XIX. Un químico inglés, John Dalton, a partir de sus experimentos con gases, formuló una teoría que podemos resumir de la siguiente manera: • todos los materiales están formados por pequeñas partículas indestructibles e indivisibles llamadas átomos. (el término átomo significa, precisamente “indivisible”); • los átomos de un mismo elemento tienen iguales propiedades, en particular un mismo peso; • los átomos de elementos distintos tienen distintas propiedades, en particular distinto peso; • las sustancias se forman cuando los átomos de un mismo o de distintos elementos se asocian para formar grupos llamados moléculas. 31 La teoría de Dalton tuvo fundamental importancia para el diseño y desarrollo posterior de una serie de experimentos que a lo largo de los años fueron llevando a un conocimiento más detallado de los átomos. Muchos de estos experimentos modificaron las ideas existentes sobre las características de los átomos. Ya a principio del siglo XX los hombres de ciencia consideraban erróneo el postulado de Dalton sobre la indivisibilidad de los átomos. Actualmente los científicos -avalados por pruebas y fundados en teorías- conciben a los átomos de la siguiente manera: • en el centro del espacio atómico, se halla una esfera muy compacta, o núcleo del átomo formado por dos tipos de partículas, los protones -con carga eléctrica de signo positivo- y los neutrones -sin carga-; • el núcleo del átomo alberga una gran cantidad de energía, precisamente toda aquella que sirve para mantener tan firmemente unidas a sus partículas constitutivas; • girando en ese espacio vacío, los átomos presentan una cierta cantidad de partículas pequeñas cargadas negativamente -los electrones-; • los electrones pueden ver modificada su área de giro, cuando por ejemplo son perturbados por una descarga eléctrica. En cuyo caso giran momentáneamente, en regiones más alejadas del núcleo. 32 En síntesis, si imaginamos al átomo como del tamaño de un campo de fútbol, el núcleo del átomo sería como el de una "bolita de vidrio" -aquellas con las que suelen jugar los niños- ubicada en el centro. Los electrones podrían representarse como una lluvia de papelitos que cae desde las tribunas de un estadio de fútbol. Claro que el tamaño "real" de un átomo es infinitamente más pequeño que el de un campo de fútbol, ¡imagine que en el punto con que termina esta frase podrían caber aproximadamente unos 10 millones de átomos! Actividad N…15 Le proponemos resolver algunas cuestiones relacionadas con la estructura de los materiales. a Los alquimistas buscaban la transformación de todos los metales en oro. Siguiendo el modelo de Dalton, ¿cree usted que es posible poner nuevamente en marcha este proyecto? Explíquelo. b Sabemos que el agua está formada por la unión de dos átomos de hidrógeno y uno de oxígeno. ¿Podría existir agua, por ejemplo, en Marte, que tuviese tres átomos de hidrógeno y uno de oxígeno? Explíquelo. c Revise las respuestas dadas en el primer punto de esta actividad teniendo en cuenta la teoría atómica. 33 Los elementos químicos S i pensamos en átomos de la misma clase, aquellos que tienen las mismas propiedades químicas, estamos en presencia de un mismo elemento químico. En la actualidad, existen más de 109 elementos químicos, ordenados en una tabla conocida con el nombre de tabla periódica. En la naturaleza se han hallado 90 elementos, el resto ha sido inventado en los laboratorios. Los elementos representados en la tabla periódica son todos los existentes en el Universo (conocido). En algún sentido podemos decir que todo es química, ya que todos los cuerpos que existen están formados por átomos de algún elemento químico. La tabla periódica es una especie de resumen de la composición del universo conocido. Una primera clasificación que aparece en la tabla periódica es la que separa a elementos químicos que son metales (hierro, cobre, estaño, plomo, cinc, aluminio, etc.) de los no metales (azufre, carbono, potasio, etc.). Ciertos metales, muy conocidos como el acero, o el bronce, no figuran en la tabla periódica, pues se trata de aleaciones, es decir, son mezclas de metales elementales. La materia que constituye a los seres vivos tiene como elementos más comunes a los llamados bioelementos: carbono, oxígeno, hidrógeno, nitrógeno, fósforo, azufre. En cambio la materia inerte presenta como elementos más abundantes los llamados geoelementos: silicio, aluminio, hierro, calcio, sodio, potasio y magnesio. Los gases nobles Entre los elementos químicos existen seis, todos ellos gaseosos, que se conocen con el nombre de gases nobles o inertes ya que en condiciones ambientales no se combinan con ningún otro elemento químico, incluido ellos mismos. Estos gases inertes son: Helio, Neón, Argón, Kriptón, Xenón y Radón. 34 H LITIO Li 12 Be BERILIO 4 BARIO RADIO Ra 88 REFERENCIAS FRANCIO Fr 87 CESIO Ba Y ITRIO 39 Sc ESCANDIO 21 ACTINIO Ac 89 LANTANO La 57 Rf 5 6 TORIO Th 90 CERIO Ce 58 Db DUBNIO 105 Ta TANTALIO 73 NIOBIO Pa PROTACTINIO 91 Pr PRASEODIMIO 59 SEABORGIO Sg 106 W WOLFRAMIO 74 MOLIBDENO 42 Cr CROMO 24 VIB Nb Mo 41 V VANADIO 23 VB Metales alcalinotérreos RUTHERFORDIO 104 Hf HAFNIO 72 Zr CIRCONIO 40 Ti TITANIO 22 IVB IIIB Metales alcalinos 56 55 Cs ESTRONCIO Sr 38 Ca CALCIO 20 MAGNESIO RUBIDIO Rb 37 POTASIO K 19 SODIO 4 3 7 26 8 9 10 11 12 Metales de transición U URANIO 92 NEPTUNIO Np 93 PROMESIO 61 Hs HASSIO 108 Os OSMIO 76 Ru RUTENIO 44 Fe HIERRO Lantánidos AMERICIO 95 Eu EUROPIO 63 Pt PLATINO 78 Pd PALADIO 46 Ni NÍQUEL 28 IIB Bk BERKELIO 97 Tb TERBIO 65 MERCURIO Hg 80 Cd CADMIO 48 CINC Zn 30 Actánidos CURIO 96 Gd GADOLINIO 64 ORO Au 79 Ag PLATA 47 COBRE Cu 29 IB Pu Am Cm PLUTONIO 94 SAMARIO 62 Mt MEITNERIO 109 Ir IRIDIO 77 RODIO Rh 45 Co COBALTO 27 VIIIB Nd Pm Sm NEODIMIO 60 Bh BOHRIO 107 RENIO Re 75 Tc TECNECIO 43 Mn MANGANESO 25 VIIB B 14 C Ei EINSTENIO 99 Ho HOLMIO 67 Pb PLOMO 82 Sn ESTAÑO 50 Ge GERMANIO 32 SILICIO Si 14 CARBONO 6 IVA Otros metales Cf CALIFORNIO 98 Dy DISPROSIO 66 Tl TALIO 81 In INDIO 49 GALIO Ga 31 ALUMINIO Al 13 BORO 5 IIIA IIA Na Mg 11 3 13 2 15 16 17 N MENDELEVIO 101 TULIO Tm 69 Po POLONIO 84 Te TELURIO 52 Se SELENIO 34 AZUFRE S 16 No metales FERMIO O OXÍGENO 8 VIA F I Lw LAURENCIO 103 Lu LUTECIO 71 RADÓN Rn 86 Xe XENÓN 54 Kr CRIPTÓN 36 ARGÓN Ar 18 NEÓN Ne 10 HELIO He Gases nobles NOBELIO 102 Yb ITERBIO 70 At ASTATO 85 YODO 53 Br BROMO 35 CLORO Cl 17 FLÚOR 9 VIIA Fm Md No 100 Er ERBIO 68 Bi BISMUTO 83 Sb ANTIMONIO 51 As ARSÉNICO 33 FÓSFORO P 15 NITRÓGENO 7 VA 2 0 IA HIDRÓGENO 1 18 1 Tabla Periódica de los Elementos Metal o no metal L os elementos químicos pueden ser clasificados en metales o no metales. Pero existen elementos que no pueden ser clasificados fácilmente en los grupos definidos por los científicos. Los gases raros no se incluyen en la clasificación, ni tampoco elementos que se encuentran en una zona de transición entre los metales y los no metales, como por ejemplo el germanio, el antimonio, el polonio, etc. Los metales brillantes, suelen ser sólidos, con la excepción del mercurio que es líquido. Son elementos de alta densidad, en general maleables y buenos conductores del calor y la electricidad: el calcio, el sodio, el magnesio y el cobre son algunos ejemplos. Los no metales suelen estar en condiciones ambientales bajo la forma de gases, líquidos o sólidos, son poco densos, no conducen el calor, ni la electricidad y carecen de brillo. Algunos ejemplos son el nitrógeno, el bromo, el carbono y el azufre. 1 18 IA 0 1 2 H HIDRÓGENO 3 Metales No metales IIA 4 Li LITIO 11 SODIO Be 19 K POTASIO 37 Rb RUBIDIO 55 Cs CESIO 87 Fr FRANCIO 20 Ca CALCIO 38 Sr ESTRONCIO 56 Ba BARIO 88 Ra RADIO 15 16 17 VA VIA VIIA 6 B BORO 12 MAGNESIO 14 IVA 5 BERILIO Na Mg 13 IIIA 3 4 5 6 7 IIIB IVB VB VIB VIIB 21 Sc ESCANDIO 39 Y ITRIO 22 Ti TITANIO 40 Zr CIRCONIO 72 Hf HAFNIO 104 Rf RUTHERFORDIO 57 La LANTANO 89 Ac ACTINIO 23 V VANADIO 41 24 Cr CROMO 42 Nb Mo NIOBIO 73 Ta TANTALIO 105 Db DUBNIO 58 Ce CERIO 90 Th TORIO 25 Mn MANGANESO 43 Tc MOLIBDENO TECNECIO 74 75 W WOLFRAMIO 106 Sg SEABORGIO 59 Pr PRASEODIMIO 91 Pa PROTACTINIO Re RENIO 107 Bh BOHRIO 60 8 9 VIIIB 26 Fe HIERRO 44 Ru RUTENIO 76 Os OSMIO 108 Hs HASSIO 61 27 Co COBALTO 45 NEODIMIO PROMESIO 92 93 URANIO Np NEPTUNIO 28 Ni NÍQUEL 46 Rh RODIO 77 Ir IRIDIO Pd PALADIO 78 Pt PLATINO 11 12 IB IIB 29 Cu COBRE 47 Ag PLATA 79 Au ORO 30 Zn CINC 48 Cd CADMIO 80 Hg MERCURIO C 8 N 9 O CARBONO NITRÓGENO OXÍGENO 14 15 16 He HELIO 10 F FLÚOR 17 Ne NEÓN 18 Al Si P S Cl Ar ALUMINIO SILICIO FÓSFORO AZUFRE CLORO ARGÓN 31 Ga GALIO 49 In INDIO 81 Tl TALIO 32 Ge 33 As GERMANIO ARSÉNICO 50 51 Sn ESTAÑO 82 Pb PLOMO Sb ANTIMONIO 83 Bi BISMUTO 34 Se SELENIO 52 Te TELURIO 84 Po POLONIO 35 36 Br BROMO 53 Kr CRIPTÓN 54 I YODO 85 At ASTATO Xe XENÓN 86 Rn RADÓN 109 Mt MEITNERIO 62 Nd Pm Sm U 10 13 7 2 SAMARIO 94 63 Eu EUROPIO 95 64 Gd GADOLINIO 96 Pu Am Cm PLUTONIO AMERICIO CURIO 65 Tb TERBIO 97 Bk BERKELIO 66 Dy DISPROSIO 98 Cf CALIFORNIO 67 Ho HOLMIO 99 Ei EINSTENIO 68 Er ERBIO 100 69 Tm TULIO 101 70 Yb ITERBIO 102 Fm Md No FERMIO MENDELEVIO NOBELIO 71 Lu LUTECIO 103 Lw LAURENCIO 37 Los símbolos de los químicos Dijimos que los átomos de un mismo elemento químico son iguales entre sí y se pueden agrupar bajo el mismo nombre. Así hablamos de átomos de hidrógeno, oxígeno, aluminio, magnesio, etc. En la búsqueda inagotable por simplificar las cosas, los químicos han ideado símbolos que los representan -tal como aparecen en la tabla periódica-. Por lo general, el símbolo está formado por una o dos letras -la segunda en minúsculaelegidas por convención. Suelen coincidir con las primeras del nombre latino del elemento, aunque a veces no es así -como en el caso del plomo, que en latín se denomina plumbun y su símbolo es Pb-. Actividad N…16 a Determinar, utilizando la tabla periódica, a qué elementos corresponden los siguientes símbolos: Hg, Zn, Li, H, Pb, U, F, P, Al, Ca, Se, S, N, O y Si. b Investigue sobre los elementos anteriores e indique en qué materiales es posible encontrarlos. El lenguaje de los químicos: las fórmulas Del mismo modo que han inventado símbolos para nombrar a los elementos químicos, también han ideado un lenguaje simbólico para distinguir mezclas de compuestos y para representar a las moléculas. Si por ejemplo, mezclamos hierro con azufre podemos escribirlo así: Fe + S -----> FeS que representa al sulfuro ferroso. En el caso del agua, tenemos H2O. El número dos como subíndice señala que el hidrógeno tiene dos átomos en la molécula de agua, en tanto que el oxígeno una sola (no hay número como subíndice). Otros ejemplos son el CH4 (metano), NH3 (amoníaco), CO2 (dióxido de carbono). 38 Moléculas y compuestos químicos L lamamos compuesto químico a cualquier sustancia formada por moléculas, todas iguales entre sí, cada una de las cuales posee, como mínimo, átomos de dos elementos distintos. Si los átomos son del mismo elemento, se dice que la sustancia es simple. Si descomponemos agua a través de un procedimiento denominado hidrólisis nos encontramos con que las sustancias finales -hidrógeno y oxígeno- son distintas de la inicial. Por lo tanto, el agua es una sustancia compuesta formada por dos tipos de átomos. En cambio, el oxígeno y el hidrógeno son sustancias simples formadas por un único tipo de átomos. El término molécula (que viene del latín y significa “masa pequeña”) originalmente se aplicó a la última unidad indivisible de una sustancia. A pesar de que el sentido se ha modificado, debemos decir que en cierta forma sigue siendo una estructura simple, ya que no puede desintegrarse sin perder su identidad. Por ejemplo, la molécula de azúcar o de agua puede dividirse en átomos, pero en este caso deja de ser azúcar o agua. Hasta aproximadamente un siglo y medio atrás, no se comprendía ni siquiera la estructura de la molécula más sencilla. A comienzos del siglo XIX los químicos sostenían, ya desde la época de los alquimistas, que las sustancias podían organizarse de dos modos diferentes de acuerdo a como fuera su respuesta al calor. Un grupo de sustancias, por ejemplo sal, plomo, agua, permanecía básicamente inalterado después de ser calentado. La sal podía volverse incandescente, el plomo podía fundirse, el agua se evaporaba; pero al enfriarse era posible que recuperaran su forma original. En cambio, un segundo grupo de sustancias, por ejemplo el azúcar y el aceite de oliva, cambiaban de forma por acción del calor. El azúcar se volvía caramelo y permanecía carbonizado cuando se enfriaba; y el aceite se evaporaba y no podía condensarse al enfriarse. 39 Los investigadores notaron que las sustancias resistentes al calor provenían por lo general del mundo inanimado (del aire, el océano y el suelo), en tanto que las sustancias combustibles provenían del mundo vivo. Así, en 1807 un químico sueco Jons Jacob Berzelius denominó “orgánicas” a las sustancias combustibles, debido a que provenían de “organismos” vivos, e inorgánicas a todas las demás. Desde entonces, es posible clasificar a los compuestos químicos en orgánicos e inorgánicos. Entre los primeros, encontramos aquellos que tienen al carbono como elemento más importante. Se encuentran las proteínas, los lípidos, los hidratos de carbono, las vitaminas, etc., así como los derivados de restos orgánicos como el carbón y el petróleo. Los compuestos inorgánicos, característicos de los materiales minerales, suelen formar moléculas bastante sencillas, como por ejemplo silicatos, carbonatos, ácidos, etcétera. La clasificación anterior, como toda clasificación, contiene elementos arbitrarios. Por ejemplo, el CO2 se considera un compuesto inorgánico, a pesar de que es eliminado por muchos seres vivos en la respiración. El agua también es considerada como una sustancia inorgánica, a pesar de que es el compuesto más abundante en los seres vivos. 40 Actividad N…17 a Lea atentamente y analice el siguiente texto: “Antes de la aparición de la vida en la Tierra, casi todo el carbono se encontraba en combinación con el oxígeno formando el gas atmosférico dióxido de carbono (CO2). Una vez que surgió la vida vegetal, el proceso de fotosíntesis comenzó a transformar las moléculas del CO2 junto con el agua que incorporan los vegetales por las raíces, en moléculas más grandes llamadas glúcidos (hidratos de carbono). Es decir, que por este proceso casi todos los átomos de carbono podrían haber ingresado en los vegetales, de no haber surgido también otro proceso (la respiración) que devuelve continuamente el CO2 a la atmósfera.” b Dando rienda suelta a su creatividad elabore un esquema (puede contener dibujos) que exprese el “viaje” que realiza el carbono en la biosfera (la capa terrestre ocupada por los seres vivos). “Fuerzas vitales” en las sustancias E n 1828, el químico alemán Friedrich Wohler estudiaba cuestiones relacionadas con la química inorgánica, es decir compuestos que nada tenían que ver con los seres vivos. Su maestro, Jons Berzelius, había clasificado la química en química orgánica e inorgánica. Sostenía que las sustancias orgánicas no podían formarse a partir de sustancias inorgánicas en condiciones de laboratorio. Solamente podían formarse en el interior de seres vivos ya que se necesitaba la presencia de la llamada “fuerza vital”. Por adherir a esta creencia Berzelius era considerado vitalista, pues sostenía que la materia que forma parte de los seres vivos obedece a leyes naturales diferentes de las que regulan el comportamiento de la materia inerte. Wohler estaba trabajando con una sustancia llamada cianato de amonio, que al calentarla se transformaba en urea. Es decir: una 41 sustancia inorgánica se transformaba en otra orgánica en el laboratorio, no dentro de un ser vivo. Pero estas evidencias no lograron cuestionar las concepciones vitalistas. Los científicos que adherían a la teoría vitalista consideraban que si bien era posible lograr esas sustancias, en los seres vivos el proceso presentaba una calidad superior, ya que podía realizarse a temperaturas relativamente bajas y con pocas cantidades de sustancias. Por esta época, los químicos sabían que existían dos tipos de fermentos: los que solamente actuaban en los seres vivos, y los que actuaban fuera de ellos. Para poner a prueba el vitalismo, se utilizaron justamente los fermentos. Si actuaban solamente dentro de los seres vivos, al destruir las células que los contenían, los fermentos quedarían destruidos completamente. Eduard Buchner ideó un sistema para triturar células de levadura con arena y así destruirlas completamente. Al filtrar el líquido con las levaduras muertas estudió con el microscopio los jugos que quedaron y reconoció que no había ninguna célula. Agregó al jugo una solución de azúcar e inmediatamente empezó a desprenderse una gran cantidad de burbujas de dióxido de carbono y el azúcar se convirtió lentamente en alcohol. Los químicos supieron entonces que un jugo “muerto” era capaz de llevar a cabo un proceso que se pensaba que solamente ocurría en el interior de las células vivas. El vitalismo no pudo sobrevivir a estas evidencias. A principios del siglo XX, la mayoría de los químicos tenía la convicción de que dentro de los seres vivos no había fuerzas misteriosas. Todos los procesos que ocurren en los seres vivos son llevados a cabo por sustancias químicas, que también pueden ser utilizadas en tubos de ensayo en un laboratorio. 42 Actividad N…18 Las íntimas relaciones que se establecen entre los materiales provenientes de la materia viva y de la materia inanimada fueron durante siglos una de las cuestiones que más ocuparon a químicos y biólogos. ¿Era posible que nuevos seres vivos sugieran de materia inerte? Era común en el siglo XVII, “ver” por ejemplo que salían gusanos del barro, moscas de la carne podrida y hasta ratas de depósitos de estiércol. a Le proponemos realizar un experimento para estudiar las relaciones entre los seres vivos y la materia orgánica e inorgánica. Materiales necesarios cuatro frascos de boca ancha, gasa muy fina, carne vacuna o pescado fresco, arena o aserrín húmedo y tierra. Procedimiento: 1 Coloque el aserrín en el fondo de los dos frascos y luego un trozo de carne o pescado en cada uno. 2 Cubra un frasco con la gasa fina ajustándola fuertemente en la boca del frasco. Deje destapado el otro frasco. 3 Caliente en un recipiente toda la tierra durante 20 minutos para asegurarse de que no existen seres vivos en el interior. 4 Ubique la tierra en cada uno de los dos frascos restantes (aproximadamente hasta la mitad). 5 Cubra un frasco con una gasa del mismo modo que el anterior. Deje el otro destapado. 6 Ubique todos los frascos en un lugar ventilado y abierto (puede ser en el borde de alguna ventana). 7 Realice observaciones periódicas y complete un cuadro como el siguiente. Puede ayudarse con una lupa para observar con mayor detalle. semana 1 2 3 frasco 1 observaciones frasco 2 frasco 3 frasco 4 b Anote tres conclusiones que obtenga a partir de las observaciones realizadas y explique si, efectivamente, los seres pueden originarse a partir de materia orgánica en descomposición y/o de materiales inorgánicos. c Anote tres conclusiones en las que detalle sus ideas sobre la posibilidad o no de la “generación espontánea” de los seres vivos. La química y la industria L as industrias químicas transforman a gran escala las sustancias naturales en otras sustancias útiles para el consumo humano. El proceso se inicia con alguna materia prima que sufre una serie de transformaciones hasta alcanzar un producto final. Las industrias químicas se suelen clasificar según las materias primas y los productos que desarrollan. Existen industrias químicas de base que utilizan materias primas y obtienen productos intermedios que son usados por otras industrias químicas, como por ejemplo, la metalurgia, la petroquímica, la industria del amoníaco, del ácido sulfúrico, etc.; y otras industrias llamadas de transformación que utilizan los productos de las anteriores, como la del automóvil, la farmacéutica, la textil, la alimentaria, del plástico, perfumes, vidrio, detergentes, pinturas, etcétera. Un ejemplo: la siderurgia La metalurgia es el conjunto de procesos que permiten la extracción de metales a partir de los minerales que los contienen. La metalurgia del hierro se denomina siderurgia. Analicemos el proceso. El hierro se obtiene tratando sus óxidos con carbón de coque en altos hornos. El alto horno es un gran recipiente vertical, por cuya parte superior se introducen los óxidos de hierro y el coque. Por la parte inferior se inyecta aire a elevada temperatura. El hierro obtenido se llama fundición y contiene entre un dos y un cinco por ciento de carbono, además de pequeñas cantidades de fósforo, 44 azufre, manganeso y silicio, y se recoge en forma líquida. Los residuos que se formaron son separados de la fundición por otros conductos. A partir de la fundición se obtienen los siguientes tipos de hierro: hierro dulce, que tiene un contenido en carbono muy bajo, y acero que tiene un porcentaje un poco mayor de carbono. Con el acero se elaboran piezas para la construcción de edificios, puentes, etc. Si tiene más carbón, se elaboran herramientas como martillos, destornilladores, tenazas. El hierro se oxida con facilidad, reaccionando con el oxígeno del aire y la humedad atmosférica. Este fenómeno, que también ocurre en otros metales, se conoce con el nombre de corrosión. 45 Actividad N…19 Un tema para estudiar: “La contaminación industrial” a Revise los Módulos1 y 2 de Ciencias y Tecnología. b Busque en la biblioteca información sobre tipos de contaminación que generalmente producen las industrias, por ejemplo al eliminar compuestos tóxicos sobre las aguas, el aire o el suelo. Elija una de ellas. c Averigüe cuál es el estado legal de esta cuestión. Es decir, si la actividad de la industria elegida está controlada por alguna normativa legal o no. d Recoja algunos comentarios sobre el tema, de personas conocidas o vecinos de alguna industria. e Mire noticieros de la televisión y observe si se presenta alguna noticia sobre este problema. f Finalmente, con toda la información obtenida elabore un informe para comentar con sus compañeros en el encuentro presencial. Un día de gran contaminación atmosférica en la ciudad de México 46 Hasta aquí usted ha estudiado átomos, moléculas, sustancias y cambios que ocurren en los materiales. Vimos que los seres vivos también están formados por distintos materiales (orgánicos e inorgánicos). Para cerrar esta primera parte del módulo le proponemos “recrear” un ingenioso experimento histórico, muy habitual entre los alquimistas. Actividad N…20 La búsqueda de oro Le proponemos un experimento que a partir de una reacción química siguiendo a los alquimistas, nos permitirá “transmutar” cobre en “oro”. El experimento, en realidad, simulará que se ha formado oro. Materiales necesarios vaso de precipitado; tela metálica con centro de amianto; trípode; varilla de vidrio; 200 cm3 de agua para disolver aproximadamente 30 gr de cloruro de zinc. Procedimiento: 1 Caliente la solución formada hasta su ebullición y luego agrege unas granallas de zinc (3 ó 4). 2 Introduzca con una pinza una moneda de cobre. Déjela sumergida unos minutos hasta que se observe un cambio en la coloración. 3 Retire la “nueva” moneda de la solución con una pinza metálica y caliéntela en la llama fría del mechero. ¿Qué pasó? Nota: En las condiciones anteriores, inicialmente se ha producido un depósito de zinc sobre la superficie del cobre. Luego al llevar a la llama, el contacto del zinc con el cobre que se encuentra debajo forma bronce. 47 Las Unidades de la Vida E n la primera parte de este libro usted ha estudiado cómo la química permite aclarar cuestiones relacionadas con los cambios que ocurren en los materiales y las principales características que éstos presentan. En esta segunda parte, se estudiará la estructura de los seres vivos, sus características y algunos cambios que se producen en ellos. En el Módulo 2 de Ciencias y Tecnología se explicó que el cuerpo humano está formado por células y que éstas pueden ser vistas con instrumentos adecuados. Durante el siglo XIX se produjo un notable desarrollo en los aparatos, esto permitió analizar con bastante detalle la estructura celular y realizar importantes experimentos. Se observaron múltiples seres vivos. Actividad N…21 a Revise el Módulo 2 de Ciencias y Tecnología y resuma brevemente en un esquema las características principales de los microscopios. b Busque en otras fuentes bibliográficas más información sobre microscopios, por ejemplo consultando una enciclopedia. 49 La Célula y su Teoría L as células habían sido observadas y bautizadas, durante el siglo XVII. La historia revela que en 1665 el investigador inglés Robert Hooke, observando a través de uno de los primeros microscopios una fina lámina de corcho, “vio” una multitud de diminutas cavidades estrechamente pegadas unas con otras. Actividad N…22 Estos dibujos históricos muestran observaciones realizadas al microscopio de estructuras celulares y los esquemas actuales sobre células. 50 a Trate de reconocer alguna estructura común en ambos tipos de dibujos. b Para discutir en grupo: si no supiéramos que estas estructuras son células, ¿qué veríamos en los esquemas? Es decir, ¿cuándo vemos algo, todos vemos lo mismo? Hooke expuso sus observaciones ante la recién formada Royal Society de Londres, con las siguientes palabras: “... pude percibir con una claridad meridiana que estaba todo (el corcho) perforado y lleno de poros, lo mismo que un panal de miel, sólo que sus poros no eran regulares; no obstante no difería para nada de un panal de miel en estos aspectos: Primero, en que tenía muy poca sustancia sólida, en comparación con la cavidad vacía que se hallaba contenida entre (...), porque los intersticios, o paredes (como puedo denominarlas), o particiones de dichos poros, eran casi tan finos en proporción a sus poros, como lo son las películas de cera de un panal de miel (que encierran y constituyen las células sexangulares) en proporción a los suyos. Segundo, en que estos poros o células, no eran muy profundos, sino que estaban formados por muchísimas cajitas, separadas una a una a lo largo de un poro muy largo, por ciertos diafragmas.” Robert Hooke, Micrographia, Londres (1665); reproducción facsímil de Culture et Civilisation, Bruselas (1966), p. 113. Las observaciones realizadas en tejidos animales no resultaban muy claras. La noción de que tanto las plantas como los animales estaban formados por unidades vivas (las células) tardó mucho en llegar. Esta demora se debió en parte quizás a la imperfección de los primeros microscopios. Recién a principios del siglo XIX comenzaron a hacer su aparición microscopios con objetivos más precisos. Una vez que fue incorporado a la tarea científica este progreso técnico, el creciente interés sobre el tema permitió que los estudios se multiplicaran. Theodor Schwann publicó en 1839 las conclusiones de su trabajo que en la actualidad son consideradas como inaugurales para la denominada teoría celular. 51 La fibra como unidad Varios pensadores y médicos antiguos, como Erasistrato y Galeno, concebían al cuerpo formado por un tejido confeccionado por arterias, venas y nervios. Esta creencia en que el cuerpo en último término está constituido a base de fibras huecas, era compartida por la mayoría de los científicos. Pensaban que actuaban como simples “pipas” para la transmisión de los vitalizadores átomos del alma. Avanzado ya el siglo XVIII, se produjo una modificación significativa en la teoría de la fibra que sostenía que las fibras no eran meros transmisores huecos de los efluvios vitales, sino que ellas mismas estaban vivas. Eran unidades vivas con que estaba compuesto el cuerpo humano. Las fibras que, según esta concepción, forman el tejido de todas las partes del cuerpo existían en un estado de tensión, y esta tensión era la responsable del fenómeno de la vida. Asimismo se interpretaba la muerte como la pérdida de esta tensión vital. Estas ideas prevalecieron mayoritariamente entre los especialistas antes de la introducción del microscopio. Esto muestra la estrecha relación existente entre la tecnología y los desarrollos llevados a cabo por la ciencia. Pero durante la década de 1830, y a pesar de la disponibilidad cada vez mayor de estos instrumentos enormemente mejorados, no resultó inmediatamente claro que los cuerpos de todos los organismos macroscópicos estuvieran constituidos -aun siendo similarespor unidades básicamente similares; o que estas unidades fueran células en el sentido que hoy se le puede dar a ese término. El naturalista Jean Baptiste de Lamarck (creador de la palabra “biología”) en su obra Filosofía zoológica publicada en 1809, insistía en que las partes sólidas de los cuerpos animales estaban constituidas por material celular. Sin embargo, no se interesaba por las células en si, sino únicamente en el tipo de arquitectura que tenían los tejidos del cuerpo. Diversos investigadores de la primera mitad del siglo XIX hicieron una aproximación más rigurosa a la genuina teoría de la célula y explicaron que el cuerpo estaba constituido por “glóbulos” microscópicos. 52 Está claro que este concepto se acerca mucho al concepto moderno de célula. Sin embargo, falla en dos puntos: • primero nunca se demostró que el glóbulo fuera otra cosa más que una simple unidad arquitectónica de tejido vivo. • segundo el término glóbulo fue aplicado a una amplia extensión de objetos. Puede ser que muchos científicos “globulistas” hayan visto lo que hoy día consideramos células pero, indudablemente también habrán observado todo tipo de estructuras, aberraciones producidas por las lentes, halos de difracción, gotitas de aceite, etc., que de un modo bastante indiscriminado fueron ubicados bajo el encabezamiento general: glóbulo. Los primeros pasos en el camino hacia el conocimiento moderno fueron dados por el botánico Robert Brown quien en 1833 estableció que los tejidos de las plantas estaban compuestos por células nucleadas. Esta observación de que las células de las plantas tenían núcleos fue crucial. Los histólogos (biólogos especialistas en el estudio de tejidos, es decir conjuntos de células de características similares) también advirtieron la presencia de núcleos en varios tejidos animales. Y lo que fue más importante, detectaron núcleos en tejido esquelético en desarrollo, porque estaba claro que los cartílagos y los huesos poseían una organización celular. El investigador Theodore Shwann observó la presencia de células en el interior del cordón dorsal (notocorda) en desarrollo de peces y anfibios embrionarios. En 1839 describió los métodos que había empleado en el estudio de ese tejido y señaló que la notocorda se asemeja con gran exactitud a cierto tejido celular de las plantas. Sin embargo, hizo falta la unión de un botánico y un zoólogo para generar la teoría de la célula. El zoólogo fue Schwann; el botánico, Matías Schleiden quien consideró al núcleo como el citoplasto o centro generativo de la célula. De hecho, fue más allá. Propuso que el nucleolo que había descubierto durante sus investigaciones, primero formaba el núcleo, y éste, a su vez, formaba la célula. Schleiden también opinaba que las células podían ser vistas desde dos aspectos diferentes: en primer lugar, como unidades independientes de vida y desarrollo, y en segundo lugar, como elementos que ayudan 53 a constituir una comunidad multicelular -la planta-. Él fue uno de los primeros en ver a la planta como una comunidad de células o, como él la llamó polystok. Actividad N…23 a Averigüe en un libro de texto si las afirmaciones de Schleiden sobre el núcleo, el nucleolo y la formación de una célula son consideradas correctas en la actualidad. b Discuta en grupo si efectivamente, las células pueden ser consideradas unidades “independientes de vida y desarrollo”. Con la publicación en 1839 de su obra central Mikroskopische Untersuchungen, Schwann estableció la idea que después sería aceptada, de que los animales y las plantas compartían un principio arquitectónico común: ambos están compuestos por células. Así, se concluyó que cada célula lleva una especie de “doble vida”: una independiente, que pertenece a su propio desarrollo y otra comunitaria, en la medida en que forma parte integral de un ser vivo. Esta idea encontró numerosos adeptos. Quizá la voz más influyente fue la que habló de la célula como la unidad de vida. Rudolph Virchow, en su obra más importante insistió en que las células no se originan de nuevo cada vez, sino que todas descienden de células preexistentes. Esta importante intuición se encuentra encerrada en la famosa frase de Virchow: “omnis cellula e cellula”, toda célula proviene de otra célula. Actividad N…24 a Vuelva a leer las ideas de Schleiden y Schwann sobre el origen de las células teniendo en cuenta la afirmación de Virchow. b Relacione sus conclusiones con los resultados del experimento realizado en la Actividad N…18 sobre el origen de los seres a partir de materia orgánica o inorgánica. 54 Virchow puso de relieve el significado de la teoría de la célula proponiendo una analogía entre los organismos biológicos y sociales. Comparó explícitamente a las células con los individuos que viven en un estado. Frecuentemente se refiere a organismos como a “repúblicas celulares” o “estados celulares democráticos”. Así, la enfermedad por ejemplo, no tenía su origen en alguna misteriosa entidad interior, sino en el mal funcionamiento de ciertas células. La célula era, pues, tanto unidad de vida como unidad de enfermedad. Alquimia y enfermedad Entre los siglos XVI y XVII surge una nueva escuela de investigadores, llamada de los iatroquímicos. Estos estudiosos utilizaban los conceptos y las prácticas de químicos y alquimistas para preparar remedios y para explicar muchos procesos que ocurren en los organismos vivos. Uno de los personajes centrales del movimiento fue Theophrastus Philipus Aureolus Bombastus von Hohenheim, conocido como Paracelso (apodo que se puso él mismo para mostrarle al mundo que era más -para- que Celso, un escritor romano del siglo I que había recopilado todo el saber médico de la época). Uno de los aportes más originales de Paracelso fue la introducción de una nueva idea sobre la enfermedad, muy diferente a la que existía entonces. Hasta Paracelso, la enfermedad era considerada como un desequilibrio humoral (es decir, entre los líquidos internos del cuerpo). Una persona podía tener muchos o pocos humores según su personalidad, por lo que había tantas enfermedades como personas. Pero Paracelso sostuvo que había causas externas para las enfermedades. Algunas enfermedades que descubrió eran causadas por minerales que al entrar al cuerpo se apoderaban de alguna zona y provocaban la enfermedad. El tratamiento debía, entonces, estar destinado a neutralizar la acción de la sustancia externa y no a equilibrar líquidos. 55 El cuerpo era “visto” por este científico como la suma total de sus células individuales. Tras muchos debates, mucha argumentación y mucha oposición, la teoría de la célula en la versión vislumbrada por Virchow poco a poco fue superando a sus críticos durante la segunda mitad del siglo XIX. Resultaba cada vez más claro que las células eran las unidades básicas y funcionales del cuerpo y que el conocimiento de sus propiedades explicaba mucho acerca de las propiedades de un organismo. La aparición de los microscopios electrónicos en la segunda mitad del siglo XX y los progresos de la bioquímica, la genética y las técnicas de laboratorio permitieron investigar los mecanismos internos de esta “cajita particular”. En las fronteras de lo viviente, se han descubierto otros seres aun más pequeños: los virus, que sólo pueden crecer y reproducirse cuando invaden a una célula. Se puede afirmar, pues, que no hay vida sin células. 56 Parecidas y diferentes, pero todas células E l mundo celular es de una infinita diversidad. Pero, ¿qué hay de común entre una bacteria, una ameba, una célula de lechuga, una neurona, un espermatozoide y un óvulo? Dada la gran diversidad de modos de vida, de forma, de tamaño (desde unos micrómetros en el caso de una bacteria hasta un metro en el de ciertas neuronas), la unidad del mundo celular ha escapado durante largo tiempo a los investigadores. Pero todos los tipos celulares están caracterizados por la misma lógica de organización y los mismos elementos fundamentales (proteínas, glúcidos, lípidos y ácidos nucleicos). Biolementos y biomoléculas E ntre los elementos químicos que constituyen a los seres vivos, podemos mencionar los siguientes: carbono (C), hidrógeno (H), oxígeno (O), nitrógeno (N), fósforo (P) y azufre (S) constituyen el 96 por ciento de la masa total de un organismo. El 4 por ciento restante está formado por calcio (Ca), sodio (Na), potasio (K), magnesio (Mg), hierro (Fe), iodo (I), entre otros. Los bioelementos se combinan entre sí para formar biomoléculas que se clasifican habitualmente en seis grandes grupos: 58 1 Los glúcidos, formados por carbono, hidrógeno y oxígeno. Son la fuente primaria de energía para el funcionamiento de la mayoría de las células. 2 Lípidos, también formados por carbono, hidrógeno y oxígeno; son elementos constitutivos de las membranas de las células. También suelen almacenarse como sustancias de reserva de las células. 3 Las proteínas, formadas por carbono, hidrógeno, oxígeno y nitrógeno. Son los constituyentes principales de la mayoría de las estructuras del cuerpo de un ser vivo (músculos, pelo, piel, uñas, entre otras estructuras). 4 Las enzimas son un tipo particular de proteínas cuya función consiste en posibilitar la existencia de reacciones químicas en la célula. Existen enzimas específicas para cada tipo de reacción. 5 Las vitaminas son una multitud de compuestos químicos diversos. Su función principal es facilitar la acción de las enzimas en reacciones químicas muy complejas. 6 Los ácidos nucleicos, constituidos por carbono, hidrógeno, oxígeno, nitrógeno y fósforo, se pueden clasificar básicamente en dos tipos: el DNA (ácido desoxirribonucleico) y el RNA (ácido ribonucleico). El DNA es una macromolécula que contiene información genética que se transmite mediante la herencia. Modelo de ADN Modelo de acción de una enzima Actividad N…25 a Busque ejemplos de glúcidos, lípidos, proteínas, enzimas y vitaminas. Averigüe en qué lugares del cuerpo humano se encuentran o actúan. b Elabore un cuadro con la información obtenida. 59 Toda célula está rodeada por una barrera, la membrana plasmática, formada por un agregado de lípidos y proteínas. Esta barrera delimita un compartimento cerrado que contiene una solución viscosa, el citoplasma, en el cual están concentradas miles de moléculas diferentes. Modelo de membrana celular 60 La organización celular E l mundo de las células está dividido en dos formas de organización fundamentalmente diferentes: las células procariotas (como las de las bacterias) y las células eucariotas (por ejemplo, todas las células del cuerpo humano). En las primeras, la organización es bastante más simple. La célula eucariota contiene un gran número de pequeños compartimentos, los orgánulos, rodeados de membranas. Los orgánulos se dividen el trabajo dentro de la célula. Sólo las células eucariotas pueden asociarse para formar organismos complejos. En éstos cada célula puede especializarse en una función particular desarrollando estructuras propias y sustancias químicas específicas. Esquema de célula eucariota Esquema de células procariotas Una de las primeras células observadas por el naturalista holandés Antonie van Leewenhoek en el siglo XVIII, el espermatozoide, en cuya estructura hay tres partes bien diferenciadas: cabeza, cuello y cola. Esquema de un espermatozoide humano ¿Cómo se forman los organismos? Durante el siglo XVII existieron dos teorías que intentaron, por caminos opuestos, dar respuesta a cómo se forman los organismos, especialmente los seres humanos. La primera, conocida con el nombre de ovismo, suponía que el óvulo (célula aportada por la madre) asumía exclusivamente la función de elemento reproductor. Esta idea se reforzaba con “observaciones” que mostraban que el feto ya estaba completamente en el óvulo cuando todavía se encontraba en el ovario. La otra teoría, conocida con el nombre de animalculismo, a diferencia de la anterior sitúa el feto preformado en el espermatozoide. 62 Actividad N…26 a Explique en media página en qué consiste el proceso de desarrollo embrionario. Puede consultar el Módulo 4 de Ciencias y Tecnología. b Confronte la información que obtenga con las teorías anteriores. 63 La Fábrica Celular C omo en una fábrica, en la célula entran materiales en bruto y se fabrican productos manufacturados. La producción está organizada alrededor de cadenas de montaje y emplea “unos obreros especializados”, las enzimas. Estas enzimas son sustancias químicas con alta especificidad, es decir cada una de ellas lleva a cabo un determinado tipo de reacción de “armado” (síntesis) o “desarmado” (degradación) de moléculas. Como en una fábrica, hay otras biomoléculas, que “hacen de capataces”: vigilando las operaciones. También existen aquellas que almacenan la información y coordinan el programa de actividades. Consideremos una célula especializada en la fabricación de una sustancia, la insulina y para ver la dinámica que conduce a la liberación del producto en la sangre. La información básica para la actividad de esta célula está alojada en el ADN, verdadera cinta magnética en la que está grabado todo el plan de fabricación. En las células eucariotas el ADN está confinado en un campartimento llamado núcleo de la célula. De modo que la información debe ser exportada desde allí hasta el citoplasma donde se llevará a cabo la fabricación de insulina. En el citoplasma no solo se hallan las estructuras (ribosomas) donde se realiza la fabricación de insulina sino también aquellos orgánulos que se encargarán del “fraccionamiento, embalaje y etiquetado” del producto. Así como se puede bloquear un taller de una fábrica o reducir su ritmo, también la célula puede ajustar el funcionamiento de sus cadenas de montaje en función de materias primas disponibles, de los constituyentes que debe fabricar y de los encargos que recibe del resto del organismo. 64 Actividad N…27 a Complete (con ayuda bibliográfica) las distintas secciones de la “fábrica” que presentamos a continuación. No obstante, la comparación con una fábrica tiene sus límites. Debido a su origen, a la cantidad de trabajos que realizan las moléculas especializadas y a la plasticidad de sus estructuras, la célula es un sistema infinitamente más complejo que la más sofisticada de las fábricas. 65 La energía de la célula L os procesos de síntesis que ocurren en una célula consumen energía. También el mantenimiento y el buen funcionamiento de la maquinaria celular requiere energía. La moneda de cambio de la energía en el citoplasma de la célula es una pequeña molécula, conocida como ATP (adenosina trifosfato). Esta molécula se renueva constantemente gracias a la combustión “a fuego lento” de azúcares o grasas. En la mayoría de las células eucariotas, esta combustión se realiza en los orgánulos conocidos como mitocondrias, donde mediante el consumo de oxígeno, los azúcares y grasas son degradados integramente produciendo dióxido de carbono (CO2). En este proceso conocido como respiración es celular donde también se forma el ATP. La mayoría de las células absorben de su medio los azúcares (el combustible) de modo que es preciso que en el mundo de los seres vivos haya una fuente que provea permanentemente esta sustancia. Son las células vegetales las que gracias a la clorofila captan la energía Sol utilizándola para fabricar estos azúcares a partir del CO2 de la atmósfera. Actividad N…28 a Revise sus conocimientos sobre fotosíntesis desarrollados en el Módulo 2 de Ciencias y Tecnología y complete el siguiente esquema. 66 Toda célula viene de otra célula E l paso desde la célula inicial única al individuo completo, se realiza por medio de un gran número de divisiones celulares planificadas, llamadas mitosis. La mitosis es un proceso en varias etapas entre las que se incluye la duplicación del ADN de la célula, la formación de dos nuevos núcleos y por último, la separación en dos células hijas que poseen exactamente el mismo material genético. En las células procariotas, que carecen de núcleo, una vez replicado el ADN la célula simplemente se escinde y se forman dos células genéticamente idénticas. Actividad N…29 Si en su centro cuentan con algunos materiales de laboratorio, usted, con la colaboración del docente podrá realizar la siguiente experiencia para observar el proceso de mitosis. Materiales necesarios un microscopio; solución de alcohol acético (3 partes de alcohol común y 1 parte de ácido acético. Se debe preparar en el momento de usarlo; ácido clorhídrico normal (ácido clorhídrico común: 82ml, agua 1.000 ml); colorante: carmín acético (1 gr. de carmín en 45 ml de ácido acético; calentar suavemente, agregar 55 ml de agua; dejar enfriar y filtrar con papel de filtro). Procedimiento: 1 Llene un frasco de boca ancha con agua. 2 Coloque una cebolla de forma tal que sus raíces toquen la superficie del agua. Deje pasar algunos días hasta que las raíces alcancen alrededor de un centímetro de longitud. 3 Luego, corte las raíces y sumérjalas en solución de alcohol acético (fijador), durante 20 ó 30 minutos (hasta 24 horas). 4 Lave las raíces con agua y sumerja 15 minutos en un recipiente con carmín acético. 67 Pase una raíz a un portaobjeto, colocando también una gota de colorante. 6 Triture 2 mm del extremo de la raíz usando para eso agujas de inyección a las que se les dobla la punta. 7 Separe la parte no triturada. Se debe tener cuidado de que no se seque el colorante. 8 Coloque suavemente el cubreobjeto sobre el material triturado, cúbralo con un papel de filtro apoyando el dedo pulgar haciendo presión en sentido vertical cuidando que no se deslice. 9 Seque el preparado con un papel de filtro y coloque gotitas de colorante junto al borde del cubreobjeto para que tome contacto con el material de observación. 10 Luego de 15 minutos puede realizar la observación al microscopio. 5 En lugar de carmín acético también se puede usar orceína acética. ¿Por qué no todas las células del organismo son iguales? T odas las células poseen el mismo lote de genes. Pero sólo algunos de ellos se expresan, es decir, codifican proteínas. La expresión diferencial de los genes se pone en marcha durante el desarrollo del embrión: es la diferenciación celular. Así, las células precursoras de los glóbulos rojos traducen principalmente el gen que codifica la hemoglobina. Este gen, en cambio, está totalmente “mudo” en todas las demás células del organismo. En una célula muscular, se expresan sobre todo los genes de las proteínas del citoesqueleto. La insulina es fabricada por células del páncreas. ¿Qué regula en último término toda la maquinaria celular? ¿Por qué un gen se expresa en ciertas células y no en otras? ¿Cómo orientan las células de un embrión su diferenciación en función de la posición que ocupan? Todos estos son problemas cuya resolución aún es motivo de investigación. 68 La Tercera Edad en las Células E n general, una célula diferenciada raramente se divide. Las neuronas son incapaces de hacerlo. Si el hígado está dañado, en cambio, las células de este órgano pueden regenerarlo proliferando, multiplicándose. Al cabo de un cierto tiempo, variable según los tipos celulares (de dos a tres días para las células del intestino, tres meses para los glóbulos rojos, decenios para las neuronas), la renovación de los constituyentes internos y la eliminación de los desechos se frenan y la célula acaba por morir. Las células muertas pueden ser sustituidas por otras células, por ejemplo, las células de la base de la epidermis sufren múltiples divisiones. Sus células hijas o bien se diferencian y producen queratina (proteína característica de la piel) hasta morir y escamarse, o bien permanecen en la base a modo de reserva. Pero el capital de divisiones que puede sufrir una célula es limitado, siendo éste uno de los factores de envejecimiento de los tejidos y los organismos. Micromundo E se mundo extraño en el que hunde sus raíces la vida, un mundo en las fronteras de lo animal, lo vegetal y lo molecular, es el de los protistas, las bacterias y los virus. Es tan pequeño que escapa a los sentidos humanos y las descripciones históricas que estudiamos nos han mostrado una diversidad de teorías sobre este mundo. Dada la dificultad para representarse una longitud inferior al milímetro, es necesario contar con un instrumento capaz de “sumergirse” en lo infinitamente pequeño: una escala de referencia. Vimos que el microscopio óptico nos permite conocer células, ya que amplía los objetos mil veces, permite observar magnitudes del orden del micrómetro o micra (una milésima de milímetro). El microscopio electrónico cuyo poder de ampliación es de quinientos 69 mil, permite ver moléculas muy grandes, de diez a cien nanómetros (1 nanómetro = l millonésima de milímetro). Un microscopio ultrapoderoso agranda los objetos un millón de veces. Con semejante instrumento, una molécula mediría un milímetro; una pulga (un milímetro) tendría el tamaño de una manzana urbana; una persona de un metro setenta, tendría una estatura de 1.700 kilómetros! Escala de referencia Escala real 1700 k m 1 . 70 m hombre 1 km 1 m i l í m e t ro pulga 100 m 100 micrómetros paramecio 10 m 10 m i c r ó m e t ro s célula 1 m 1 m i c r ó m e t ro bacteria 10 cm 10 0 n a n ó m e t ro s virus 1 cm 10 n a n ó me t ro s proteína 1 mm 1 n a n ó m e t ro moléculas 1/ 100 de m m 0.01 nanómetros átomo 70 Otra escala importante es la de la complejidad, que se puede medir por la cantidad de “letras” de los planos químicos hereditarios que permiten la reproducción del virus, la bacteria o la célula humana. El plano de un virus como el de la hepatitis B contiene un código genético de 3.182 “letras”, que equivale a una página de 3000 caracteres, a razón de 60 caracteres por línea y 50 líneas por página. El de una bacteria contiene tres millones de letras, o sea mil páginas de tres mil caracteres (una enciclopedia de cinco centímetros de grosor). Finalmente, el plano de una célula humana contiene tres mil millones de “letras”, es decir, el equivalente de una pila de mil enciclopedias de mil páginas, que alcanzaría una altura de cincuenta metros (un edificio de veinte pisos). Los seres vivos eran divididos hasta principios de siglo, en dos grandes reinos: animal y vegetal. Como se explicó en el Módulo 2 de Ciencias y Tecnología uno se distingue del otro por la forma de alimentación. Los animales se alimentan de vegetales o de otros animales; no fabrican sus propios alimentos sino que los toman de afuera; son heterotrófos. Los vegetales, gracias a la clorofila, transforman la energía luminosa del Sol en energía química que utilizan para fabricar los alimentos y combustibles necesarios para conservar sus funciones vitales: son autótrofos. Si por un lado es fácil incluir al perro entre los animales y al árbol entre los vegetales, no sucede lo mismo con organismos como los protistas, que se comportan a veces como unos, a veces como otros, por ello se los ubicó en un reino aparte. Las bacterias, por su tipo celular particular, procariota, también se ubican en un reino separado, conocido como monera. En cuanto a los virus, algunos científicos se preguntan si no son moléculas químicas complejas a las que no se puede clasificar entre los seres vivos. Una particularidad de estos microorganismos (protistas y bacterias) en relación con los animales y los vegetales superiores es que se componen de una sola unidad morfológica elemental, la célula, que podemos pensar como una especie de gota microscópica de jalea viva. No obstante los organismos superiores, formados por millones de millones de células, también pasan por el estado unicelular; esto 71 sucede, en el momento de la reproducción sexual. Por otra parte, todas sus células, incluso las más complejas y diferenciadas, poseen una estructura comparable con la del protista más simple. Es por ello que conviene indagar ante todo en los microorganismos. Actividad N…30 Observe los siguientes esquemas y organice de acuerdo con el tamaño (de menor a mayor) las siguientes estructuras: célula animal, célula vegetal, bacteria, virus, núcleo celular, lisosoma, mitocondria y cloroplasto. 73 Los Virus L os virus representan quizás el límite entre lo vivo y lo no vivo. No son células. No pueden moverse, ni alimentarse en forma independiente. Sólo pueden reproducirse, pero dentro de una célula a la que parasitan. Es decir, podemos pensar que un virus “vive” si está dentro de una célula. 74 Pandemia, epidemia y endemia La epidemiología es la ciencia que estudia la forma en que se presentan, transmiten y previenen las enfermedades. Deriva de la palabra epidemia (del griego, sobre el pueblo) término que se aplica a la aparición repentina en una región geográfica de una enfermedad infectocontagiosa que se propaga rápidamente entre los habitantes. Existen asimismo, enfermedades que son locales, es decir, habituales en una región o localidad determinada. En este caso se habla de endemia. En cambio, si una enfermedad infectocontagiosa se inicia en un país y se extiende hacia otras naciones, se dice que se trata de una pandemia. Estudiaremos las principales características de los virus a través de su acción en una enfermedad que periódicamente nos lleva a tomar vacaciones obligadas: la gripe. Se trata de una enfermedad vírica, que representa un auténtico problema de salud en todos los países del mundo. Muchos especialistas consideran que se trata de la última gran sobreviviente de las grandes pandemias que han marcado la historia de la humanidad. Si bien se sabe mucho sobre la gripe, sus características, algunas formas de prevención, de control, estamos lejos de conocer todos sus misterios, como por ejemplo, las relaciones que establece el virus con las células o los modos de propagación. La gripe como enfermedad contagiosa era conocida en la Antigüedad. Las primeras explicaciones apelaban a la llamada “conjunción” de los planetas, que determinan la ocurrencia de males terribles sobre las poblaciones humanas. Sin embargo, la primera descripción de las epidemias de la gripe es más tardía. Recién en 1851, Theóphillus Thompson publicó un libro sobre las epidemias en Gran Bretaña desde 1510 hasta 1837. La palabra influenza se utilizó por primera vez en Inglaterra en el siglo XVIII para describir la epidemia de 1743, ya que el carácter estacional de la enfermedad hacía sospechar la influencia de un fenómeno exterior al organismo humano. En los países del hemisferio sur se producen desde abril hasta octubre aproximadamente; en los del hemisferio norte, de noviembre a abril. 75 El ABC de la Gripe E n la actualidad, se estima que el virus de la gripe ha causado entre 15 y 20 millones de muertes. Además de manifestarse como pandemia mundial, la gripe se manifiesta en epidemias nacionales o regionales. Ataca a todas las edades, y especialmente a los niños, aunque reviste mayor gravedad entre los ancianos. La variabilidad de la gravedad y la extensión geográfica de las epidemias está relacionadas con la existencia de tres tipos de virus gripal: los tipos A, B y C. En la cubierta, estos virus presentan proteínas que se modifican permanentemente, de allí el origen de las múltiples variantes del virus. El tipo C no provoca epidemia en el hombre. El tipo A es el único virus que afecta a las vías respiratorias y sus epidemias influyen claramente en la curva de mortalidad bruta de un país Epidemia de gripe según edad. Estimación a nivel mundial. Epidemia de gripe tipo A en di i d l d Una de las hipótesis más aceptadas sobre la propagación del virus de la gripe fue formulada en 1945 por Frank Macfarlane Burnet, de la Universidad de Melbourne (Australia). Sostiene que la misma epidemia de gripe se produce con seis meses de intervalo entre el hemisferio norte y el sur, debido a la transmisión de los virus entre los individuos por la migración de personas entre los dos. Otras hipótesis excluyen a las personas y sostienen que algunas grupos de aves son portadoras del virus de un hemisferio al otro. Pero esta conjetura ha quedado descartada, ya que actualmente se considera que son los efectos climáticos estacionales los que explican el desfasaje de seis meses entre una epidemia en un hemisferio y la misma epidemia en el otro hemisferio. La gripe es una enfermedad estacional que se presenta en invierno en los países templados (hay casos esporádicos en verano). Aunque podría pensarse en la influencia del frío sobre los mecanismos de defensa de las vías respiratorias, es probable que las causas estén relacionadas con los cambios en la actividad humana que tienen lugar en invierno, como por ejemplo, la vida social en grupos en lugares poco ventilados. A fines de la década del ‘70 se propuso una explicación para los mecanismos de transmisión del virus : los sujetos afectados por la gripe (del tipo A, la más virulenta) muy rara vez transmiten la enfermedad, ya que el virus pasa rápidamente a un estado latente a nivel de las vías respiratorias (se queda en “reposo” en el interior de las células broncopulmonares). Estos sujetos se transforman en portadores asintomáticos y desarrollan una inmunidad específica contra el virus. En la estación siguiente, un “estímulo externo estacional” reactiva el virus. Éste fabrica partículas víricas idénticas a sí mismo, de modo que el sujeto portador se convierte en infeccioso durante un corto período, aunque sin manifestar, la mayoría de las veces sin síntoma alguno. En contacto con el individuo portador los sujetos no inmunizados pueden iniciar un nuevo ciclo de infección. Así, es posible que la enfermedad se desarrolle rápidamente. La lucha contra las epidemias se centra en la utilización de vacunas y medicamentos específicos de la gripe. Debido a que la inmunidad decrece con el tiempo, la vacunación se debe repetir cada año. 77 Actividad N…31 a Realice una pequeña encuesta entre aproximadamente 10 personas conocidas y pregúnteles qué origen tiene la gripe, cuál es la razón posible del carácter estacional de la enfermedad y qué alternativas conocen para enfrentarla. b Clasifique las respuestas y elabore por escrito una primera conclusión con las respuestas obtenidas. c Compare su conclusión con la de otro estudiante. d Finalmente, elabore un póster o lámina ilustrativa que contenga las conclusiones y pueda ser colocada en un lugar visible en su centro. Actividad N…32 Diario Perfil. Extracto de la página 25 8 de julio de 1998. a Lea los artículos que presentamos a continuación SOCIEDAD - 25 PERFIL- Miércoles 8 de julio de 1998 Recomiendan vacunarse La respuesta del SAME a llamados sin urgencia demora cinco horas, tres más que en condiciones normales VIRUS DE INVIERNO La gripe ya afecta a miles de porteños y ya provoca demoras en el SAME Las llamadas de pacientes engripados al Servicio de Atención Médica de Emergencia creció un 200 por ciento y ya se superaron todos los récords. El incremento repercutió principalmente en la velocidad de respuesta a los requerimientos. El titular del SAME pide paciencia ante las demoras y sugiere que se evite llamar cuando no es imprescindible. El infectólogo Daniel Stamboulian advirtió que este año todavía no apareció el virus gripal, pero sí infecciones respiratorias virales, “parientes” de esa enfermedad. El especialista recomendó la prevención con una consulta al médico, en especial, aquellos mayores de 60 años que tengan tos o fatiga, “la única manera de prevenirse de la gripe -señaló- es evitar los cambios bruscos de temperatura y el contacto con aquellos que la padezcan; lavarse las manos y aplicarse la vacuna, tal como lo hicieron hasta ahora 1.900.000 personas”. Si bien los niños y los ancianos están más expuestos a la gripe, los enfermos cardíacos, renales o diabéticos también son propensos a contraer esta enfermedad. Los síntomas son un resquebrajamiento general y la presencia de tos y fiebre, apuntó finalmente Stamboulian. 34- CIENCIA Jueves 9 de julio de 1998 - PERFIL SALUD La gripe entra ahora en su fase más algida, pero los expertos no recomiendan vacunarse Si todo el mundo anda engripado es por una razón muy simple: estamos entrando en el momento máximo de la epidemia de la gripe de este año. Los especialistas explican Los especialistas explican que estamos entrando al pico de la epidemia de gripe de este invierno y la sensación es de figurita repetida. ¿Qué se puede hacer? Poco. ¿Hay que tomar algún antibiótico? No, salvo complicaciones ¿Conviene vacunarse? No. A esta altura del invierno -y de la epidemia- ya es tarde para vacunas (ver recuadros). A todo esto, también salta otra curiosidad: ¿cómo es que padecemos la gripe todos los años cuando diferentes enfermedades han desaparecido? La viruela ha sido erradicada. Hay vacunas contra la poliomelitis y el sarampión. Entonces, ¿qué factor hace que la gripe sea tan difícil de vencer? que es una enfermedad que hay que vigilar -especialmente en casos de chicos y mayores de 65 años sanos- y también en pacientes con problemas cardíacos, de asma o dia- Llegó la gripe betes. Es una afección que puede afectar hasta a un 30 por ciento de la gente. Sin embargo es estrictamente estacional: en dos meses será un recuerdo. Estamos entrando en el pico de la epidemia de gripe de este año. El máximo se tocará dentro de dos semanas y en un par de meses prácticamente desaparecerá. ¿Qué es? Una infección viral que ataca las vías respiratorias. Síntomas usuales: Fiebre (entre 38º y 40º), escalofríos, transpiración, dolores musculares, dolor de cabeza, congestión nasal. (Duran entre 3 y 5 días) Síntomas menos usuales: Tos, cefaleas, dolor de garganta,sensibilidad a la luz. Vacunas antigripales: No se recomiendan a esta altura del año ya que la epidemia está entrando en su pico. Complicaciones: Pueden presentarse en: a) mayores de 65 años, b) chicos con problemas cardíacos, c) diabéticos, d) portadores de VIH, e) asmáticos En casos de complicaciones o pacientes de riesgo hay que consultar al médico para que recete algún medicamento antiviral específico. Tiempo de recuperación total: Entre una y dos semanas. Consejos de especialista “La gripe es una enfermedad autolimitada. Esto significa que generalmente se resuelve sola, después de unos días, sin tratamientos específicos” explica el doctor Roberto Debbag, infectólogo que trabaja en el Hospital Garrahan y es miembro del Centro de Estudios Infectológicos FUNCEI. Pero con algunas personas hay que estar muy atentos. Por ejemplo: *Chicos menores de 7 años, y mayores de 65 años. *Enfermos cardíacos. *Personas con diabetes y asma. *Portadores del virus del sida y otras enfermedades que afecten al sistema inmune. “En estos casos -dice Debbag-, es importante consultar al médico para que éste recete alguna sustancia antiviral.” Otro punto importante que destacan es que -salvo en casos muy puntuales- ya no es útil vacunarse. “Es que la vacuna tarda entre 15 y 30 días para comenzar a proteger efectivamente. Y para ese momento ya estaremos pasando el pico de la epidemia”. Si se vive en la ciudad no es mucho lo que se puede hacer para prevenir. Es que los lugares cerrados donde coincide mucha gente (como las oficinas y las escuelas) son los sitios claves para el contagio. Evitar en lo posible los hacinamientos es una buena prevención. Y lo mismo en cuanto a compartir bombillas, vasos y cubiertos. Una vieja discusión se da sobre la vitamina C. Para algunos expertos su ingesta protege y para otros es inocua. Lo que sí se sabe es que tomar una dosis diaria no tiene ningún efecto secundario. Diario Perfil. Extracto de la página 34 9 de julio de 1998. 79 Esta es la imagen del pequeño culpable de la epidemia de la gripe Cómo pelear la batalla Cuando hay un engripado en casa suele sufrir toda la familia. Como la causa de la gripe es viral, en general no hay mucho que hacer salvo esperar que el sistema inmune se encargue de conocer al virus y crear los anticuerpos necesarios para detenerlo. Algo que puede tomar unos cinco días, dependiendo de la gravedad de la infección y del estado del paciente. Sin embargo, durante esa semana en que uno se siente “de cama”, lo mejor sería que el paciente esté, literalmente, en la cama. O al menos en reposo. También hay que pensar que en invierno las casas calefaccionadas alcanzan un ambiente con muy baja humedad y poca renovación de aire. Eso ayuda a diseminar el virus y a que el afectado tienda a deshidratarse. Y esto se incrementa si la gripe provoca fiebre alta. Por todas estas razones conviene que el engripado tome mucho líquido en la forma de caldos, jugos cítricos y agua pura. Diario Perfil. Extracto de la página 34 9 de julio de 1998. (continuación) Por otra parte, si el cuerpo dispone de abundante líquido, las secreciones en las vías respiratorias (los mocos) se hacen más fluidas y eso resta lugares y ambientes aptos para la reproducción del virus. Bajar o no la fiebre con drogas antifebriles es una antigua discusión médica. Para algunos, la fiebre forma parte de la eacción inmunológica corporal. Por lo tanto, bajarla artificialmente sería ir en contra de la acción de las propias defensas. Claro que esta recomendación no corre si la temperatura es demasiado alta (más de 40 grados), ni para los chicos más chicos y los ancianos. En los casos en que la congestión nasal sea demasiado intensa se puede tomar algún descongestivo. Es que tener “limpios” los senos nasales puede prevenir una sinusitis y hasta una otitis. Los medicamentos antihistamínicos (generalmente se toman contra las alergias) suelen causar sequedad en las mucosas y por eso los especialistas no los recomiendan. b Vuelva a leer lo que más le interese de los apartados anteriores sobre la gripe. c Elabore un listado con seis ideas que le servirán de ayuda para explicar ante sus compañeros en forma oral qué es la gripe, cómo se contagia y cómo actúan las vacunas antigripales. 80 Actividad N…33 A modo de síntesis de lo estudiado hasta aquí le presentamos un cuadro con algunos de los momentos salientes en la historia de las Ciencias Naturales. Como podrá observar el cuadro está incompleto. a Complete por orden cronológico la columna correspondiente a Biología, incluyendo los siguientes eventos: - Robert Hooke inventa el término “célula”. - Aparece la teoría celular. - Teorías sobre el desarrollo embrionario: animalculismo y ovismo. - Robert Virchow: “toda célula proviene de otra célula”. - Antonie van Leewenhoek observa espermatozoides. Año Biología Química b En la columna correspondiente a Química incluya los siguientes eventos, también por orden cronológico. - Comienzo de la manufactura química: utilización de alcohol, fabricación de pólvora. - La alquimia se transforma en química - Paracelso. Iatroquímica. 81 - Van Helmont - Robert Boyle. Estudios sobre la combustión. - Flogisto. - Estudios sobre el dióxido de carbono y el oxígeno. - Lavoisier. Fundación de la química moderna - John Dalton. Teoría atómica. - Aparece la química inorgánica - Aparece la química orgánica. - Medeleiev. Tabla periódica de los elementos c Complete los años 1900, 1950 y la actualidad, tanto en química como en biología con algunos de los desarrollos más importantes producidos en esos campos de la investigación científica. Le sugerimos realizar una investigación bibliográfica en diversas fuentes (enciclopedias, textos de química y biología, entre otros). Le presentamos algunos acontecimientos que podrían incluírse: - Desarrollo de la celulosa y los plásticos. - Obtención de naftas a partir de la destilación del petróleo. -Fabricación de caucho artificial. - Utilización en medicina de átomos marcados radiactivamente. - Utilización del microscopio electrónico en biología. - Elaboración del modelo de ADN. - Se establecen los principios de la genética. - Obtención de diversas sustancias por biotecnología. - Clonación de mamíferos. - Ensayos con plásticos biodegradables. Año 1900 1950 Actualidad Biología Química Actividad N…34 Como cierre de lo trabajado en este módulo haga un informe breve sobre alguna enfermedad causada por algún organismo procariota o protista. Así podrá recuperar y relacionar algunos de los temas tratados. Sugerimos realizar un trabajo sobre uno de los siguientes temas a elección: Chagas - Tuberculosis - Difteria - Meningitis - Paludismo Algunos de estos temas ya fueron introducidos en el Módulo 6 de Ciencias y Tecnología. La información que usted necesita para hacer el informe puede rastrearse en centros de salud, en periódicos locales o nacionales (podrá conseguir números atrasados) y en bibliotecas. Entre las informaciones relevantes a desarrollar en el informe pueden figurar: • • • • las características de la enfermedad; los agentes de transmisión y su estructura; los modos de prevención y tratamiento; datos estadísticos locales, nacionales o internacionales. Su informe podrá tener las siguientes secciones Título Muestra, en forma resumida, el tema sobre el que se ha hecho el trabajo. Introducción Es la primera parte del trabajo. Se debe incluir aquí una descripción general del tema que trata el informe. Desarrollo Se debe mostrar en esta parte en forma secuenciada toda la información obtenida y los datos hallados. Se pueden presentar gráficos y cuadros como los que usted elaboró en este módulo. 83 Conclusión Debe cerrar el trabajo mostrando el estado del tema en la actualidad y algunas cuestiones que pueden quedar abiertas para la discusión. Referencias Finalmente en este apartado se incluyen todas las fuentes de información consultadas para la realización del informe. • Si se trata de libros, las citas deben indicar en primer lugar el nombre del autor, año de publicación, título del libro, ciudad donde se publicó y editorial. • Si se trata de revistas, primero se indica el nombre del autor, año de publicación, título del artículo, nombre de la revista, número de la revista y páginas en las que se encuentra el artículo. Si se trata de periódicos, autor (en caso de que aparezca), fecha, nombre del diario y país en el que se edita, páginas en las que se encuentra la nota. 84 Material de distribución gratuita 3 MODALIDAD SEMIPRESENCIAL Te rc e r C i c l o d e E d u c a c i ó n G e n e ra l B á s i c a p a ra Ad u l t o s Ciencias Naturales 3 Ciencias Naturales 3
© Copyright 2026