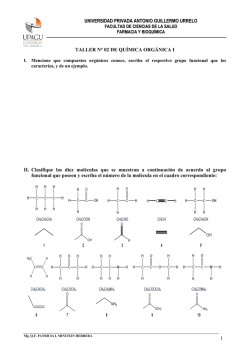
Hibridación sp3
UNIVERSIDAD PRIVADA ANTONIO GUILLERMO URRELO FACULTAD DE CIENCIAS DE LA SALUD FARMACIA Y BIOQUÍMICA HIBRIDACIÓN, ENLACES σ Y ENLACES π Mg. Q.F. PATRICIA I. MINCHÁN HERRERA ORBITALES ATÓMICOS RECORDANDO • Los electrones pueden existir en ciertos estados llamados orbitales. • Orbital atómico: Región tridimensional alrededor del núcleo atómico, donde existe mayor probabilidad de encontrar un electrón. QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA ORBITALES ATÓMICOS • El Carbono Su Número Atómico es 6 por tanto presenta 6 electrones: • 2 en su primer Nivel: 1s2 • 4 en su segunda Nivel: 2s2, 2p2 = electrones de valencia QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA HIBRIDACIÓN • La hibridación es una reorganización de los orbitales atómicos con diferentes energías para formar una nueva serie de orbitales equivalentes. • Resultan de la combinación de las propiedades de los orbitales s, p, d y f QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA HIBRIDACIÓN DEL CARBONO QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA HIBRIDACIÓN • La hibridación de los orbitales atómicos permite formar enlaces covalentes más resistentes llamados sigma. • Los orbitales híbridos se obtienen cuando dos o más orbitales no equivalentes (s y p) del mismo átomo se combinan preparándose para la formar un enlace covalente. QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA TIPOS DE HIBRIDACIÓN QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Hibridación sp3 • Un orbital s y tres orbitales p dan 4 orbitales sp3 • Geometría tetraédrica. • CH4, CCl4 QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Hibridación sp3 6C: 1s2, 2s2 2p2 I) Estado Basal II) Estado Excitado Cuando se aplica energía brinca un electrón apareado a un orbital solo. Obteniendo 4 orbitales desapareados 2s 2px 2py QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA 2pz Hibridación sp3 6C: 1s2, 2s2 2p2 II) Estado excitado III) Hibridación sp3: Se da cuando se reacomoda un orbital “s” con 3”p” Obteniendo 4 orbítales híbridos QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA CH4 QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Hibridación sp3 1 orbital s + 3 orbitales p 4 orbitales sp3 (distribución tetraédrica) Otras moléculas con hibridación sp3: AMONIACO Y AGUA QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA NH3 • ¿Ángulos de 109.5º? QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA EJEMPLOS DE C sp3: Diamante y Gas butano QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Observa los C sp3 del Gas butano (gas doméstico tiene solo enlaces sigma) H H H H I I I I H-C–C–C–C–H I I I I H H H H QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Hibridación sp2 • Un orbital s y dos orbitales p dan 3 orbitales sp2 • Geometría triangular (trigonal). 120º QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Hibridación sp2 6C: 1s2, 2s2 2p2 II) Estado excitado III) Hibridación sp2: Se da cuando se reacomoda un orbital “s” con 2”p” Obteniendo 3 orbítales híbridos y 1 puro QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA EJEMPLOS DE C sp2: Polietileno y Poliestireno QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Observa los C sp2 del Butileno QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Hibridación sp • Un orbital s y un orbital p dan 2 orbitales sp • Geometría lineal QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Hibridación sp1 6C: 1s2, 2s2 2p2 II) Estado excitado III) Hibridación sp1: Se da cuando se reacomoda un orbital “s” con un”p” Obteniendo 2 orbítales híbridos y 2 puros QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA EJEMPLO DE C sp1: Acetileno QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Observa los C sp1 del Butino QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Características de los Orbitales Híbridos Tetraédrica Triangular Lineal QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA ¿Y si hay orbitales d? Las más comunes QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA sp3d2 3 sp d • Bipirámide triangular • Octaédrica QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Resumen Hibridación Geometría sp Lineal sp2 Triangular sp3 Tetraédrica sp3d Bipiramidal triangular sp3d2 Octaédrica QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Dibujo ENLACES y QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA ENLACES y • Los enlaces químicos en las moléculas se deben a la superposición de orbitales atómicos. • Debido a la superposición, aumenta la probabilidad de que los electrones se encuentren en la región del enlace. QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA ENLACES y • La superposición puede ser de 2 tipos: Enlaces sigma (σ): Enlaces pi (π): QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA ENLACES y Enlaces sigma (σ): Se forman por la unión de dos orbitales “híbridos” (sp1, sp2 o sp3). Enlaces pi (π): se forman por la unión de los orbitales “puros” (2p). QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA ENLACES y • Se dan dos tipos de enlaces covalentes: – Enlaces sigma (σ): formados por la unión de dos orbitales “híbridos” de los átomos enlazados. – Enlaces pi (π): formados por la unión lateral de los orbitales puros concentrados arriba y abajo del plano que forman los núcleos de los átomos enlazados. Enlace Enlace QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Etileno Etano Enlace C-C QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Moléculas con enlace doble (ETENO): Orbitales puros forman enlaces pi Observa la figura trigonal de cada carbono y doble enlace con un ángulo de 120°: QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Moléculas con enlace triple (ETINO): Orbitales puros forman 2 enlaces pi: Observa la figura lineal de cada carbono y triple enlace: QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Acetileno QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA CARACTERÍSTICAS DE LOS ENLACES y • Los enlaces son más débiles que los : C2H4 + Cl2 C2H4Cl2 • Reacción de adición, se rompe el enlace . • Si lo hiciéramos con etano: C2H6 + Cl2 C2H4Cl2 + H2 • Reacción de substitución. • El enlace C-C no se rompe. QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA ROTACIÓN DE LOS ENLACES H H H H C H C H Forma Elipsada H H H Forma Alternada QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA ROTACIÓN DE LOS ENLACES • Si hay un solo enlace, hay rotación de la molécula. • Si hay doble o triple es muy difícil que rote o de plano no rota. • Facilidad de rotación: Sencillo Doble Triple QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA 1 H2N 2 3 4 C C O 5 C O 11 6 CH2 7 C HN 12 8 CH HC 9 CH3 10 Ejercicio: 1. Indique la hibridación que presentan cada uno de los siguientes átomos N1; C2; O4; C5; C7; C9; C10; O11 y N12 2. Indique que valor de ángulo de enlace y distribución geométrica, presentan los siguientes átomos: N1; C3; O4; C6; C8; C10 y N12 3. Determine el numero total de orbitales moleculares están presente en esta estructura química. 4. Indique cuantos enlaces del tipo sp3-s, sp2-sp3 y sp-sp3 existen en la molécula en estudio QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA Dejamos de temer aquello que se ha aprendido a entender Marie Curie QUÍMICA ORGÁNICA I Q.F/OBST. PATRICIA MINCHÁN HERRERA
© Copyright 2026