cuantificacion de amiodarona en suero mediante precipitacion de
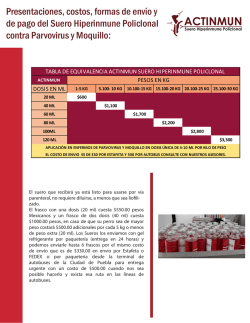
NOTA (Farmacología) Acta Científica Venezolana, 51: 53–60, 2000 CUANTIFICACION DE AMIODARONA EN SUERO MEDIANTE PRECIPITACION DE PROTEINAS SEGUIDA DE CROMATOGRAFIA LIQUIDA DE ALTA RESOLUCION CON DETECCION ULTRAVIOLETA Marcela Valencia 1, Varlin Zapata 1, Adela Bider 1 , Margarita Pérez-González 2 y Vito Lamanna 3 1. Unidad de Detección de Medicamentos y Química Clínica, Instituto de Medicina Experimental, Apartado Postal 50587, Caracas 1050, Venezuela. 2. Cátedra de Patología General y Fisiopatología, Escuela de Medicina "Luis Razetti", Apartado Postal 50587, Caracas 1050, Venezuela. 3. Cátedra de Farmacología, Escuela de Medicina "Luis Razetti", Apartado Postal 50587, Caracas 1050, Venezuela. Recibido: 15/09/98 ; Revisado: 25/03/99 ; Aceptado: 19/10/99 RESUMEN: Nos propusimos desarrollar un método para la medición de amiodarona en suero mediante cromatografia líquida de alta resolución con detección ultravioleta, optimizando las condiciones analíticas descritas en la literatura y determinar las condiciones óptimas de almacenamiento de la muestra, para la instalación de un servicio nacional de referencia. La preparación de la muestra consistió en la adición de 2 partes de acetonitrilo a 1 parte de suero, agitación por 45 s, incubación a 24Æ C por 5 min, centrifugación a 6000 g durante 2 min e inyección de 20 L del sobrenadante al cromatógrafo. Utilizando una columna Bondapak CN RP (3,9 150 mm) a 45Æ C, con una fase móvil compuesta por KH2 PO4 10 mM / metanol / acetonitrilo (40:37:23 v/v/v) a pH 3,5, bombeada a 0,6 mL/min, obtuvimos un tiempo de retención de 4,9 min. La detección se realizó a 242 nm, y la cuantificación mediante comparación con estándares externos; el límite de detección fue de 0,11 g/mL. La relación masa/respuesta fue lineal (r2 > 0,99) para inyecciones con masa nominal de 2,96 a 18930 ng, lo cual excede lo requerido para el monitoreo de amiodarona sérica (0,3 a 6,0 g/ml). La recuperación fue de 99,26% 2,84%. El almacenamiento a -16Æ C de muestras precipitadas evita la degradación de la droga. Este método resultó más eficiente, sencillo y económico que otros ya descritos, manteniendo la sensibilidad, especificidad y linealidad requeridas para ser considerado un método óptimo para la cuantificación de amiodarona en suero. Palabras clave: HPLC, amiodarona, antiarrítmicos, cuantificación, suero. MEASUREMENT OF SERUM AMIODARONE BY PROTEIN PRECIPITATION FOLLOWED BY HIGH PERFORMANCE LIQUID CHROMATOGRAPHY WITH ULTRAVIOLET DETECTION ABSTRACT: Our aim was to develop a quantitative method for serum amiodarone measurement using high performance liquid chromatography with ultraviolet photometric detection. We studied previous reports in the literature in order to obtain a simpler method to be used routinely in our TDM unit. Sample preparation was based on protein precipitation adding 2 parts of acetonitrile to 1 part of serum, followed by vortex-agitation for 45 s, incubation at 24Æ C for 5 min, and centrifugation at 6000 g for 2 min. Twenty microliters of the supernatant was directly inyected into the chromatographic system. A Bondapak CN RP column (3.9 150 mm) at 45Æ C, with a mobile phase consisting of KH2 P04 10 mM / methanol / acetonitrile (40:37:23 v/v/v), pH 3.5, were used. Eluting with a flow rate of 0.6 mL/mm the retention time of amiodarone was approximately 4.9 min. Detection was performed at 242 nm and the quantification was made by peak heigth comparison with external standards. The mass/response ratio is linear (r2 > 0.99) within a mass range of 2.96 to 18,930 ng of injected amiodarone, which exceeds the requirements for the monitoring of serum levels (0.3 to 6.0 g/mL). Sample storage should be done with acetonitrile-extracted sera at -16Æ C to avoid degradation. The method is very efficient, linear, sensitive and specific but it also simpler and cheaper than others reported in the literature. Key Words: HPLC, amiodarone assay, antiarrythmic, drugs, serum. INTRODUCCION La amiodarona es un antiarrítmico excepcional, con diversas acciones farmacológicas, efectivo en el tratamiento de un amplio espectro de alteraciones del ritmo cardíaco, siendo ampliamente utilizado para el tratamiento de las taquiarritmias supraventriculares y ventriculares2;3;15 . Es un compuesto muy hidrofóbico, base débil con pK de 6,6. Su absorción gastrointestinal es lenta e incompleta y su biodisponibilidad es de sólo 30 a 65% debido a una absorción incompleta y a un metabolismo de primer paso. La amiodarona se une ampliamente a proteínas y a los lípidos tisulares, distribuyéndose extensamente en el tejido adiposo8;13;18 . Como resultado de esto, el volumen de distribución aparente de la droga es de 50-60 L/Kg, lo cual hace que se requiera un largo período de carga antes de que se evidencie su actividad antiarrítmica. La principal vía de eliminación es el metabolismo hepático, lo cual da origen a un metabolito activo, la desetilamiodarona, con actividad equivalente a la droga madre5;6 . Su excreción renal no es importante y no es necesario un ajuste de dosis en pacientes con alteraciones en la función renal17 . La vida media de la amiodarona es variable y larga, con un rango de 16 a 180 días8;13;18 . La utilidad de hacer determinaciones de concentraciones plasmáticas de amiodarona es un tema controversial. Existen autores que afirman que no son necesarias, ya que existe una amplia variación interindividual en la relación dosis/concentración plasmática alcanzada y entre esta última y los efectos terapéuticos y tóxicos3;13 . Otros 54 Valencia, Zapata, Bider, Pérez-González y Lamanna Tabla 1. Comportamiento del pico de amiodarona en función del flujo de fase móvil. Flujo (mL/min) Respuesta (AU) Retención (min) Separación 0,4 0,5 0,6 0,7 0,8 50938 49888 49970 49753 49811 7,29 5,84 4,89 4,20 3,68 Adecuada Adecuada Adecuada Inadecuada Inadecuada autores señalan que lo anteriormente descrito, unido al hecho de que la amiodarona presenta una biodisponibilidad variable y a que es potencialmente tóxica cuando se utiliza en terapia crónica, son razones suficientes para justificar la realización de las determinaciones de las mismas3;13;20 . Los escasos datos disponibles en la literatura indican una concentración plasmática efectiva mínima de amiodarona entre 1 y 2 g/mL y que la frecuencia de efectos tóxicos aumenta con concentraciones plasmáticas superiores a 2,5 g/mL6;7 . El 80% de los pacientes que reciben amiodarona presentan efectos secundarios, pero sólo 10-15% los presentan de tal gravedad que se justifica la suspensión de la terapia. Algunos de los efectos secundarios parecen estar relacionados con la dosis total del medicamento administrada a lo largo del tiempo, es decir, con la cantidad de medicamento acumulado5 . Sin embargo, no siempre puede establecerse una correlación entre la dosis y el efecto secundario observado3 . Existen numerosos métodos descritos en la literatura para la detección de amiodarona en líquidos biológicos1;4;7;9;10;12;14;16;19;20 . La mayoría de ellos están basados en la cromatografia líquida de alta resolución (HPLC); sin embargo, estos métodos resultan complicados y costosos por la forma de extracción y porque la mayoría utiliza estándares internos para la cuantificación, los cuales no siempre están disponibles comercialmente14 . Esto ha ocasionado que, pese a la necesidad de definir si existe una relación clara entre la dosis de amiodarona administrada, el tiempo de administración y la aparición de efectos tóxicos, los estudios farmacocinéticos son escasos si se comparan con la información existente en la literatura para otros medicamentos cardiovasculares. Es por ello que decidimos realizar un estudio profundo de las metodologías de detección de amiodarona ya publicadas y tratar de establecer una nueva que fuese lo más eficiente, simple y económica posible. MATERIALES Y METODOS Reactivos El clorhidrato de amiodarona, utilizado para la preparación de estándares y sueros con amiodarona añadida, el EDTA, el metabisulfito de sodio y el fosfato dihidrógeno de po- Figura 1. A) Espectro obtenido a 4,89 min. La máxima absorbancia relativa fue aproximadamente a 241,5 nm. B) Cromatograma de un estándar de amiodarona (inyección de 47,325 ng); detección a 242 nm. tasio (KH2 PO4 ) fueron adquiridos a Sigma Chemical Co., EUA. El acetonitrilo, metanol, ácido fosfórico y ácido perclórico, grado HPLC, fueron adquiridos a Fisher Scientific Co., EUA. Obtención de suero humano Muestras de sangre humana de voluntarios sanos, obtenidas mediante punción venosa antecubital, fueron recogidas en tubos Vacutainer de 6 mL sin anticoagulante, dejadas en reposo a temperatura ambiente durante 15 min y centrifugadas a 1500 g durante 10 min a 4Æ C. Los sueros obtenidos fueron mezclados, colocados en tubos de polipropileno sellados con Parafilm y utilizados frescos o almacenados a -16 Æ C hasta el momento de su uso. * Marca registrada 55 Cuantificación de amiodarona mediante HPLC Figura 2. Curva de calibración de amiodarona basada en la inyección de estándares de acetonitrilo. Figura 3. Cromatogramas típicos del extracto en acetonitrilo de un suero con amiodarona (1) y un suero blanco (2). Sistema cromatográfico Preparación de soluciones estándar Se utilizó un equipo formado por una bomba Waters 600, un inyector automático Waters 714 Plus y un detector de arreglo de fotodiodo Waters 996, acoplados a un sistema de adquisición y procesamiento de datos Millenium , adquiridos a Waters Associates, Millford, MA, EUA. Las condiciones cromatográficas usadas fueron una modificación del método descrito por Pollak14 . Usamos una columna Bondapak CN RP de 3,9 mm 150 mm (Waters Associates), mantenida a 45Æ C. La separación de la amiodarona se logró en condiciones isocráticas, con una fase móvil compuesta por KH2 PO4 10 mM / metanol / acetonitrilo (40:37:23), ajustada con ácido fosfórico a un pH final de 3,5, filtrada a través de membranas de nylon con poros de 0,45 m y desgaseada mediante sonicación bajo vacío (Waters solvent clarification kit). La detección se realizó mediante barrido de 220 nm a 400 nm de longitud de onda y la identidad del compuesto se confirmó mediante comparación espectral multidimensional. La cuantificación se realizó a 242 nm – longitud de onda correspondiente a la máxima absorbancia de la amiodarona – comparando la densidad óptica de la muestra con la de estándares externos. A partir de una solución madre de clorhidrato de amiodarona, 1 mg/mL en acetonitrilo, con una concentración de amiodarona base de 946,5 g/mL, se preparó una solución de trabajo 1/100 que aporta 189,3 ng de la droga en un volumen de inyección de 20 L. A partir de la solución de trabajo, mediante diluciones seriadas 1:1 en acetonitrilo, se obtuvieron estándares con rango de concentraciones de 0,148 g/mL a 4,733 g/mL, equivalentes a la inyección en columna de 2,958 a 94,650 ng en 20 L, con los cuales se construyeron curvas de calibración de seis niveles para la cuantificación. Determinación del flujo óptimo Se hicieron inyecciones de 189,3 ng de amiodarona en 20 L de acetonitrilo para obtener una curva de altura del pico de amiodarona en función del flujo de fase móvil. Partiendo de 0,4 mL/min, flujo asociado a una buena separación entre el pico de amiodarona y el frente, se repitió la corrida incrementando éste en intervalos de 0,1 mL/min hasta un máximo de 0,8 mL/min. Estabilidad de las soluciones estándar Extracción de las muestras La preparación de las muestras consistió en precipitación de proteínas mediante la adición de dos partes de acetonitrilo a una parte de suero, agitación en vórtex por 45 s, incubación a 24Æ C durante 5 min, y centrifugación a 6000 g durante 2 min a 4Æ C. Para el análisis se inyectaron 20 L del sobrenadante en el sistema cromatográfico. * Marca registrada Para evaluar la posibilidad de reducir el uso de solventes orgánicos en algunos de los pasos del método, se comparó la estabilidad de soluciones de amiodarona en acetonitrilo, solvente orgánico apropiado para la preparación de soluciones de trabajo para la adición de estándar interno12 , con una solución acuosa (PCA) compuesta por EDTA 0,1 mM, metabisulfito de sodio 0,2 mM y ácido perclórico 0,67% v/v, la cual, además de ser una potente mezcla antioxidante, permitió la disolución de la droga, la cual es pobremente soluble en agua. A partir de la solución madre previamente descrita, se prepararon mezclas 56 Valencia, Zapata, Bider, Pérez-González y Lamanna patrones con amiodarona en nueve concentraciones entre 2,958 ng y 18930 ng. Se evaluó la linealidad de la curva de calibración mediante el coeficiente de correlación lineal r de Pearson. Estabilidad de la droga en sueros y extractos Figura 4. A) Recuperación de la droga en sueros con amiodarona añadida, inyectados inmediatamente después de la precipitación de proteínas (Control) y en sueros almacenados por cinco días a diferentes temperaturas. * Diferencia significativa con respecto al grupo control; P < 0,05. B) Recuperación de la droga en extractos conservados a -16 Æ C por 1, 3 ó 4 días. * Diferencia significativa con respecto al día 0; P < 0,05. Los resultados fueron expresados como porcentaje con respecto a la masa nominal inyectada. 1/10 (1893 ng/20 L) en acetonitrilo o PCA y se almacenaron a 4Æ C durante 96 h. Se comparó la altura del pico de amiodarona en inyecciones de 20 L de cada solución realizadas inmediatamente después de su preparación y repetidas al final del período de almacenamiento. Linealidad de la relación masa/respuesta Se construyó una curva, representando la altura del pico de amiodarona, expresada en unidades de absorbancia (AU), en función de la masa inyectada en 20 L. Se utilizaron como estándares acetonitrilo sin amiodarona y La recuperación de la droga a partir de sueros con amiodarona añadida luego de la desproteinización fue estudiada mediante comparación con estándares externos. Se prepararon 35 muestras de suero humano fresco con una concentración de amiodarona de 3,786 g/mL que, después de la extracción descrita, equivale a la inyección en columna de 25,24 ng de amiodarona y se cuantificó la masa recuperada. Cinco muestras fueron sometidas al proceso de extracción e inmediatamente inyectadas en el cromatógrafo; tres grupos de diez muestras cada uno fueron almacenados durante cinco días a -16Æ C, 4Æ C ó 24Æ C, y luego sometidos al proceso de extracción y cuantificación de amiodarona. Las muestras que fueron extraídas y procesadas de inmediato, además de representar el grupo control en los experimento de degradación, permitieron calcular la eficiencia del proceso de extracción, es decir, la recuperación de la droga luego de la precipitación de proteínas. Para estudiar la estabilidad de la droga en los extractos, se realizó la precipitación con acetonitrilo de 20 muestras de suero humano con amiodarona añadida, similares a las descritas anteriormente. Los extractos fueron inyectados inmediatamente y 15 de ellos fueron separados en tres grupos de cinco muestras y conservados durante 1, 3 ó 4 días a -16Æ C. El día correspondiente a cada grupo, las muestras eran retiradas del congelador, agitadas brevemente en vórtex e inyectadas nuevamente en el cromatógrafo. La cuantificación de amiodarona en los extractos conservados se expresó como porcentaje con respecto a la masa nominal inyectada. En ambos experimentos las diferencias entre los grupos fueron evaluadas mediante análisis de varianza de una vía (ANOVA) seguida de la prueba de Bonferroni cuando el ANOVA indicaba diferencias significativas. El criterio de significancia estadística fue una P < 0,05. Sensibilidad y especificidad analíticas El límite de detección de este método, fue evaluado mediante la inyección de estándares con concentraciones decrecientes, mediante diluciones seriadas 1:1 en acetonitrilo a partir de una solución con 2,958 g de amiodarona en 20L, y comparando la altura del pico de amiodarona con las oscilaciones de la línea de base (ruido). Para evaluar la interferencia potencial de otros medicamentos en la cuantificación de la amiodarona se procesó un patrón comercial para monitoreo de drogas terapéuticas (suero control Dade nivel 3), reconstituido a partir del liofilizado según las instrucciones del fabricante, el cual contiene concentraciones elevadas (tóxicas) de 19 fármacos diferentes comúnmente utilizados en la práctica clínica, pero no contiene amiodarona. Cuantificación de amiodarona mediante HPLC 57 Figura 6. Concentraciones séricas de amiodarona en un voluntario sano tras la administración oral de una dosis de 800 mg. Figura 5. Cromatogramas de un patrón en acetonitrilo (1) y un suero con amiodarona añadida (2). B) Suero control Dade nivel 3. Uso potencial en experimentos farmacocinéticos Se estudió la concentración sérica de amiodarona luego de una dosis oral única de 800 mg en un voluntario sano, con la finalidad de comprobar la aplicabilidad del método a estudios farmacocinéticos. Se obtuvieron muestras de sangre inmediatamente antes de la administración de la droga, y 30 min, 1 h , 2 h, 4 h, 8 h, 12 h y 24 h después. Cada muestra fue extraída inmediatamente después de separar el suero, almacenada a -16Æ C, y fueron inyectadas, previa calibración del equipo, al finalizar extracción de la última muestra. RESULTADOS Determinación del flujo óptimo En el método descrito por Pollak14 se utilizó una columna Bondapak CN RP de 250 mm de longitud, obteniéndose una retención cercana a 8 min con un flujo de fase móvil de 0,8 mL/min. Tomando esto como base, se predijo una una retención cercana a 4,8 1 min para un flujo de 0,8 mL/min al usar una columna de 150 mm. Sin embargo, en los cromatogramas iniciales, este flujo produjo una elución temprana de la amiodarona (3,68 min), cuyo pico, identificado mediante comparación con un espectro patrón, no se separó adecuadamente del frente. Se obtuvo una curva de respuesta en función del flujo (Tabla 1). Partimos de un flujo relativamente bajo (0,4 mL/min), con el cual obtuvimos una buena resolución del pico de interés pero un mayor tiempo de elución. Para obtener el mínimo tiempo de elución que no comprometiese la resolución, incrementamos el flujo a razón de 0,1 mL/min. La respuesta teórica esperada es una disminución del tiempo de retención y un estrechamiento absoluto de la banda cromatográfica, lo que condiciona un aumento de la altura del pico con relativa invariabilidad de su área. En nuestro caso observamos una disminución progresiva del tiempo de retención sin elevación de la respuesta fotométrica, lo que sugiere que el estrechamiento esperado de la banda fue contrarrestado por un efecto de difusión a lo largo de la columna. Este efecto de difusión en algunos casos, puede ser tan importante como para producir, paradójicamente, ensanchamiento relativo de la banda y disminución de la altura del pico. A temperatura ambiente y en sistemas similares, esto es notable sólo a flujos mayores de 1,5 mL/min, pero probablemente la corrida a 45Æ C permitió evidenciarlo a flujos menores. Seleccionamos como flujo óptimo a utilizar 0,6 mL/min ya que nos ofrece el menor tiempo de retención con adecuada resolución y no condicionó una disminución importante de la altura absoluta del pico de amiodarona. En la Figura 1 se muestra un cromatograma típico, con detección a 242 nm, el cual muestra un pico aislado con retención de 4,89 min cuyo barrido espectral de 225 nm a 400 nm concordó con el espectro patrón de la literatura consultada11 . 58 Estabilidad de las soluciones estándar Se comparó la estabilidad de soluciones de amiodarona en acetonitrilo y PCA. La amiodarona fue estable en acetonitrilo, con una pérdida del 0,22% de la masa inicial en 96 horas, mientras que en PCA, la pérdida fue de 93,51%. Linealidad de la relación masa/respuesta Se construyó una curva, representando la altura del pico de amiodarona, expresada en unidades de absorbancia (AU), en función de la masa inyectada. La Figura 2 muestra los datos obtenidos en seis puntos entre 2,958 ng y 94,65 ng de masa inyectada, quedando excluídos, debido a la escala utilizada, tres puntos adicionales correspondientes a 198,3 ng, 1893 ng y 18930 ng. La ecuación de la regresión obtenida con los nueve datos fue y = 261,769x + 24,965, con un coeficiente de correlación r2 > 0,999. Para los análisis posteriores se prepararon e inyectaron los estándares correspondientes a una curva de calibración con los seis primeros puntos, equivalentes en suero a un rango de concentraciones de 0,148 a 4,733 g/mL. La curva de calibración así obtenida abarca el rango en el que se espera se encuentran los niveles de amiodarona en las muestras provenientes de los pacientes bajo tratamiento. Características cromatográficas del extracto Aunque la precipitación de proteínas con acetonitrilo no es un método específico de extracción, la amiodarona, por su carácter hidrofóbico, tiene un alto índice de retención en columnas de fase reversa y elución tardía con respecto a la mayoría de los compuestos presentes en un suero desproteinizado, lo que le proporciona selectividad a la separación cromatográfica. A pH 3,5, muy inferior al pK de la amiodarona, el compuesto se encuentra ionizado en cerca del 99,9%, lo que contribuye a una adecuada resolución. En la Figura 3 se muestran cromatogramas superpuestos correspondientes a un extracto de suero con amiodarona añadida y suero blanco. Se observó la presencia del pico de amiodarona en el primero de éstos y una línea de base limpia en el segundo, en el tiempo de elución correspondiente. Estabilidad de la droga en sueros y extractos La recuperación de la droga en muestras de suero con amiodarona añadida, inyectados inmediatamente después de la precipitación de proteínas fue de 25,053 ng 0,717 ng (promedio DE), lo que representa el 99,26 2,84% de la masa nominal contenida en las muestras (Figura 4A). Se observó una degradación espontánea del medicamento en los sueros almacenados por cinco días a 24Æ C, en los cuales la recuperación aparente fue de 69,07 2,01%. También se observó degradación espontánea en sueros conservados en frío a 4Æ C (72,15 3,72%) y a Valencia, Zapata, Bider, Pérez-González y Lamanna (71,88 1,71%). El ANOVA indicó diferencia significativa entre los grupos (F(3;31) = 163,19; P < 0,001), y la prueba de Bonferroni indicó degradación a todas las temperaturas con respecto al control (P < 0,05). La Figura 4B muestra los resultados de la cuantificación de amiodarona en extractos de suero con patrón añadido almacenados a -16Æ C durante 1, 3 ó 4 días, comparados con extractos inyectados inmediatamente después de la precipitación de proteínas. Se observa mayor estabilidad de la droga en los extractos de acetonitrilo, ya que no hubo pérdidas de magnitud comparable a la de los sueros conservados a cualquier temperatura. La presencia de extractos con una masa aparente notablemente superior al 100% de su cuantificación inicial sugiere la evaporación del acetonitrilo como factor potencial de inexactitud. En las muestras correspondientes al día 4 (recuperación de 112,5 0,8%) ocurrió exposición no intencional de las muestras durante 2 h (los viales usandos en el inyector automático tienen una abertura en su parte superior para la entrada de la aguja). El ANOVA indicó diferencia significativa entre los grupos (F(3;19) = 28,46; P < 0,001), y la prueba de Bonferroni indicó mayor concentración de las muestras conservadas por 4 días (P < 0,05). -16Æ C Sensibilidad y especificidad del método El límite de detección de este método, expresado como la mínima cantidad de amiodarona que produce una relación señal / ruido de 5:1, fue de 0,74 ng, cantidad equivalente a la inyección de 20 L de un extracto de suero con una concentración de 0,11 g/mL. La Figura 5 nos muestra los resultados de la comparación de los cromatogramas de un patrón en acetonitrilo (23,663 ng, equivalente a una concentración en suero de 3,549 g/mL), un suero con amiodarona añadida (0,574 g/mL) y el suero control Dade nivel 3. El sitio correspondiente al tiempo de retención de amiodarona está limpio en el cromatograma de suero comercial. Aplicaciones del método Se estudió la concentración sérica de amiodarona luego de una dosis oral única de 800 mg v.o. en un voluntario sano con la finalidad de comprobar la aplicabilidad del método a estudios farmacocinéticos. La Figura 6 muestra los resultados obtenidos. El gráfico corresponde a lo esperado para las condiciones del experimento, alcanzándose el pico de concentraciones plasmáticas a las 4 h de la administración10 . DISCUSION Hemos tratado de desarrollar un método de detección de amiodarona por HPLC con detección ultravioleta que, sin perder sus necesarias características de sensibilidad, especificidad y linealidad, sea lo suficientemente simple, eficiente y relativamente económico como para ser usado en el estudio rutinario de grandes grupos de pacientes. Esto, Cuantificación de amiodarona mediante HPLC desde el punto de vista farmacológico, permitirá valorar la utilidad real de los niveles séricos como predictores de los efectos terapéuticos y tóxicos de este antiarrítmico. La mayoría de los métodos de determinación de amiodarona por HPLC y electroforesis capilar que se encuentran en la literatura requieren de una laboriosa extracción en fase sólida7;14 , de una compleja extracción líquidolíquido1;10;20 , o de sistemas cromatográficos complejos. Estos métodos de extracción hacen necesario el uso de un estándar interno lo cual encarece, complica y agrega fuentes de error en la preparación y cuantificación de las muestras. El análogo bromurado de la amiodarona (L8040) utilizado como estándar interno en la mayoría de los métodos, no está disponible comercialmente, y ninguna de las sustancias alternativas propuestas satisface los requerimientos de un estándar interno ideal14 . Todo esto ha traído como consecuencia que la determinación de amiodarona no pueda ser un análisis de rutina en las diferentes unidades de detección de medicamentos del mundo, a pesar de ser altamente necesaria y requerida por los especialistas de la cardiología. La precipitación de proteínas con acetonitrilo e inyección directa del sobrenadante produjo una recuperación elevada y reproducible, cercana al 100%. Esto coincide con lo descrito en la literatura acerca de las propiedades de la desproteinización con solventes orgánicos9;11 . Este es un método más sencillo y reproducible que la extracción en fase sólida y la partición líquido-líquido y, puesto que el proceso no involucra pasos con pérdida parcial del analito, evaporación o transferencia incompleta de volúmenes, no es necesario el uso de estándar interno para estimar la recuperación y corregir pérdidas. La precipitación de proteínas con acetonitrilo / suero 1:1 es incompleta, a menos que se agreguen otros agentes precipitantes, como sulfato de zinc a una concentración final de 0,05%9 . Plomp y col.12 utilizaron una solución de estándar interno en acetonitrilo para la precipitación de muestras de plasma, (mezcla 2:1), logrando una recuperación de amiodarona y de L8040 cercanas a 100%. Las características de este método hacían innecesario el uso de estándar interno, y de otros agentes precipitantes. En la práctica, comprobamos que la mezcla acetonitrilo / suero 1:1 produjo un sobrenadante turbio después de la centrifugación, mientras que la mezcla 2:1 produjo un sobrenadante cristalino, indicativo de precipitación completa de coloides. Aunque la precipitación de proteínas no es un método específico de extracción, el carácter hidrofóbico de la amiodarona le confiere una elevada retención en columnas de fase reversa con respecto a la mayoría de los compuestos presentes en un suero desproteinizado, lo que le proporciona selectividad a la separación cromatográfica. Además, para muestras de origen humano se prefiere el uso de columnas de fase reversa, debido a la posibilidad de usar fases móviles acuosas y a una mayor facilidad de equilibración y diversidad de aplicaciones4 . Con la finalidad de hacer el método lo más económico posible, escogimos la utilización de una fase móvil con un alto contenido de agua, evitando así el uso de fases mó- 59 viles con más de un 80% de solventes orgánicos, que son comunes en la literatura1;7;9;10;12;16 , y cuyo uso rutinario implica costos, riesgos laborales y daños ecológicos potenciales mucho mayores. La sustitución de una columna de 250 mm de longitud por una más corta (150 mm) también redujo directamente el costo de la fase estacionaria y el volumen de solventes requeridos para la elución. El tipo de detección utilizado (barrido espectrofotométrico y comparación espectral multidimensional) asegura la identificación específica de la amiodarona. Debido a que en los sueros de los pacientes es posible encontrar contaminantes que no estén completamente resueltos del pico de la amiodarona, preferimos cuantificar por altura y no por área bajo el pico; aunque es posible que los contaminantes afecten el area bajo el pico, es menos probable que alteren su altura máxima. La amiodarona fue estable en los extractos, pero no en los sueros sin extraer conservados a temperatura ambiente o en frío. Nuestros resultados coinciden con lo reportado por Vuagnat y col.19 quienes encontraron que el nivel sérico disminuye contínuamente a partir del primer día, independientemente de la temperatura de almacenamiento, con pérdida del 23% en una semana. Para garantizar la estabilidad y correcta cuantificación de las muestras de suero de pacientes referidos a un laboratorio externo es preferible la precipitación de la muestra con acetonitrilo y su conservación en tubos herméticos, en lugar de la simple congelación del suero, antes de su envío al mismo. Hay autores que asumen la estabilidad de la amiodarona en suero1 , lo cual contradice los hallazgos descritos. Estos resultados podrían deberse a la comparación de muestras de suero congeladas por cinco meses con otras congeladas por un tiempo menor no especificado, sin estudios de degradación a corto plazo usando sueros frescos como control. Hasta el presente no se habían hecho recomendaciones con respecto a la conservación de este tipo de muestras para su análisis cromatográfico posterior; dada la inestabilidad de la droga en suero, esta es una contribución importante del presente estudio. El método fue lineal para inyecciones comprendidas entre 2,958 ng y 18930 ng de amiodarona, con un coeficiente de correlación r2 > 0,999. La calibración desde 0 ng hasta 95,65 ng abarca el rango en el que se espera se encuentran los niveles de amiodarona en las muestras provenientes de los pacientes bajo tratamiento. El límite de detección de este método, expresado como la mínima cantidad de amiodarona que produce una relación señal / ruido de 5:1, fue de 0,74 ng, cantidad equivalente a la inyección de 20 L de un extracto de suero con una concentración de 0,11 g/mL, inferior a la concentración terapéutica mínima de la droga. El análisis de un suero comercial con concentraciones tóxicas de 19 fármacos, entre los que se encuentran algunos de uso frecuente en cardiología (digoxina, lidocaína, n-acetil-procainamida, procainamida, fenitoína, quinidina) no mostró picos con posibilidad de interferencia en la cuantificación de amiodarona, particularmente si ésta se hace por altura y no por área del pico. La capacidad 60 Valencia, Zapata, Bider, Pérez-González y Lamanna de detectar el leve ascenso en la concentración plasmática de amiodarona 30 min después de una dosis única vía oral, y de discriminar el perfil farmacocinético hasta las 24 h, sugiere que la sensibilidad del método es suficiente para su aplicación en estudios farmacocinéticos y de monitoreo terapéutico. Lesko y col.10 hacen la misma afirmación sobre su método, utilizando dos perfiles, uno de los cuales es muy similar al obtenido por nosotros. Durante el año de experiencia de detección de niveles séricos de amiodarona en nuestra Unidad, con pacientes de diferentes centros cardiológicos de la ciudad de Caracas, utilizando el método descrito, hemos realizado 73 determinaciones, encontrando un valor promedio 1,08 0,707 g/mL con un rango de valores que van desde 0,37 - 3,07 g/mL. La elución en un tiempo menor de 5 min permite, en la práctica, el análisis de hasta 60 muestras en 8 horas con dos calibraciones diarias, lo que le confiere un adecuado rendimiento para su uso en el laboratorio clínico. La posibilidad de usar cantidades muy pequeñas de muestra, hasta un mínimo de 20 L de suero, le da gran flexibilidad al proceso de recolección de la muestra. El método desarrollado, con una relación óptima entre costos y rendimiento, satisface las exigencias de sensibilidad, especificidad y precisión requeridas para el su uso rutinario en el laboratorio clínico. AGRADECIMIENTOS Este estudio fue realizado gracias a la ayuda de Fundadiagnóstica. REFERENCIAS 1. Bliss, M., Mayersohn, M., and Nolan, P. High performance liquid chromatographic analysis of amiodarone and desethylamiodarone in serum. J. Chromatogr. Biomed. Appl. 381: 179-184, 1986. 2. Ezri, M. D., Shima, M. A., and Denes, P. Amiodarone: a review of its clinical and electrophysiological effects. Clin. Prog. Pacing Electrophysiol. 1: 20-29, 1983. 3. Falik R., Flores, B., Shaw, L., Gibson, G., Josephson, M. E. and Marchlinski, F. E. Relationship of steady state serum concentration of amiodarone and desethylamiodarone to therapeutic efficacy and adverse effects. Am. J. Med. 821: 1102-1108, 1987. 4. Hannak, D., Scharbert. F. and Kattermann, R. Stepwise binary gradient high performance liquid chromatographic system for routine drug monitoring. J. Chromatogr. 728: 307-310, 1996. 5. Harris, L., McKenna, W. J., Rowland, E., Holt, D.W., Storey, G. C. A. and Kirkler, D. M. Side effects of long term amiodarone therapy. Circulation 67: 45-51, 1983. 6. Heger, J. J., Solow, E. B., Prystowsky, E. N. and Zipes D. Plasma and red blood cell concentrations of amiodarone during chronic therapy. Am. J. Cardiol. 53: 912-917, 1984. 7. Jandreski, M. A. and Vanderslice, W. E. Clinical measurement of amiodarone and desethylamiodarone by using solid phase extraction followed by HPLC with a high-carbon reverse-phase column. Clin. Chem. 393: 496-500, 1993. 8. Korth-Bradley, J. M., Rose, G. M., de Vane, P. J., Peters, J. and Chiang, S. T. Population pharmacokinetics of intravenous amiodarone in patients with refractory ventricular tachycardialfibrillation. J. Clin. Pharmacol. 36: 715-719, 1996. 9. Lam, S. High performance liquid chromatography of amiodarone and desethylamiodarone in serum after microscale protein precipitation. J. Chromatogr. Biomed. Appl. 381: 175-178, 1986. 10. Lesko, L. J., Marion, A., Canada, A. T. and Haffajee C. High pressure liquid chromatography of amiodarone in biological fluids. J. Pharm. Sci. 70, 12: 1366-1368, 1981. 11. MilIs, T. and col. Instrumental Data for Drug Analysis, vol 6. CRC Press Inc, New York, USA, 1996, p. 8. 12. Plomp, T. A., Engels, M., Robles de Medina, E. O. and Maes, R. A. A. Simultaneous determination of amiodarone and its mayor metabolite desethylamiodarone in plasma, urine and tissues by high performance liquid chromatography. J. Chromatogr. Biomed. Appl. 273: 379-392, 1983. 13. Podrid, P. J. Amiodarone: reevaluation of an old drug. Ann. lnt. Med. 122: 689-700, 1995. 14. Pollak, P. T. A systematic review and critical comparison of internal standards for the routine liquid chromatographic assay of amiodarone and desethylamiodarone. Ther. Drug. Monit. 18: 168-178, 1996. 15. Rosenbaum, M. B., Chiale, P. A., Halpern, M. S., Nau, G. J., Przybylski, J., Levi, R. J., Lazzari, J. O. and Elizari, M. V. Clinical efficacy of amiodarone as an antiarrhytmic agent. Am. J. Cardiol. 38: 934-944, 1976. 16. Trivier, J. M., Pommery, J., Libersa, C., Caron, J. and Lhermitte, M. High performance liquid chromatographic assay of amiodarone N-desethylation in microsomes of rat liver. J. Chromatogr. Biomed. Appl. 579: 267-276, 1992. 17. Ujhelyi, M. R., Klamerus, K. J., Vadiei, K., O’Rangers, E., Izard, M., Neefe, D. L., Zimmerman, J. J. and Chow, M. S. Disposition of intravenous amiodarone in patients with normal and impaired renal function. J. Clin. Pharmacol. 36: 122-30, 1996. 18. Vadiei, K., O’Ranger, E. A., Klamerus, K. J., Kazierad, D. J., Leese, P. T., Chow, M. S. and Zimmerman, J. J. Pharmacokinetics of intravenous amiodarone in patients with impaired left ventricular function. J. Clin. Pharmacol. 36: 720727, 1996. 19. Vuagnat, A., Goedel-Meinen, L., Gries, E., Hoffman, M., Presch, A. and Blomer, M. Stability of amiodarone in serum samples under various storage conditions. Arzneimittelforschung 42: 327-330, 1993. 20. Zhang, C. X., Aebi, Y. and Thorman, W. Microassay of amiodarone and desethylamiodarone in serum by capillary electrophoresis with head-column field-amplified sample stacking. Clin. Chem. 42: 1805-1811, 1996.
© Copyright 2026