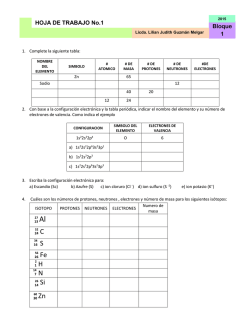
1 TEMA 1: LA MATERIA LEYES DE LA QUÍMICA La materia
TEMA 1: LA MATERIA LA QUÍMICA LEYES DE LA QUÍMICA La química es la parte de la ciencia que se encarga de estudiar la constitución (no solo de qué átomos está formada, sino también cómo están unidos), las propiedades (intentando deducirlas a partir de sus constitución) y las transformaciones de la materia (las reacciones químicas). La materia Separación de los componentes de una mezcla Leyes ponderales de la química LA MATERIA Ley de la conservación de la masa de Lavoisier Ley de las proporciones definidas de Proust Ley de las proporciones múltiples de Dalton La materia que nos rodea, normalmente está formada por una mezcla de sustancias, como por ejemplo el aire que esta formado por una mezcla de nitrógeno, oxígeno, dióxido de carbono, vapor de agua y otras sustancias en menor proporción. Teoría atómica de Dalton Ley de los volúmenes de combinación de Gay-Lussac Hipótesis de Avogadro Masas atómicas y moleculares Átomo-gramo y molécula-gramo Número de Avogadro. concepto de mol Las propiedades de una mezcla (densidad, punto de fusión, punto de ebullición, etc) dependen de la composición de la mezcla. Fíjate, por ejemplo en el distinto color y sabor de dos vasos de café con leche mezclados en distinta proporción. Por el contrario, se llama sustancia pura a aquella que siempre presenta las mismas propiedades, de tal manera que son características de esa sustancia. Equivalencia entre la uma y el kg: Volumen Molar Ecuación general de los gases perfectos agua cobre Ley de Boyle - Mariotte Ley de Charles – Gay Lussac Ley de Gay Lussac Ley de Avogadro La densidad de un gas Densidad (g/cm3) P. Fusión (ºC) 1 0º 8,93 1083 P.Ebullición (ºC) 100 (1Atm) 2310 Además, en las sustancias puras la temperatura a la que se producen los cambios de estado, no solo es siempre la misma, sino que permanece constante mientras tiene lugar el cambio de estado, cosa que no ocurre en las mezclas. Así por ejemplo, el agua pura empieza a congelar a 0ºC y aunque sigamos enfriando, la temperatura no baja y permanece a 0ºC hasta que se congela toda el agua. Una vez que se ha congelado toda, si seguimos enfriando se podría a –1ºC, –2ºC, etc. Ese comportamiento no lo tienen las mezclas, que en primer lugar empiezan a congelar a más bajas temperaturas y no siempre a la misma (depende la composición) y en segundo lugar la temperatura varía a lo largo del cambio de estado Ley de las presiones parciales de Dalton Teoría cinética de los gases Las sustancias puras se clasifican en elementos y compuestos: DISOLUCIONES • Clasificación de las disoluciones • partes por millón (ppm) Molaridad (M) Normalidad (N) Molalidad (m) Fracción molar (x) Los elementos son sustancias puras (y por tanto con propiedades fijas) pero que no pueden descomponerse en otras sustancias mas simples por métodos experimentales. Por ejemplo el cobre, el oxígeno, etc Los compuestos son sustancias puras (y que por tanto también tienen propiedades fijas) pero que se pueden descomponer en otras sustancias diferentes. Por ejemplo el agua, el azúcar, etc Las mezclas se clasifican en homogéneas y heterogéneas: ECUACIONES QUÍMICAS • Cálculos estequiométricos Reacciones químicas • 1 Mezclas heterogéneas son aquellas en las que los componentes pueden distinguirse a simple vista o al microscopio y su composición y sus propiedades varían de una parte a otra de la mezcla. Por ejemplo el granito Mezclas homogéneas, llamadas también disoluciones, son aquellas en las que los componentes no pueden distinguirse ni siquiera al microscopio y tienen la misma 2 composición y las mismas propiedades en toda la mezcla. Por ejemplo el aire, el agua del mar o del grifo, el bronce, etc Cuando se utiliza: Podemos hacer un esquema de la clasificación de la materia: Elementos Sust.Puras Compuestos Materia Heterogéneas Mezclas Ejemplo: Materiales: Sedimentación Se utiliza para separar Agua y barro un líquido de un sólido que no es soluble y tiene distinta densidad Tiempo Centrifugación Se utiliza para separar Leche y nata un líquido de un sólido que no es soluble y tiene distinta densidad Centrífuga Homogéneas o Disoluciones Filtración Se utiliza para separar un líquido de un sólido que no es soluble agua y arena Embudo Papel de filtro O un Kitasato conectado a una bomba de vacío Decantación Se utiliza para separar dos líquidos no miscibles. La separación es por densidad agua y aceite Embudo de decantación Cristalización Se utiliza para separar un líquido de un sólido que es soluble. Se deja evaporar el líquido y quedarían los cristales del sólido agua y sal Cristalizador Destilación Se utiliza para separar dos líquidos que tienen distinto punto de ebullición. agua y alcohol Destilador: Matraz, mechero, termómetro y refrigerante Y podemos utilizar el siguiente algoritmo para identificarlas Cromatografía Sustancias con distinta velocidad de desplazamiento y que tienen distinto color. SEPARACIÓN DE LOS COMPONENTES DE UNA MEZCLA • • Clorofilas En un papel de filtro se pone la mezcla y se introduce una punta en alcohol. El alcohol va subiendo y arrastra los componentes, separándolos por densidad Para separar mezclas heterogéneas se utilizan diversos medios como: Sedimentación, Centrifugación, Filtración y Decantación. Para separar los componentes de una mezcla homogénea o disolución se utilizan medios basados en los cambios de estado: Cristalización y Destilación. 3 4 LEYES PONDERALES DE LA QUÍMICA En el amoníaco, el nitrógeno e hidrógeno se encuentran en una proporción de 4,63. Hallar la cantidad de amoníaco que se obtendrá a partir de 2,87 gr de hidrógeno. Ley de la conservación de la masa de Lavoisier: Dice que, en una reacción química la masa permanece constante, es decir que la suma de la masa de las sustancias que reaccionan es igual a la suma de la masa de los productos. Nitrógeno x = = 4,63 Hidrógeno 2,87gr ∑ Re activos =∑ Pr oductos ⇒ x = 13,29gr N por tanto la cantidad de NH3 formada será: 13,29+2,87=16,16 gr NH3 Ejemplo 1: Ejemplo 3: Si se pesa cuidadosamente una determinada cantidad de limaduras de hierro y se calientan durante algunas horas, al volver a pesar veremos que han aumentado de peso. ¿Contradice esto la ley de Lavoisier? No, porque se ha formado óxido de hierro, que obviamente pesa más que el hierro, pero no hemos pesado el oxígeno que ha reaccionado con el hierro Cuando 1,00 gr de hierro reacciona con 1,00 gr de azufre se producen 1,57 gr de sulfuro de hierro, quedando azufre en exceso. Si ahora hiciéramos reaccionar 1,31 gr de hierro con 0,63 gr de azufre: a) ¿Quién quedará en exceso? b) ¿Qué cantidad de sulfuro de hierro de formará? c) ¿Cual es la composición centesimal de dicho compuesto? Fe+O2 → FeO a) Supongamos que reacciona todo el hierro, entonces necesitaría una cantidad de azufre igual a: Al contrario puede decirse cuando se calienta un trozo de mármol (carbonato de calcio), pues que pesa menos que al principio. En este caso lo que ocurre es que se forma dióxido de carbono, que al ser un gas escapa: Hierro 1,00gr 1,31gr = = 1,75 = Azufre 0,57gr x CaCO3→ CaO+CO2 Ley de las proporciones definidas de Proust: Dice que, cuando dos o más elementos se combinan entre sí para formar un compuesto, lo hacen siempre en una proporción de pesos definida y constante. Eso quiere decir que en cualquier compuesto químico la relación entre los pesos de los elementos que lo forman es constante, por ejemplo, la cantidad de plomo que se une a una determinada cantidad de azufre guarda siempre la misma relación: Plomo 1,82gr 1,50gr 0,98gr = = = = 6,5 = cte. Azufre 0,28gr 0,23gr 0,15gr ⇒ x = 0,75gr Azufre Como vemos, para 1,31 gr de Fe sería necesario una cantidad de azufre de 0,75 gr, mayor de la que se ha puesto, así que evidentemente parte del hierro quedará sin reaccionar. La cantidad de hierro que reacciona con 0,63 gr de azufre es; Hierro 1,00gr x = = 1,75 = Azufre 0,57gr 0,63 ⇒ x = 1,10gr Hierro Por tanto, como solamente reaccionan 1,10 gr del hierro que se puso, sobran 1,31– 1,10=0,21 gr de hierro. b) La cantidad de sulfuro de hierro que se ha obtenido es: 0,63 gr de Azufre + 1,10 gr de Hierro = 1,73 gr de FeS Eso puede comprobarse calentando una mezcla de azufre en exceso con una determinada cantidad de plomo y posteriormente eliminando el azufre que no ha reaccionado disolviéndolo en sulfuro de carbono. c) La composición centesimal es el porcentaje de cada elemento, es decir cuantos gramos de cada elemento hay en 100 gr de compuesto, así que, como sabemos que en 1,57 gr de FeS hay 1 gr de hierro y 0,57 de azufre, entonces en 100 gr de FeS habrá: Al contrario, podemos calentar una determinada cantidad de óxido de mercurio y pesarla después para averiguar por diferencia de pesada la masa de oxígeno que ha perdido: Mercurio 1,88gr 1,50gr 1,00gr = = = = 12,5 = cte. Oxígeno 0,15gr 0,12gr 0,08gr Ejemplo 2: 5 1,57gr FeS 100gr FeS = 1,00gr Fe x ⇒ x = 63,69% Fe 1,57gr FeS 100gr FeS = 0,57gr S x ⇒ x = 36,31%S 6 Ley de las proporciones múltiples de Dalton: Dice que, si dos elementos pueden combinarse de diferentes formas, los pesos de uno de los elementos que se combinan con una cantidad fija del otro elemento, guardan una relación de números enteros sencillos. • • Compuesto Dióxido de Carbono Monóxido de Carbono Compuesto Trióxido de Azufre Dióxido de Azufre Análisis 100 gr C 266,7 gr O 100 gr C 133,6 gr O Relación de pesos Oxígeno 266,7 2 = 133,6 1 Análisis 146,4 gr O 97,8 gr O Relación de pesos Oxígeno 146,4 3 = 1,5 = 97,8 2 100 gr S 100 gr S • La materia está formada por minúsculas partículas indivisibles e indestructibles llamadas átomos. Hay distintas clases de átomos que se distinguen por su masa y sus propiedades. o Todos los átomos de un elemento poseen las mismas propiedades químicas. o Los átomos de elementos distintos tienen propiedades diferentes. Los compuestos se forman al combinarse los átomos de dos o más elementos en proporciones fijas y sencillas. De modo que en un compuesto los de átomos de cada tipo están en una relación de números enteros (H2O) o fracciones sencillas (Fe2O3). Ejemplo 4: H2 O El estaño forma dos cloruros cuyos contenidos en estaño son del 88,12% y 78,76% . Comprobar que se cumple la ley de Dalton. Compuesto Cloruro 1 Cloruro 2 Análisis 88,12 gr Sn 11,88 gr Cl 88,12 11,88 78,76 gr Sn 78, 76 21, 24 21,24 gr Cl Relación = 7,42 = 3,71 • Relación CO CO2 En las reacciones químicas, los átomos se intercambian de una a otra sustancia, pero ningún átomo de un elemento desaparece ni se transforma en un átomo de otro elemento. 7,42 2 = 3,71 1 También podíamos haber calculado, aplicando la ley de las proporciones definidas, la cantidad de cloro que reacciona con una mima cantidad de estaño: Estaño 78,76gr x = = Cloro 21,24gr 11,88gr Compuesto Cloruro 1 Cloruro 2 ⇒ Análisis 88,12 gr Sn 11,88 gr Cl 44,05 gr Sn 11,88 gr Cl x = 44,05gr Sn Con la teoría atómica de Dalton se explican perfectamente las leyes ponderales: • Relación de pesos Estaño 88,12 2 = 44,05 1 • Ejemplo 5: Empezando la casa por el tejado: Ya deberías saber que el cobre tiene dos óxidos, el Cu2O y el CuO. Como puedes ver claramente, para una misma cantidad de oxígeno en el óxido cuproso hay doble cantidad de cobre que en el óxido cúprico, así que la relación de cobre es 2/1. Ahora escribe los dos óxidos del hierro e indica la relación que guarda el hierro. • Como los átomos no pueden crearse ni destruirse, está claro que en una reacción química simplemente se reorganizan y por tanto como hay los mismos, aunque unidos de otra forma, es obvio que la masa de los reactivos y de los productos sea la misma (Ley de Lavoisier) Como una muestra de CO2, por ejemplo, está formada por un conjunto de moléculas “iguales”, es evidente que la proporción de átomos de los dos elementos se mantenga constante. (Ley de Proust) Igual se explica la ley de Dalton, ya que aunque un elemento pueda combinarse con otro de diferente forma, siempre la proporción del segundo elemento guardará una relación de números sencillos, ya que siempre el número de átomos que se combine será un número entero. El modelo de Dalton ha estado vigente hasta que a primeros del siglo XX Thomson descubriera el electrón y con ello que los átomos no son individibles. TEORÍA ATÓMICA DE DALTON Ejemplo 6: Aunque hoy día nos resulte simple, como poco, hay que tener en cuenta que Dalton elaboró su teoría en 1805 para dar explicación a las leyes ponderales y que debemos considerarla como una de las que más ha contribuido al desarrollo de la química. Calcular la composición centesimal del sulfato de sodio. DATOS: Pesos atómicos: Na=23, S=32, O=16 7 8 Como una molécula de Na2SO4 está formada por 2 átomos de e sodio, 1 de azufre y 4 de oxígeno, su peso molecular es 142 gr/mol: La fórmula empírica del hidrato de carbono es (CH2O)n y sabiendo la masa molecular podemos calcular el valor de n. Ya que: 2 Na ––– 2.23 = 46 1 S ––– 1.32 = 32 4 O ––– 4.16 = 64 Pm Na2SO4 (12+2+16).n = 180 Y ahora, de acuerdo con la ley de las proporciones definidas, si en 142 gr de Na2SO4 hay 64 gr de Na, en 100 gr de sustancia habrá: 142gr Na 2 SO 4 46gr Na = 100gr Na 2 SO 4 x ⇒ x = 32,39 % Na 142gr Na 2 SO 4 32gr S = 100gr Na 2 SO 4 x ⇒ x = 22,53 % S ⇒ n=6 Por tanto la fórmula del compuesto es C6H12O6 que puede ser glucosa o uno de sus isómeros. = 142 gr/mol 142gr Na 2 SO 4 64gr O = 100gr Na 2 SO 4 x ⇒ LEY DE LOS VOLÚMENES DE COMBINACIÓN DE GAY–LUSSAC Dice que, cuando dos o más gases reaccionan entre sí, sus volúmenes y los volúmenes de los productos gaseosos guardan una relación de números enteros sencillos. (Siempre que, claro, todos ellos estén medidos en las mismas condiciones de P y Tª) Así por ejemplo 1 volumen de hidrógeno reacciona con 1 volumen de cloro y da lugar a dos volúmenes de cloruro de hidrógeno. O por ejemplo, un volumen de oxígeno reacciona con dos volúmenes de hidrógeno y da lugar a dos volúmenes de vapor de agua. x = 45,07 % O Ejemplo 7: Un compuesto que tiene una masa molecular de 126 gr/mol contiene un 25,4% de azufre, 38,1% de oxígeno y 36,5% de sodio. ¿Cuál es su fórmula? % % Patómico = 0,79 Azufre 25,4 % 25, 4 32 Oxígeno 38,1 38,1 16 = 2,38 36,5 36 , 5 23 = 1,58 Sodio Divd.por el menor 2 , 38 0 , 79 Relación =1 1 = 3,01 3 =2 2 0 , 79 0 , 79 1, 58 0 , 79 Dalton no tomó muy en serio los experimentos de Gay–Lussac, porque no podía explicar esto, ya que pensaba que las partículas de los gases eran monoatómicas. HIPÓTESIS DE AVOGADRO La fórmula del compuesto es Na2SO3, que corresponde al sulfito de sodio Avogadro para poder explicar la ley de Gay–Lussac formuló la hipótesis de que las partículas de los elementos gaseosos no eran átomos aislados, sino que eran agrupaciones de dos átomos, a los que llamó moléculas. (Hoy sabemos que salvo los ganes nobles, todos los elementos gaseosos forman moléculas diatómicas.) Ejemplo 8: El análisis de un hidrato de carbono nos da la siguiente composición centesimal: 40% de carbono, 6,7º% de hidrógeno y el resto, 53,29% oxígeno. Hallar su fórmula sabiendo que su masa molecular es 180. % Carbono Hidrógeno Oxígeno % Patómico = 3,33 40 % 40 12 6,71 6 , 71 1 = 6,71 53,29 53, 29 16 = 3,33 Divd.por el menor 6 , 71 3, 33 Relación =1 1 = 2,01 2 =1 1 3, 33 3, 33 3, 33 3, 33 Con esta hipótesis, que por estar probada es una ley, se explica perfectamente la ley de los volúmenes de combinación de Gay–Lussac, sin tener que descartar la teoría de Dalton: 9 10 Por comparación con la uma se tabulan la masas atómicas de cada uno e los elementos (y las masas moleculares), que hoy día se determinan con gran precisión en el espectrógrafo de Este razonamiento llevó a Avogadro a enunciar que, en volúmenes iguales de gases diferentes hay el mismo número de moléculas, siempre que estén medidos en las mismas condiciones. (Y al contrario, naturalmente, el mismo número de moléculas sea del gas que sea ocupan el mismo volumen.) masas. Así la masa del 12 C es evidente 12,000 umas, 1,008 umas el hidrógeno o 15,999 umas el oxígeno. Aunque los químicos suelen utilizar el término “peso atómico”, los físicos prefieren llamarlo “masa atómica” porque es más exacto. La IUPAC recomienda llamarlo “masa atómica relativa” Ejemplo 9: ÁTOMO–GRAMO Y MOLÉCULA–GRAMO Los volúmenes de los gases de la tabla están medidos en las mismas condiciones de presión y temperatura. Complétala. Gas Volumen Nº Moléculas Cloro 3 x Oxígeno Nitrógeno 3 1 x x/3 Metano 6 2x Como las masas atómicas y las masas moleculares son relativas, es evidente que en 12gr de carbono, en 1,008 gr de hidrógeno o 15,999 gr de oxígeno habrá el mismo número de átomos y por eso (y porque es imposible medir umas) los químicos acordaron utilizar como patrón de masa el número en gramos que es idéntico a su masa en umas. Amoníaco 12 4x • • MASAS ATÓMICAS Y MOLECULARES La hipótesis de Avogadro precisamente es la base para el cálculo de la masa de los átomos, ya que si dos volúmenes iguales de gases contienen el mismo número de moléculas, pesándolos podremos establecer la relación entre sus masas, así por ejemplo si se pesan volúmenes iguales de hidrógeno y oxígeno veremos que el de oxígeno pesa 16 veces más. El CO2 pesa 22 veces más que el mismo volumen de hidrógeno, así que como la molécula de hidrógeno es diatómica, el CO2 pesa 44 veces más que el átomo de hidrógeno. Átomo–gramo de un elemento es el número en gramos que coincide exactamente con su masa atómica. Obviamente 1 átomo–gramo de cualquier elemento contiene el mismo número de átomos. Molécula–gramo de un compuesto es el número en gramos que coincide exactamente con su masa molecular. Obviamente 1 molécula–gramo de cualquier compuesto contiene el mismo número de moléculas. Ten cuidado al emplear los términos en los elementos gaseosos que forman moléculas diatómicas, así por ejemplo, un átomo–gramo de oxígeno son 16gr de oxígeno, mientras que una molécula gramo de oxígeno (O2) serían 32 gr de oxígeno. Como siempre que se mide una magnitud física, hay que definir una unidad de medida, y esta inicialmente fue la masa del hidrógeno, por ser el átomo más ligero y al que se le asigno 1. Posteriormente se cambió y se eligió como patrón la masa de 1/16 oxígeno. Actualmente, la IUPAC ha acordado utilizar como unidad de masa atómica, uma, la doceava parte de la masa del isótopo 12 del carbono. 11 12 NÚMERO DE AVOGADRO. CONCEPTO DE MOL Ejemplo 10: Ya hemos dicho que en un átomo–gramo de cualquier elemento o en una molécula–gramo de cualquier compuesto hay el mismo número de átomos o de moléculas respectivamente. Ese número, llamado Número de Avogadro, NA = 6,023.1023. a) ¿Donde hay más átomos, en 1 mol de hierro o en 1 mol de carbono? b) ¿Dónde hay más átomos, en 1 mol de hierro o en 1 mol de oxígeno? b) ¿Que pesa más, 1 mol de hierro o 1 mol de carbono? Elemento masa de 1 átomo masa de 1 mol C 12,0 umas 12,0 gramos O 16,0 umas 16,0 gramos Cl 35,5 umas 35,5 gramos a) Un mol de cualquier sustancia contiene un número de Avogadro de lo que sea, por tanto en 1 mol de hierro hay 6,023.1023 átomos de hierro y en 1 mol de carbono hay también 6,023.1023 átomos de carbono. b) En 1 mol de oxígeno hay 6,023.1023 moléculas de oxígeno (ya que el oxígeno es un gas que forma moléculas diatómicas O2) y como cada molécula tiene dos átomos de oxígeno, en 1 mol de oxígeno hay 2*6,023.1023 átomos de oxígeno. c) En el apartado a) hemos razonado que en 1 mol de hierro y de carbono hay el mismo número de átomos, pero como los átomos de hierro son más pesados que los de carbono, 1 mol de hierro pesará más que el de carbono. Actualmente los términos átomo–gramo y molécula–gramo se engloban en el término genérico de mol., Así que, un mol es la cantidad de materia que contiene el mismo número de partículas que hay en 12 gr de átomos de 12C. Ejemplo 11: ¿Cuántos moles hay en 132 gr de CO2? Como 1 mol de CO2, por definición, es igual a su masa molecular expresada en gramos, es decir 44 g, entonces, por simple proporción: De una simple proporción se obtiene el número de moles como: nº moles = nº gramos Pm n º gramos 132 = = 3 moles Pm 44 a la misma conclusión llegamos recordando que: n º moles = Recuerda que, por ejemplo: 1 mol H2O –––– tiene una masa igual a su Pm, es decir 18 gr –––– contiene 6,023.1023 moléculas 1 mol CO2 x Equivalencia entre la uma y el Kg: Ejemplo 12: a) ¿Cuántas moléculas hay en una cucharada de 100 cm3 de ácido sulfúrico? b) ¿Cuál es la masa en gramos de una molécula de ácido sulfúrico? DATOS: Densidad del H2SO4 = 1,98 gr/cm3 Para hallar el equivalente de la uma y el Kg recordemos que 1 mol de carbono 12 tiene una masa de 12 gramos y contienen un número de Avogadro de átomos, es decir que: 1 mol de át.de C12 –––– contiene 6,023.1023 át.de C12 ––– tiene una masa de 12 gr 1 átomo de C12 ––– x gr a) En primer lugar hay que averiguar la masa de sulfúrico, teniendo en cuenta que: ρ = m/V por tanto, la masa de 1 solo átomo de carbono será: ⇒ m = V ⋅ ρ = 100cm 3 ⋅ 1,98 cmgr3 = 198 gr H2SO4 y ahora: 1 mol H2SO4 –––– son 98 gr H2SO4 –––– contiene 6,023.1023 moléculas H2SO4 198 gr H2SO4 –––– x 1át ⋅ 12 g C = = 1,99 ⋅ 10 − 23 g = 1,99 ⋅ 10 − 26 Kg 6,023 ⋅ 10 23 át 12 de donde x = 1,217.1024 moléculas de H2SO4 y como la uma, que es la doceava parte del C12 sería: 1uma = –––– son 44 gr CO2 –––– contiene 6,023.1023 moléculas CO2 –––– 132 gr CO2 b) Por definición, la masa de 1 sola molécula de H2SO4 tiene una masa de 98 umas. Teniendo en cuenta la relación entre la uma y el Kg: C12 = 1,66 ⋅ 10 − 27 Kg 12 H2SO4 = 98 umas . 1,66.10–27 Kg/uma = 1,63.10–25 Kg 13 14 VOLUMEN MOLAR ECUACIÓN GENERAL DE LOS GASES PERFECTOS De la hipótesis de Avogadro se deduce inmediatamente que, si en volúmenes iguales de gases diferentes hay el mismo número de moléculas (siempre que estén medidos en las mismas condiciones), naturalmente, el mismo número de moléculas sea del gas que sea ocupan el mismo volumen. Pues bien: La ecuación general de los gases es el resumen que engloba a varias leyes que se enunciaron de forma separada: Ley de Boyle – Mariotte: Dice que, si se mantiene la temperatura constante, el volumen de una determinada cantidad gas es inversamente proporcional a la presión: Un mol de cualquier gas (es decir 6,023.1023 moléculas de ese gas) ocupa el mismo volumen, siempre que se mida en las mismas condiciones. Experimentalmente se comprueba que un mol de cualquier gas, medido en CN (1atm y 0ºC), ocupa un volumen de 22,4 litros. Naturalmente si se mide en otras condiciones de presión y temperatura, ocupará otro volumen distinto, pero igual sea el gas que sea. PV = k (T, n constantes) Ley de Charles – Gay Lussac: Dice que, si se mantiene la presión constante, el volumen de una determinada cantidad gas es directamente proporcional a la temperatura absoluta: V = k´T Ejemplo 13: Teniendo en cuenta que la molécula de hidrógeno es H2 y que la molécula de oxígeno es O2, y que sus masas relativas son 1 y 16 respectivamente, si, descomponiendo el agua por electrolisis en el laboratorio, llenáramos una botella de 2 litros de hidrógeno y otra igual de oxígeno. ¿Dónde habrá más moléculas? Razónalo Ley de Gay Lussac: Dice que, si se mantiene el volumen constante, la presión que ejerce una determinada cantidad gas es directamente proporcional a la temperatura absoluta: P = k´T De acuerdo a la hipótesis de Avogadro, en volúmenes iguales de gases diferentes (medidos en las mismas condiciones) hay el mismo número de moléculas, por tanto en 2 L de H2 y en 2 L de O2 hay las mismas moléculas. Otra cosa es que la masa de los dos litros de cada gas tengan distinta masa, ya que deben seguir guardando la relación entre sus masas, así la masa de la botella de oxígeno será 16 veces mayor que la de hidrógeno. V = k´´n de donde: 32 ⋅ 2 = 2,86 gr O 2 22,4 y= (P, T constantes) La ecuación general de los gases se obtiene combinando las tres, de lo que evidentemente resulta que: 1 mol O2 –––– son 32 gr O2 –––– contiene 6,023.1023 moléc. O2 ––– ocupan 22,4 l en CN x gr O2 –––– y moléc. O2 ––– 2 l en CN x= (V, n constantes) Ley de Avogadro: Si se mantienen las mismas condiciones de presión y temperatura, el volumen de un gas depende del número de moles, es decir de la cantidad de gas: Ejemplo 14: Calcular la cantidad de oxígeno que habrá en una botella de 2 litros, medidos en condiciones normales. ¿Cuántas moléculas de oxígeno hay? Teniendo en cuenta que 1 mol de oxígeno (O2) son 32 gr de oxígeno y que 1 mol de cualquier gas medido en CN ocupa un volumen de 22,4 litros, por simple proporción: (P, n constantes) 2 ⋅ 6,023 ⋅ 10 23 = 5,38 ⋅ 10 24 moléculas O 2 22,4 PV=nRT donde R es una constante para todos los gases ideales que vale R=0,082 atm.litro/ºK.mol A partir de aquí se deduce muy fácilmente el volumen molar de un gas en CN, ya que no hay mas que sustituir, P=1atm, n=1mol y T=0ºC=273ºK 1atm ⋅ V = 1mol ⋅ 0,082 15 atm ⋅ litro 273º K º K ⋅ mol ⇒ V = 22,4 litros 16 Ley Boyle – Mariotte T, n constantes PV = k1 Ley Charles – Gay Lussac P, n constantes V = k2T Ley Gay Lussac Ley de Avogadro V, n constantes P = k3T P, T constantes V = k4n La densidad de un gas puede calcularse fácilmente a partir de la ecuación general, ya que si tenemos en cuenta la definición de densidad y que el nºmoles=nºgramos/Pm: PV = nRT ⇒ PV = m RT Pm ⇒ ρ= m P ⋅ Pm = V RT Observa que la densidad de un gas no es constante como pasa en los sólidos y líquidos. La densidad de un gas depende de la presión y de la temperatura (en la expresión anterior, para un gas concreto Pm y R son constantes, pero P y T son variables.) Ejemplo 1: Imagina que en el laboratorio tenemos una temperatura de 20ºC. En una jeringa, como la de la figura, que tiene un émbolo que puede moverse prácticamente sin rozamiento introducimos oxígeno hasta un volumen de 30 mL. Posteriormente introducimos la jeringa en agua caliente y después de un ratito, cuando se ha llegado al equilibrio térmico, vemos que el émbolo se ha desplazado y el gas ocupa 32 mL. ¿Cuál es ahora la temperatura del gas? Si la presión del laboratorio es de 730 mmHg, ¿Cual es la densidad del oxígeno antes y después de calentarlo? También podíamos (1) calcular el número de moles aplicando la ecuación general de los gases PV = nRT → P ⋅ 0,030 = n ⋅ 0,082 ⋅ (273 + 20) → n=0,00125P moles y (2) luego calcular el volumen que ese número de moles ocupa en otras condiciones: PV = nRT → P ⋅ 0,032 = 0,00125P ⋅ 0,082 ⋅ T´ → T´= 312,5ºK = 39,5ºC La densidad de un gas puede obtenerse a partir de la ecuación de los gases sin más que reorganizar las magnitudes: m m P ⋅ Pm ⇒ PV = RT ρ= = Pm V RT m P ⋅ Pm (730 / 760) ⋅ 32 gr = = = 1,279 V RT 0,082 ⋅ (273 + 20) L m P ⋅ Pm (730 / 760) ⋅ 32 gr = = = = 1,199 V RT 0,082 ⋅ ( 273 + 39,5) L ρ 20 º C; 0,96atm = ρ 39,5 º C;0,96 atm Ejemplo 2: En un experimento de laboratorio se han obtenido 2 litros de hidrógeno, medidos a 27ºC y 740 mmHg. Calcular la masa relativa del hidrógeno sabiendo que la masa del gas es de 0,158 gr . El hidrógeno puede obtenerse, por ejemplo por reacción de ácido clorhídrico con aluminio, y se recoge sobre agua. Se coloca una probeta o un matraz aforado, como en el dibujo, invertido y previamente lleno de agua. El gas al ir ascendiendo va desplazando el agua. Si tomamos el valor de 0,082 atm.litro/ºK.mol para la constante universal de los gases, las unidades de las magnitudes que aparecen en la fórmula hay que medirlas en esas unidades también, así que la presión hay que expresarla en atmósferas. Teniendo en cuenta que 1atm=760 mmHg PV = nRT ⇒ PV = m RT Pm ⇒ 740 0,158 2= 0,082 ⋅ (273 + 27) 760 Pm despejando, obtenemos que la masa molecular del hidrógeno es 2 gr/mol. Y como la molécula de hidrógeno es diatómica (H2), resulta que la masa relativa del hidrógeno es 1 gr/mol, o bien 1 uma/átomo. PV nR T V T 0,030 (273 + 20) ⇒ ⇒ ⇒ T´= 312,5ºK = 39,5ºC = = = P V´ n R T´ V´ T´ 0,032 T´ Fíjate que a partir de la ecuación general de los gases, escribiéndolas para dos situaciones diferentes y dividiéndola miembro a miembro hemos obtenido la ley de Charles – Gay Lussac. 17 18 LEY DE LAS PRESIONES PARCIALES DE DALTON TEORÍA CINÉTICA DE LOS GASES Hasta ahora se han tratado gases aislados, pero Dalton estudió el comportamiento de las mezclas de gases. El estudio de las reacciones en las que intervienen gases se hace midiendo los volúmenes que ocupan antes y después de la reacción (teniendo siempre en cuenta que el volumen de un gas depende la presión y de la Temperatura.) Las leyes anteriores, obtenidas experimentalmente, necesitan de una teoría que las pueda explicar. Varios científicos como Bernoulli, Joule, Clausius, Maxwell y Boltzman a lo largo del tiempo han desarrollado la teoría cinético–molecular para los gases, según la cual: • La presión parcial de un gas, por definición es la presión que el gas ejerce como si estuviese solo y él ocupase todo el recipiente que lo contiene, así el gas 1, del que supongamos que hay n1 moles, tendrá una presión parcial igual a: • p1 V = n 1 RT • La ley de Dalton dice que, la presión total de una mezcla de gases es igual a la suma de las presiones parciales que ejerce cada gas, siempre que no reaccionen entre ellos. • Un gas está formado por muchas partículas, o moléculas, muy pequeñas en relación a la distancia que las separa. Las moléculas están en continuo movimiento y las fuerzas que se ejercen entre ellas son despreciables. La energía cinética media de las moléculas es proporcional a su temperatura absoluta Los choques de las moléculas entre sí y con las paredes del recipiente son elásticos. Según este modelo, la presión se explica por los choques de las partículas con las paredes del recipiente. PTotal = p1 + p 2 + .... Así por ejemplo, si en un recipiente a 27ºC hay una determinada cantidad de oxígeno que ejerce una presión de 1 atm y una cantidad de nitrógeno que ejerce una presión de 0,5 atm, la presión total sería de 1,5 atm. La comprobación de la ley de Dalton de las presiones parciales es muy simple, ya que como a cada gas se le puede aplicar la ley de los gases perfectos, tendremos que: P = n1 RT RT RT RT + n2 + .... = (n 1 + n 2 + ...) =n V V V V donde n1, n2, ... son los moles de cada uno de los gases y n es el total de moles. Por otro lado, dividiendo la presión parcial de un gas por la presión total de la mezcla tendremos: PV = nRT ⇒ pi = P ni n ⇒ Precisamente por el aumento de energía cinética que tiene lugar al aumentar la temperatura se explica la gran influencia que tiene la temperatura en la velocidad de las reacciones químicas. Obviamente un aumento de la presión hace disminuir el volumen y que las moléculas tengan menos espacio para moverse. Una disminución del volumen hace que las moléculas de gas estén mas juntas y que por tato aumente el número de choques con lo que la presión aumentará. Por tanto la presión y el volumen son inversamente proporcionales. Al aumentar la temperatura, aumentará la energía cinética de las moléculas y por tanto los choques contra las paredes serán mayores, lo que provoca un aumento del volumen. El volumen y la temperatura son directamente proporcionales. p1 V = n 1 RT pi n i = P n No todas las moléculas del gas tienen la misma velocidad, incluso la velocidad de una partícula concreta varía constantemente debido a los continuos choques, por lo que realmente habría que decir que es la energía cinética media de las moléculas del gas la que es proporcional a la temperatura. pi = P ⋅ x i se deduce que la presión parcial de un gas es igual a la presión total por su fracción molar ( xi = ni / n ) Al aumentar la temperatura, aumentará la energía cinética de las moléculas y por tanto los choques contra las paredes serán mayores, lo que provoca, si el volumen es fijo, un aumento de la presión. La presión y la temperatura son directamente proporcionales. Si se mantiene la presión, y aumentamos el número de moléculas obviamente aumentará el volumen, que es lo que ocurre cuando inflamos un globo. El volumen y el número de moles son directamente proporcionales. 19 20 DISOLUCIONES FORMAS DE EXPRESAR LA CONCENTRACIÓN DE UNA DISOLUCIÓN Una disolución es una mezcla homogénea formada por dos o más componentes. Los términos de disolución diluida y concentrada, aunque se usan con frecuencia, no son indicativos de la composición exacta de la mezcla, solo nos dan una idea subjetiva de la misma. Por ejemplo, una persona puede decir que la sopa está salada y otra que está en su punto. Por eso se emplean otras formas cuantitativas para medir la concentración de una disolución. • • El disolvente es el medio de dispersión y no cambia de estado El soluto es la sustancia que se disuelve Una disolución típica es la de sal o de azúcar en agua. Cuando se echa sal en el agua, las moléculas de agua, que están en continuo movimiento, chocan con las de sal y le van comunicando energía hasta que adquieren la suficiente para romper los enlaces que mantienen unidos los iones al cristal. De esta forma se dispersan, y como los iones son muy pequeños no pueden verse al microscopio, da la impresión de que una disolución es una sustancia pura, aunque no lo es porque la proporción de soluto y disolvente puede variarse y por tanto la mezcla no siempre tendrá las mismas propiedades. Más adelante daremos una explicación detallada del proceso de disolución y de porqué, por ejemplo, la sal común se disuelve en agua y el aceite no. Antes de empezar, y aunque lo creas una tontería, procura tener bien claro que en una disolución hay que distinguir entre tres cosas distintas: Soluto, Disolvente y Disolución (que es la mezcla de ambos). Con mucha frecuencia la dificultad para entender los ejercicios deriva de confundir el concepto de disolvente con el de disolución. La mejor manera de no confundirse es indicando siempre de qué se trata. Por ejemplo: escribe siempre 10 gr de NaCl, o por ejemplo 10 gr de disolución. No te limites a escribir 10 gr que al final no sabrás de qué se trata. % en peso, indica el número de gramos de soluto que hay disueltos en 100 gr de disolución. Por ejemplo, si en 100 gramos de agua disolvemos 5 gr de NaOH la concentración de la disolución no es del 5%, ya que tendríamos 5 gr de NaOH disueltos en 105 gr de disolución CLASIFICACIÓN DE LAS DISOLUCIONES POR EL ESTADO FÍSICO DE SUS COMPONENTES SÓLIDAS Sólido en sólido: Acero (hierro+carbono) Líquido en sólido: Mercurio en plata (amalgama). Gas en sólido: gases absorbidos por carbono activo 5 gr NaOH 105 gr disolución = x 100 gr disolución POR SU CONCENTRACIÓN DISOLUCIÓN DILUIDA: contiene poco soluto disuelto. Ej: a 0 ºC, en 100 g de agua pueden disolverse hasta 37,5 NaCl. Si a esa temperatura disolvemos solo 1gr NaCl en 100g de agua diríamos que la disolución es diluida ⇒ x=4,76 % en peso de NaOH % en volumen, indica el número de cm3 de soluto que hay disueltos en 100 cm3 de disolución. (a veces también se refiere a 100 gr de disolución) Ejemplo 1: Una disolución de ácido sulfúrico tiene una concentración del 80% en peso. a) Indica como está formada la disolución b) Que cantidad de ácido habría en una botella de 0,5 Kg? a) El 80% en peso quiere decir que tiene 80gr de H2SO4 en 100 gramos de disolución, por tanto que la mezcla está formada por 80gr de H2SO4 y 20gr de H2O. LÍQUIDAS Sólido en líquido: Sal en agua Líquido en Líquido: Alcohol en agua Gas en líquido: Oxígeno en agua DISOLUCIÓN CONCENTRADA: Tiene mucho soluto disuelto Ej una disolución que tenga disueltos 36 gr de NaCl en 100 g de agua 0 ºC . GASEOSAS Gas en gas: Oxígeno en nitrógeno. DISOLUCIÓN SATURADA: Es aquella que, a una determinada temperatura, no es capaz de disolver más soluto. Ej una disolución saturada de NaCl es aquella que contiene 37,5 disueltos en 100 g de agua 0 ºC . b) Por simple proporción: 80gr H 2 SO 4 100gr disolución = x 500gr disolución 21 ⇒ x = 400gr H 2 SO 4 gramos por litro (gr/Litro) con ello se quiere indicar el número de gramos de soluto disueltos en 1 litro de disolución. (Si por ejemplo disolvemos 2 gr de NaCl en 1 litro de agua, esa disolución no tendría una concentración de 2 gr/L, ¿porqué?) 22 Ejemplo 3: Cuál es la Molaridad de una disolución que se ha obtenido disolviendo 4 gr de NaCl hasta obtener un volumen de 250 cm3 de disolución. Indica el material necesario y el método de preparación. Cl=35,5; Na=23 Ejemplo 2: Una disolución de ácido sulfúrico tiene una concentración del 80% en peso. Calcular su concentración en gr/L sabiendo que su densidad es 1,75 gr/cm3. La densidad de la disolución nos indica que 1 litro de disolución tiene una masa 1750gr, ahora bien, esos 1750gr son de disolución y no de H2SO4, así que como en el ejercicio anterior, lo que tenemos es que calcular la cantidad de ácido que hay en los 1750 gr: 80gr H 2 SO 4 100gr disolución = x 1750gr disolución ⇒ En primer lugar fíjate en el término exacto que se ha empleado, “hasta obtener un volumen de 250 cm3 de disolución” eso quiere decir que el resultado ha sido 250 cm3 exactos de disolución. Muy distinto sería si se hubiera empleado “en un volumen de 250 cm3 de agua”, ya que en ese caso el resultado final de la mezcla, es decir la disolución, no sería 250 cm3. x = 1400gr H 2 SO 4 así que un litro de esa disolución estaría formado por 1400gr de H2SO4 y 350gr de H2O, y la concentración sería 1400 gr/L. Como puedes ver, si generalizamos el proceso, tendremos que la relación entre la concentración en g/l y el % es: gr / L = densidad ⋅ 1000 ⋅% 100 M= (la densidad en gr/cm3) partes por millón (ppm) con ello se quiere indicar el número de miligramos de soluto disueltos en 1 litro de disolución, por tanto es un concepto similar a los gr/Litro, pero que se emplea cuando las disoluciones son extremadamente diluías, incluso a veces se utiliza el término partes por billón, que sería el número de microgramos por litro. 1ppm = gr / L 10 3 1 ppb = y gr / L 10 6 n º gramos por tanto, la manera más sencilla de calcular la molaridad es: • calcular los moles de soluto y dividirlo por el volumen en litros. • calcular la concentración en gr/L y luego dividir por el Pm. M= gr / L 16 gr / L = = 0,27 mol / l Pm 58,5 gr / mol El procedimiento sería: El problema inverso sería preguntarnos cuantos moles hay en un volumen V de una disolución que tiene una concentración molar M. Simplemente despejando tenemos que: (el Volumen de disolución en litros) (1) Colocamos el vidrio de reloj en la balanza y la taramos a cero. (si no es posible pues se anota su peso en limpio y le sumamos la cantidad a pesar). Una vez que tenemos el vidrio de reloj en la balanza y marcando cero, empezamos a añadir sal, con la ayuda de la cucharita y nunca volcando el bote, hasta que marque la cantidad de 4 gramos. (2) Ahora colocamos el embudo sobre el matraz aforado y volcamos la sal que hemos pesado y con la ayuda del frasco lavador limpiamos el vidrio de reloj sobre el embudo para asegurar de que toda la sal que había se arrastre. y como el nºgramos = nºmoles*Pm : n º gr = M ⋅ VL ⋅ Pm (2) Calculando la concentración en gr/L. Naturalmente, si en 250 cm3 de disolución hay 4 gr de sal, en 1 litro (1000 cm3) habrá 16 gramos. Vidrio de reloj Cucharita Balanza electrónica Embudo Matraz aforado de 250 cm3 Frasco lavador Vaso de precipitados con agua destilada Varilla de vidrio Pipeta o cuentagotas n º moles gr / L = Pm = litro litro Pm n º moles = M ⋅ VL moles NaCl 0,068 moles NaCl = = 0,27 mol / l VL 0,250 L Disolución El material de laboratorio necesario para preparar esa disolución sería: Molaridad (M) es el número de moles de soluto disueltos en 1 litro de disolución. Sus unidades, obviamente serán moles/Litro. Es la forma mas corriente de expresar la concentración en química y como ves es parecida a la de gr/L, pero que en lugar de gramos se refiere a moles. Teniendo en cuenta que nºmoles=nºgr/Pm, la relación entre ambas formas de expresar la concentración es: M= (1) Calculando los moles de soluto y dividirlo por el volumen en litros: molesNaCl = gr/Pm = 4/58,5 = 0,068 moles NaCl (el Volumen de disolución en litros) 23 24 Teniendo en cuenta que: moles=M*VL, que en el agua no hay sal y que el volumen de la mezcla será de 10mL+90mL=100mL MNaCl,pipeta*VL,pipeta + 0 = MNaCl,mezcla*VL,mezcla 0,27*0,010 = M´*0,100 de donde la concentración de la nueva disolución será M´=0,027 mol/L. (3) Ahora vamos echando agua destilada desde el vaso de precipitados y nos ayudamos con una varilla de vidrio. Pegamos el vaso a la varilla dejando que el agua derrame lentamente y de esa forma evitamos salpicaduras. Cuando el matraz aforado está lleno de agua en algo más de la mitad lo agitamos para que se disuelva y continuamos echando agua de la misma forma. (4) Cuando falta poco para llegar al enrase, continuaremos echando agua pero ya con un cuentagotas o una pipeta para no pasarnos. Fíjate que de esta forma la sal ha quedado disuelta exactamente en 250 cm de disolución. Sin embargo si hubiésemos echado la sal en un vaso de precipitados y luego volcado 250 cm3 de agua lo habríamos hecho mal. Normalidad (N) es el número de equivalentes–gramo de soluto disueltos en 1 litro de disolución. Es la preferida de los químicos por lo que más adelante entenderás y como ves es parecida a la de gr/L y a la Molaridad, solo que en este caso en lugar de gramos o moles se refiere a equivalentes por litro. n º gramos N= n º equivalentes gr / L Peq = = litro litro Peq El PesoEquivalente–gramo, o simplemente equivalente, es la cantidad de una sustancia que se combina o que tiene el mismo poder de combinación que 1 gr de hidrógeno. Se obtiene dividiendo la masa atómica o molecular entre la valencia (ν), entendiéndose por tal: ν Valencia de combinación Recuerda que una de las claves de un buen químico es que trabaja cuidadosamente y no se mancha, ni llena nada y mantiene el material limpio y ordenado. Piensa que se trabaja con muchas sustancias y algunas son muy peligrosas. Ejemplo 4: Imagina que tenemos una disolución de cloruro sódico de una concentración 0,27M, como la que acabamos de preparar. Si con la ayuda de una pipeta tomamos 10 cm3 y los vertemos en un vaso de precipitados que contiene 90 cm3 de agua destilada, ¿cuál será la concentración de la nueva disolución? Elemento Valencia Ion Carga del ion Ácido Número de hidrógenos sustituibles Hidróxido Sal Reac.Redox P.eq = 40 2 Pm ν = 20 Ca 2 Cu2+ 2 H2SO4 2 98 2 = 49 Número de OH del hidróxido Al(OH)3 3 78 2 = 26 Número de átomos del metal por su valencia Fe2(SO4)3 6 399 ,6 6 = 66 ,6 Número de electrones que gana o pierde Cu →Cu 1 63 ,5 1 = 63,5 2+ + 63 ,5 2 = 31,75 Teniendo en cuenta que nºEq=Pm/ν, la relación entre la Normalidad y las otras formas de expresar la concentración es: ν n º eq Peq = = Pm / ν = Pm = M⋅ν Litro Litro Litro Litro n º gramos N= Obviamente, la disolución resultante será mucho más diluida, pero una cosa es segura: tendrá la misma cantidad de sal que hay en los 10 cm3 de la disolución original que hay en la pipeta, ya que solo le hemos añadido agua destilada y en el agua no hay sal. Dicho de otra forma: molesNaCl en la pipeta + molesNaCl en el vaso de agua = molesNaCl en la mezcla final 25 n º gramos n º gramos la manera mas sencilla de calcular la normalidad es calcular el nº de equivalentes y dividirlo por el volumen en litros, o bien, calcular la concentración en gr/L y luego dividir por el Peq, o bien si se conoce la molaridad multiplicarla por la valencia de la sustancia. La Normalidad siempre es igual o un múltiplo entero de veces mayor que la Molaridad. Sus unidades, obviamente serán equivalente/litro El problema inverso sería preguntarnos cuantos equivalentes hay en un volumen V de una disolución que tiene una concentración normal N. 26 n º eq = N ⋅ VL Una disolución 1 molal de á. sulfúrico tiene una densidad e 1,51 gr/cm3 ¿Cuál es la concentración molar y normal de la disolución? (el Volumen de disolución en L) y como el nºgramos = nºEquivalentes*Peq : n º gr = N ⋅ VL ⋅ Peq Siempre lo que interesa es calcular la concentración en gr/Litro: (el Volumen de disolución en L) Ejemplo 5: Se desea preparar 300 cm3 de una disolución de FeCl3 0,5N. Calcular la cantidad de sal que hay que pesar. Cl=35,5, Fe=55,8 Pm FeCl 3 = 54,1gr / eq 3 n º gr = N ⋅ VL ⋅ Peq = 0,5 ⋅ 0,300 ⋅ 54,1 = 8,1gr de FeCl3 Pm FeCl 3 = 162,3gr / mol Peq FeCl 3 = de donde Después de pesar lo 8, 1 gr de FeCl3 le añadiremos agua destilada hasta obtener los 300cm3 de disolución. Ejemplo 6: Cuál será la Molaridad y la Normalidad de una disolución de hidróxido amónico que tiene una densidad de 0,9 gr/cm3 y una concentración del 28,33% en peso. Si multiplicamos por 1000 la densidad obtendremos que la masa de 1 litro de disolución es 900 gr. Ahora resulta recuerda que el 28,33% en peso quiere decir que tiene 28,33gr de soluto en 100 gramos de disolución, y por simple proporción podemos calcular los gramos que hay en los 900 gr de disolución, es decir en un litro de disolución: 28,33gr NH 4 OH 100gr disolución = x 900gr disolución(1litro) ⇒ x = 254,9gr / litro NH 4 OH (al mimo resultado habríamos llegado aplicando que gr / L = densidad ⋅1000⋅% 100 ). Ahora: gr / L 254,9 = = 7,28 mol / L Pm 35 gr / L 254,9 N= = = 7,28 eq / L Peq 35 / 1 y ahora: gr / L M gr / L Pm ⇒ m= m= y como M = ρ1000 − gr / L ρ1000 − gr / L Pm 1000 1000 x 98 ⇒ m=134,78 gr/L 1= 1510 − x 1000 M= gr / L 134,78 = = 1,37 mol / L Pm 98 y N= gr / L 134,78 = = 2,75 eq / L Peq 98 / 2 Ejemplo 8: Una disolución 0,5M de a. sulfúrico tienen una densidad de 1,32 gr/cm3 ¿Qué molalidad y normalidad tendrá? M= gr / L Pm m= M 0,5 = = 0,39 moles / Kg disolvente ρ1000 − gr / L 1320 − 49 1000 1000 N= gr / L 49 = = 1eq / L o bien N = M ⋅ ν = 0,5 ⋅ 2 = 1eq / L Peq 98 / 2 ⇒ gr / L = 0,5 ⋅ 98 = 49 gr / L y ahora M= Fracción molar (x) la fracción molar de un componente A de una mezcla se define como el número de moles de ese componente dividido por el número de moles totales de la mezcla. Así podemos definir una fracción molar para el soluto (xs) y otra para el disolvente (xd) de la forma: Molalidad (m) es el número de moles de soluto disueltos en 1 Kilogramo de disolvente. Esta forma difiere bastante de la Molaridad aunque el nombre sea similar. Fíjate que se refiere a los moles que hay disueltos en 1 Kg (no en 1 litro) y de disolvente (no de disolución). Si la densidad de la disolución es ρ (en gr/cm3) si la multiplicamos por 1000 tendremos la masa de 1 litro de disolución. Si ahora restamos los gr/L de soluto que hay disueltos nos quedará exclusivamente los gramos que son de disolvente. Y si los gramos de disolvente los dividimos entre 1000 habremos pasado a Kg de disolvente, así que: xs = Ms n º moles soluto = n º moles total Ms + Md xd = Md n º moles disolvente = n º moles total Ms + Md La suma de las fracciones molares, obviamente es igual a la unidad: xs+ xd=1 n º moles M m= = Kg disolvente ρ1000 − gr / L 1000 Ejemplo 7: 27 28 Ejemplo 9: Si disolvemos una cucharada de 25 gr de azúcar en 300 gr de agua, calcular la concentración de la disolución expresada en % en peso y calcular la fracción molar de azúcar. El azúcar tiene la fórmula C12H22O11 y un Pm=342gr/mol ECUACIONES QUÍMICAS Ya hemos visto, al estudiar la teoría atómica de Dalton, que los átomos no pueden crearse ni destruirse, y por tanto, en una reacción química los átomos de los reactivos simplemente se reorganizan y dan lugar a unos productos en los que hay los mismos átomos, aunque unidos de otra forma. Teniendo en cuenta que la disolución resultante tendrá una masa de 325 gr, para saber la cantidad de azúcar en 100 gr de disolución, establecemos la siguiente proporción: 25gr azúcar 325gr disolución = x 100gr disolución Eso quiere decir que para escribir correctamente una ecuación química no basta con escribir los reactivos y los productos, sino que además debemos introducir unos coeficientes para ajustarlas, de manera que haya el mismo número de átomos a ambos lados de la ecuación. Por ejemplo, en la formación del agua: x = 6,79% de azúcar ⇒ La fracción molar, recordando que el nºmoles=nºgr/Pm: xs = n º moles soluto = n º moles total 25 342 25 342 + 300 18 H2 + = 4,37 ⋅ 10 −3 2 H2 + O 2 → 2 H 2 O Más adelante veremos los métodos para ajustar reacciones redox, que suelen ser más complejas, pero las reacciones ordinarias se ajustan simplemente probando por tanteo como cuando se hace un puzle. De todas formas se pueden dar algunas orientaciones: • M= N= ρ ⋅ 1000 ⋅% 1980 ⋅ 96 = 1900,8 gr / L = 100 100 • • gr / L 1900,8 = = 19,4 mol / L Pm 98,08 gr / L 1900,8 = = 38,8 eq / L Peq 98,08 / 2 xs = Los coeficientes siempre van delante de la fórmula e indican el número de moléculas (o de moles) que reaccionan o se forman, pero nunca se pueden modificar los subíndices que forman parte de la fórmula porque la romperían. Ajusta primero los elementos que aparecen en 1 reactivo y en 1 producto En muchas ocasiones aparecen grupos de átomos que no varían y por tanto debes tratarlos como si se tratara de un elemento. Por ejemplo el ion sulfato SO42–, el nitrato NO3– , etc 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 Los coeficientes de la reacción, una vez ajustada, indican la proporción en que reaccionan los reactivos y se forman los productos, así que podemos leer que 2 átomos de aluminio reaccionan con 3 moléculas de sulfúrico y dan lugar a 1 molécula de sulfato de aluminio y 3 moléculas de hidrógeno. Igualmente podríamos decir que 2 docenas de átomos de aluminio reaccionan con 3 docenas de moléculas de sulfúrico … O bien podemos decir que los coeficientes nos están indicando el número de moles que reaccionan y se forman, así debemos leer que 2 moles de aluminio reaccionan con 3 moles de sulfúrico y dan 1 mol de sulfato de aluminio y 3 moles de hidrógeno. La densidad de la disolución (ten en cuenta que lo que hay en la botella no es sulfúrico, sino una disolución de sulfúrico, muy concentrada, pero una disolución) nos dice que 1 litro de disolución tiene una masa de 1980 gr , de los cuales 1900,8 gr son de ácido, así que el resto es el disolvente: 79,8 gr que serían de agua. Así que: m= O2 → H2 O Como suelen escribirse los coeficientes como números enteros, simplemente multiplicamos toda la ecuación por 2: Ejemplo 10: En la etiqueta de una botella de ácido sulfúrico concentrado pueden leerse los siguientes datos: Pureza = 96%, Pm =98,08 gr/mol, densidad = 1,98 gr/cm3. Expresar la concentración del ácido en gr/L, M, N, m y fracción molar. gr / L = 1 2 n º moles 19,4 moles / L = = 243,1mol / Kg disolvente Kg disolvente 0,0798 Kg disolvente / L Evidentemente podemos aplicarle las equivalencias con el mol que ya hemos estudiado, así podemos poner que: Ms 19,4 = = 0,81 M s + M d 19,4 + 7918,8 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 2 moles Al –––– 3 moles H2SO4 ––– 1 mol Al2(SO4)3 ––– 3 moles H2 2*27 gr Al –––– 3*98 gr H2SO4 ––– 342 gr Al2(SO4)3 –– 3*2gr H2 2*6,023.1023 átom Al ––– 3*6,023.1023 moléculas H2SO4 ––– 6,023.1023 moléculas Al2(SO4)3 – 3*6,023.1023 moléculas H2 3*22,4 litros H2 medidos en C.N 29 30 Al mismo resultado habríamos llegado si procedemos como en el Ejemplo 1 y ahora aplicamos la ecuación general de los gases perfectos: Podemos establecer una proporción entre cualquiera de los compuestos en términos de moles, masa y volúmenes molares, pero cuidando siempre que arriba y abajo haya las mismas unidades: moles y moles; gr y gr o L en CN y L en CN Los pasos son: • Lee el enunciado muy bien hasta comprenderlo • Escribe y ajusta la reacción. • Subraya los compuestos entre los que debes hacer la proporción • Escribe bajo cada fórmula la cantidad en los términos (moles, masa o volumen molar) que te indique el problema. Como norma general: Si nos dan o piden gramos utilizaremos la masa molecular Si nos dan o piden el volumen de un gas medido en CN, pondremos 22,4 L En el resto de los casos utilizaremos la relación en moles. Por ejemplo: o Si nos dan el volumen de un gas a 1,5 atm y 25 ºC. Mediante la ecuación de los gases perfectos PV=nRT calculamos el número de moles y luego establecemos la proporción. o Si nos dan el volumen de una disolución de concentración M. Calculamos el número de moles=M.VL y luego establecemos la proporción. • Establece la proporción (regla de tres) y ya está. PV = nRT • Como de la reacción, una vez ajustada, se deduce que de dos moles de aluminio (2*27gr de Al) se obtienen 3 moles de hidrógeno (3*2gr de H2) Calcular el número moles de hidrógeno (o bien de gramos de hidrógeno) y luego, mediante la ecuación de los gases perfectos, calcular el volumen que esos gramos ocupan en las condiciones que nos digan. Exactamente como se ha hecho antes, claro que poniendo P=740/760 atm. y T=(273+27) ºK ⇒ 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 2*27 gr Al –––––––––––––––– 3*2 gr H2 6 gr Al –––––––––––––––– x gr H2 → x = 0,667 gr H2 PV T = P´V´ T´ • 740 V = 0,333 ⋅ 0,082 ⋅ (273 + 27) 760 → n=0,333 moles H2 ⇒ V=8,413 L Otra opción es calcular el volumen que ocupa el gas en CN y luego aplicando la ecuación de los gases perfectos calcular el nuevo volumen en las nuevas condiciones, que es lo que vamos a hacer ahora: P=1 atm V=0,49 l T=0ºC=273ºK 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 2*27 gr Al –––––––––––––––– 3*22,4 L H2 en CN 6 gr Al –––––––––––––––– V L H2 en CN 0,667 0,082 ⋅ 273 2 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 2*27 gr Al –––––––––––––––– 3 moles H2 6 gr Al –––––––––––––––– n moles H2 • a) Del enunciado se deduce que la proporción hemos de hacerla en términos de masa y de volumen molar: de dos moles de aluminio (2*27gr de Al) se obtienen 2 moles de hidrógeno, que al tratarse de un gas ocupan (2*22,4 litros de H medidos en CN) 1⋅ V = ⇒ b) Cuando nos pregunten por el volumen de un gas y esté medido en unas condiciones que no sean las CN, ya no podemos establecer la proporción directamente como hemos hecho antes porque no sabemos el volumen que ocupa un mol de gas en todas las condiciones posibles, así que no nos queda otra opción que: y como PV=nRT Ejemplo 2: Calcular el volumen de hidrógeno, medido en CN, que se obtiene al tratar 6 gr de aluminio con ácido sulfúrico en exceso. ¿Qué volumen de hidrógeno se obtendría si se midiera a 27ºC y 740 mmHg? m RT Pm de donde V = 7,467 litros de hidrógeno medidos en CN Ejemplo 1: Calcular los gramos de hidrógeno que se obtienen al tratar 6 gr de aluminio con ácido sulfúrico en exceso. Al=27, S=32, O=16, H=1 Fíjate que en el enunciado te dice que hay ácido sulfúrico en exceso, lo que quiere decir que la reacción tendrá lugar hasta gastar todo el aluminio, y así sabemos que habrán reaccionado exactamente los 6 gr de Al. PV = ⇒ ⇒ P´=740 mmHg= 740 760 atm V´ T´=27+273ºK 1 ⋅ 7,467 273 = 740 (273 + 27) 760 ⋅ V´ ⇒ V´=8,413 L Otra opción, similar a la primera, sería calcular los gramos de H2 obtenidos y luego, mediante la ecuación de los gases, el volumen que esos gramos ocupan en las condiciones del problema Como ves los ejercicios son muy sencillos y cualquier complicación se reduce a enganchar unos conceptos con otros de manera que un ejercicio difícil no es más que varios sencillos encadenados y debes desarrollar la habilidad para descomponerlo. de donde VCN = 7,467 litros de hidrógeno medidos en CN 31 32 • Ejemplo 2: Calcular: a) Los gramos de ácido sulfúrico que reacciona con 6 gr de aluminio. b) El volumen de ácido sulfúrico 4M que reacciona con 6 gr de aluminio • a) Como nos piden gramos de H2SO4, Para tener las mismas unidades utilizaremos masa molecular del H2SO4. 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 2*27 gr Al ––– 3*98 gr H2SO4 6 gr Al –––– x gr H2SO4 → x = 32,667 gr H2SO4 • b) Ahora nos piden nos piden volumen V de H2SO4 4M que reacciona. Para tener las mismas unidades en este caso utilizaremos moles (Recuerda que moles=M*V) • 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 2*27 gr Al −−−− 3 moles H2SO4 → V = 0,083 L H2SO4 4M 6 gr Al –––– 4*V moles H2SO4 moles = M*VL Al caer las primeras gotas de ácido, reaccionarán gastando base, y en el erlenmeyer además del agua habrá: el NaCl que se ha formado, el NaOH que ha quedado sin reaccionar y nada de HCl. Como hay NaOH seguirá de color rosa. Llegará una gota de HCl que sea la que gasta todo el NaOH. En ese momento hemos neutralizado a la base. En el erlenmeyer además del agua habrá: el NaCl que se ha formado, nada de NaOH porque ha reaccionado todo y nada de HCl. Como ahora no hay NaOH el indicador vira de color y así nos indica que hemos completado la neutralización. Cerramos la llave de la bureta y medimos la cantidad de ácido que hemos gastado, en este caso 25 cm3. (La bureta tienen el cero arriba y está numerada hacia abajo, por lo que simplemente hay que anotar el número que marca.) Si continuásemos vertiendo ácido en el erlenmeyer habrá la misma cantidad de NaCl, puesto que ya no se forma más, y el HCl que echemos, que estaría en exceso. En primer lugar debemos calcular la cantidad real de hidróxido sódico que hemos tomado, ya que los 2 gramos que hemos pesado tienen una pureza del 80%. grNaHO Puro = Ejemplo 4: Para calcular la molaridad de una disolución de ácido clorhídrico se pesan 2 gr de hidróxido sódico de una pureza del 80 % y se disuelven en agua con unas gotas de indicador. En una bureta se coloca la disolución de clorhídrico y se deja caer gota a gota hasta que el indicador puesto en la disolución de hidróxido sódico cambia de color. En ese momento se mide el volumen de ácido consumido siendo de 25 cm3. A la reacción que tiene lugar entre un ácido y una base se llama de neutralización y el resultado siempre es una sal y agua. • • El compuesto que deseamos valorar, en este caso el ácido, se ha colocado en la bureta y se llena hasta que marque el cero. En un erlenmeyer o en vaso de precipitados se coloca el otro compuesto, en este caso la base, con unas gotas de indicador. (Los indicadores son sustancias que tienen la propiedad de tener un color diferente según que el medio sea ácido o básico. Por ejemplo la fenolftaleína es de color rosa en medio básico y transparente en medio ácido) 2 ⋅ 80 = 1,6 gr NaOH puro 100 Ahora vamos a calcular la cantidad de ácido que reacciona con esa cantidad de base. Como se trata de una disolución de HCl haremos la proporción sobre moles, teniendo en cuenta que los moles de ácido que hay en un volumen V (en litros) es: moles=M.VL HCl + NaOH → NaCl + H2O 1 mol HCl –––– 40 gr NaOH M*0,025 moles HCl –– 1,6 gr NaOH moles=M.VL de donde M = 1,6 molesHCl/LDisolución o simplemente M=1,6Molar Podríamos resolver el ejercicio de otras formas, por ejemplo, calculando el número de gramos de clorhídrico que han reaccionado con esos 1,6 gr de NaOH y luego, sabiendo el volumen en que se encuentran calcular la concentración de la disolución: HCl + NaOH → NaCl + H2O 36,5gr HCl –– 40gr NaOH x –––––– 1,6gr NaOH de donde x = 1,46 gr HCl. Ahora es como un problema simple de disoluciones que dijera: “Calcula la molaridad de una disolución de HCl que se ha obtenido disolviendo 1,46 gr de HCl hasta tener 25 cm3 de disolución”. Empezamos calculando la concentración en gr/L. Naturalmente, si en 25 cm3 de disolución hay 1,46 gr de HCl, en 1 litro (1000 cm3) habrá: 1,46gr HCl 25cm 3 disolución = x 1000cm 3 disolución HCl + NaOH → NaCl + H2O de donde x=58,4 gr/L. Teniendo en cuenta que el PmHCl = 36,5 gr/mol: 33 34 Ejemplo 6: Para averiguar la pureza en carbonato de calcio de una caliza se pesan 2 gr de caliza (CaCO3 + impurezas) y se tratan con ácido clorhídrico en exceso, obteniéndose 0,4 litros de dióxido de carbono medidos en las condiciones del laboratorio (27º y 1 atm) gr / l 58,4 gr / l M= = = 1,6 mol / l Pm 36,5 gr / mol Ejemplo 5: Cuando se hacen reaccionar 10 gr de hidróxido sódico con 80 mL de H2SO4 1M se obtiene sulfato de sodio y agua. Calcular: a) los gramos de Na2SO4 que se obtendrán. b) los gramos de reactivo que quedan sin reaccionar La reacción es Se colocan los 2 gr de caliza en un erlenmeyer y se va dejando gotear el clorhídrico. Como el dióxido de carbono que se forma en la reacción es un gas se escapa y lo recogemos sobre agua, en una bureta, realizando un montaje como el de la figura: 2 NaOH + H2SO4 → Na2SO4 + 2 H2O Como vemos en la estequiometria de la reacción, 2 moles de NaOH reaccionan con 1 mol de H2SO4. Quiere decir que las reacciones tienen lugar entre una proporción exacta de los reactivos, de manera que si ponemos a reaccionar una cantidad cualquiera de NaOH (en este caso 10g) con una cantidad cualquiera de H2SO4 (en este caso 80 mL de ácido 1M) la reacción transcurrirá hasta que se gaste uno de los dos reactivos. Al reactivo que está en menor proporción se le llama reactivo limitante, porque cuando se agota la reacción termina y quedará una cierta cantidad "sin reaccionar" del reactivo que estaba en mayor proporción. 2 HCl + CaCO3 → CaCl2 + CO2 + H2O Así pues, la cantidad de Na2SO4 formada viene determinada por la cantidad de reactivo que está en menor proporción. Lo primero que tenemos que hacer es averiguar los moles de CO2 obtenidos. Para ello utilizamos la ecuación de los gases perfectos: Vamos a poner en moles la cantidad inicial de cada reactivo para poder saber quien actuará de reactivo limitante. PV=nRT molesNaOH = gr/Pm = 10/40 = 0,25 moles NaOH molesH2SO4 = M*VL = 1*0,080 = 0,08 moles H2SO4 Como 2 moles de NaOH reaccionan con 1 mol de H2SO4 está claro que 0,25 moles de NaOH necesitarían para reaccionar la mitad de sulfúrico, es decir, 0,125. Como solamente hemos puesto 0,08 moles de H2SO4 está claro que es insuficiente y que la reacción finalizará cuando se gasten esos 0,08 moles de sulfúrico. En consecuencia el H2SO4 es el reactivo limitante y con él debemos hacer las cuentas. Entonces: 2 NaOH + H2SO4 → Na2SO4 + 2 H2O 1 mol H2SO4 −−− 142 gr Na2SO4 0,08 moles H2SO4 −− x gr Na2SO4 → x = 11,36 g Na2SO4 b) De la reacción se deduce que los 0,08 moles de H2SO4 han necesitado para reaccionar el doble de NaOH, es decir, 0,16 moles de NaOH. Por tanto han quedado sin reaccionar 0,25moles−0,16moles = 0,09 moles de NaOH, que expresado en gramos sería: grNaOH Sin Reaccionar = moles*Pm = 0,09*40 = 3,6 g NaOH en exceso ⇒ 1 ⋅ 0,4 = n ⋅ 0,082 ⋅ (273 + 27) Con frecuencia se confunden los gramos de muestra con los gramos de CaCO3 a pesar que son cosas muy distintas. Piensa que lo que hace que se obtengan 0,4L CO2 (a 27º y 1atm) [o bien 0,016 moles] es una determinada cantidad de CaCO3. Ni más ni menos. Si a "esa cantidad de CaCO3 necesaria" le acompaña una cierta cantidad de impurezas tendremos una muestra con más o menos masa, pero siempre deberá tener exactamente esa cantidad de CaCO3 necesaria para poder formar los 0,016 moles de CO2. La cantidad CaCO3 de puro necesaria para obtener a 0,016 moles de CO2 se calcula como siempre a partir de la reacción: 2 HCl + CaCO3 → CaCl2 + CO2 + H2O 100 gr CaCO3 ––––– 1 mol CO2 x gr CaCO3 –––– 0,016 moles CO2 → x = 1,6 gr de CaCO3 Quiere decir que en los 2 gr de caliza había 1,6 gr de CaCO3 y el resto eran impurezas, así que la pureza en carbonato de calcio de la caliza será: pureza = 35 ⇒ n=0,016 moles CO2 1,6gr CaCO 3 ⋅ 100 = 80 % 2gr caliza 36 TEMA 2 MODELOS ATÓMICOS ESTRUCTURA ATÓMICA Y CLASIFICACIÓN DE LOS ELEMENTOS Hasta finales del siglo XIX, con la teoría atómica de Dalton y la hipótesis de Avogadro podía explicarse el átomo y su comportamiento en las reacciones químicas, pero diversos experimentos han ido mostrando como los átomos están formados por diversas partículas y que por lo tanto no son indivisibles como decía Dalton. Modelos atómicos El electrón. Modelo atómico de Thomson Modelo atómico de Rutherford Partículas fundamentales. Conceptos previos EL ELECTRÓN. MODELO ATÓMICO DE THOMSON Número atómico (Z) Número másico (A) Isótopos Masa atómica A finales del sigo XIX Geissler y Crooker realizaron varios experimentos en tubos llenos con diversos gases a muy baja presión (muy similares a los fluorescentes actuales), observando que conducían la corriente cuando se sometían a voltajes elevados. Espectros discontinuos. niveles de energía en los átomos Espectros de emisión Espectros de absorción. Hipótesis de Planck Modelo atómico de Bohr Modelo atómico de Sommerfeld. numero cuántico secundario Hipótesis de De Broglie Principio de incertidumbre de Heisenberg Determinismo y probabilidad Números cuánticos Orbitales atómicos Distribución de electrones. Configuración electrónica Inicialmente se les llamó rayos catódicos porque parecían salir del cátodo (polo negativo) y posteriormente Stoney los bautizó con el nombre de electrones. Tenían las siguiente propiedades: • • • Principio de excusión de Pauli Principio de máxima multiplicidad de Hund Configuración electrónica • • LA TABLA PERIÓDICA Propiedades periódicas Salen perpendicularmente del cátodo y se mueven en línea recta en ausencia de campos eléctricos y magnéticos Los campos eléctricos y magnéticos los desvían, probando que tienen carga eléctrica negativa. Son capaces de mover las aspas de un molinete de mica si se ponen en su camino, lo que prueba que son corpúsculos con masa Cuando chocan con algunas sustancias provocan su luminiscencia y producen calor, porque su energía cinética se transforma en energía térmica. Impresionan las películas fotográficas Thomson estudió los electrones en un tubo de vacío, precursor del tubo de televisión, que estaba formado por un filamento que, al calentarse con un circuito auxiliar, emite electrones por efecto termoiónico. Los electrones emitidos se aceleran hacia un ánodo perforado mediante una gran ddp y se hacen chocar sobre una pantalla de sulfuro de cinc o cualquier otra sustancia fluorescente. 1. Radio atómico y volumen atómico 2. Radio iónico 3. Energía de Ionización 4. Afinidad Electrónica 5. Electronegatividad. 6. Valencia. 37 38 Thomson, haciendo que no se desviaran al atravesar un campo eléctrico y otro magnético perpendicular, consiguió medir la relación entre la carga y la masa del electrón, por lo que recibió el premio Nóbel de física. Posteriormente Millikan (también Nóbel de física), en su famoso experimento de la gota de aceite (consiste en suspender en un campo eléctrico una gota de aceite previamente cargada) consiguió medir la carga del electrón y con ello calcular su masa. Así resulta que e = 1,6 ⋅ 10 −19 C y me = 9,1 ⋅ 10 −31 Kg Modelo atómico de Thomson: Este supuso que, puesto que en el tubo se había practicado el vacío, los electrones debían provenir de los átomos del cátodo. En consecuencia los átomos no son indivisibles como decía Dalton ya que, al menos están formados por electrones y algo más bastante más pesado, puesto que la masa de los electrones es muy pequeña. • • • Casi todas las partículas atraviesan la lámina de oro sin desviarse Algunas pocas de desvían Algunas, muy pocas, rebotan que es lo más sorprendente. Lo primero que se deduce es que el átomo está prácticamente hueco y por eso la mayoría de las partículas α lo atraviesan sin desviarse. Debe tener una zona maciza muy pequeña cargada positivamente que es la que desvía a las partículas α (que también son positivas) y debe ser muy pequeña porque solamente unas pocas son las chocan con ella y rebotan. Puesto que los átomos son neutros, ese “algo más” debe tener carga positiva para compensar a la negativa de los electrones. Thomson, en una carta a un amigo suyo, hacía este mismo razonamiento y le decía que “los átomos deberían ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones, de la misma forma que las pasas en un bizcocho”. Por ese motivo a este modelo se conoce también como el pastel de pasas. Rutherford elaboró un nuevo modelo para el átomo para explicar los resultados de su experimento, diciendo: • • • MODELO DE RUTHERFORD Becquerel había descubierto a final del XIX que ciertos elementos inestables, a los que se les llamó radiactivos, trataban de estabilizarse emitiendo partículas α. β y radiación γ. Rutherford y su ayudante Geiger estudiaban la naturaleza de las partículas α haciéndolas incidir sobre una lámina muy delgada de oro y recogiéndolas sobre una pantalla fluorescente de sulfuro de cinc. • El átomo está formado por dos partes: núcleo y corteza. El núcleo es la parte central, de tamaño muy pequeño, donde se encuentra toda la carga positiva y, prácticamente, toda la masa del átomo, es decir los protones y neutrones Girando, a gran distancia, se encuentran los electrones, que deben girar para que la fuerza centrífuga compense a la atracción eléctrica, de forma parecida al movimiento de los planetas, donde la fuerza centrífuga compensa al peso. (Como del núcleo a la corteza hay un espacio vacío muy grande, eso explicaría que la mayor parte de las partículas alfa atraviesan la lámina de oro sin desviarse.) En un átomo en estado normal, al ser neutro, tiene el mismo numero de protones (+) en el núcleo que de electrones (−) en la corteza. Rutherford descubrió los protones bombardeando nitrógeno con partículas α y puesto que los protones tienen carga positiva, y en consecuencia deberían repelerse, Rutherford postuló la existencia de otra partícula de masa similar que sería la responsable de darle estabilidad. Años después Chadwick descubrió el neutrón y muchos años después Yukawa dio la primera explicación de la estabilidad de los núcleos. Lo que observaron es que: 39 40 De acuerdo con la idea de Rutherford, el átomo de hidrógeno está formado por un protón en el núcleo y un electrón girando a su alrededor a una distancia r, de tal manera que la fuerza de atracción eléctrica se compense con la fuerza centrífuga (SR Inercial) PARTÍCULAS FUNDAMENTALES. CONCEPTOS PREVIOS De acuerdo con lo anterior, en un átomo hay tres partículas fundamentales: protones y neutrones, (a los que se llama indistintamente con el nombre de nucleones porque están en el núcleo), y electrones en la corteza. Tienen las siguientes características: protón neutrón electrón Felectr = Fcentrif ⇒ K Ke 2 mr r= Ke 2 mv 2 Masa (Kg) 1,007597 1,008982 0,000549 1,67.10−27 1,67.10−27 9,1.10−31 Masa referida al eletrón 1836 1838 1 Carga (C) +1,6.10−19 0 −1,6.10−19 Carga referida al electrón +1 0 −1 Hoy día sabemos que de las tres partículas elementales que inicialmente se pensaba que formaban los átomos, solamente lo es el electrón. Los protones y neutrones a su vez están formados de otras partículas elementales llamadas quarks. e2 v2 =m 2 r r de donde se puede despejar el radio de la órbita o bien la velocidad con la que debe girar para mantenerse: v= Masa (uma) Número atómico (Z): Es el número de protones de un núcleo y es el que nos define al elemento químico. (Un átomo en estado normal tiene igual número de protones y electrones. Si pierde o gana electrones se convierte en un ión positivo o negativo del mismo elemento, pero si perdiera o ganada un protón se transformaría en otro elemento distinto, el anterior o posterior en la tabla periódica.) Número másico (A): Es el número de protones y neutrones, es decir el número de nucleones. Como vemos, en el modelo de Rutherford cualquier radio es aceptable con tal que de gire con la velocidad adecuada, con lo que los espectros atómicos deberían ser continuos. La energía del electrón en la órbita, que será la suma de la cinética más la potencial (la Ep es negativa porque las cargas del electrón y del protón tienen distinto signo: q=e y q´=−e) 1 e2 E = Ec + Ep = mv 2 − K 2 r sustituyendo v 2 De acuerdo con esto, es evidente que el número de neutrones de un núcleo será: N = Z−A Lo núcleos se representan con el símbolo del elemento y un número en la parte inferior que indica el número atómico (que es informativo, porque realmente es redundante) y otro número en la parte superior que indica su masa: A Z 1 Ke 2 e 2 1 Ke 2 Ke 2 1 Ke 2 E = m −K = − =− 2 mr r 2 r r 2 r X Z XA X AZ Isótopos: Son aquellos núcleos que tienen el mismo número de protones, y por tanto definen al mismo elemento, pero difieren en el número de neutrones y por tanto tienen distinta masa. Tienen igual Z y distinto A. El hidrógeno tiene tres isótopos: La energía del electrón es función del radio de la órbita y aumenta con la distancia hasta hacerse cero en el infinito (ten en cuenta que es negativa, lo que indica que una carga negativa está ligada a una positiva. Lo mismo que ocurre entre las masas). Al modelo de Rutherford pronto se le encontraron dos fallos importantes: • • Si el electrón que es una carga gira debería radiar energía en forma de ondas electromagnéticas y por tanto iría perdiendo energía hasta caer en el núcleo. Puesto que todos los radios son posibles no explica que los electrones salten de unos niveles a otros y en consecuencia no puede explicar las rayas espectrales. Es importante recordar que las propiedades químicas de los elementos vienen determinadas por la disposición de los electrones de la última capa, así pues todos los isótopos de un elemento se comportan químicamente igual y en este aspecto son 41 42 indistinguibles. Sin embargo tienen distintas propiedades físicas, empezando porque tienen distinta masa y porque no todos tienen la misma estabilidad. Ejemplo 1: Un isótopo del oxígeno tiene número de masa igual a 18. ¿Cuántos protones, neutrones y electrones tiene? ¿Y el ion O−2 de ese isótopo? Pat Ag = 107 ⋅ 56 109 ⋅ 44 + = 107,88 100 100 las unidades, son uma/átomo o bien gr/mol ESPECTROS DISCONTINUOS. NIVELES DE ENERGÍA EN LOS ÁTOMOS Al tratarse de oxígeno su número atómico no puede ser otro que Z=8 ya que, como hemos dicho, el número atómico es el número de protones y define al elemento y viceversa. Como A=18 y corresponde a la suma de protones y neutrones: Protones Neutrones Electrones =Z=8 = A – Z = 18 – 8 = 10 = nº Protones si es neutro = 8 El ion del oxígeno tiene su núcleo exactamente igual, es decir 8 protones y 10 neutrones, pero su carga eléctrica no es nula, sino que tiene dos cargas negativas, es decir que tienen 2 electrones de más, y por tanto 8 + 2 =10 e−. Masa atómica: Ya hemos visto que la mayoría de los elementos tienen varios isótopos en proporción prácticamente estable, por eso la masa atómica que se tabula se calcula haciendo la media ponderada de las masas de los isótopos según su abundancia relativa. Ya sabemos que cuando la luz blanca se hace pasar a través de un prisma se descompone dando lugar a un espectro que contiene la totalidad de los colores desde el rojo al violeta, por lo que se llama espectro continuo, mientras que si solo hay unos pocos se llama espectro discontinuo. Ese fenómeno, llamado dispersión de la luz, se debe a que las distintas radiaciones que componen la luz, aunque todas tienen la misma velocidad en el vacío, tienen distinta velocidad cuando viajan a través de otro medio, por ejemplo del vidrio, de manera que las radiaciones de menor longitud de onda se desvían más y por eso se separan. Las ondas electromagnéticas (OEM) son ondas transversales que no necesitan un medio material para propagarse. Se dividen en varios grupos según su frecuencia (o según su λ longitud de onda, ya que ambas están relacionadas por la velocidad de la luz c = ) ν Ejemplo: 2 Se tienen los elementos a) Isótopos b) Isoeléctrónicos 228 90 X, 234 90 Y, 234 91 Z, 234 92 Q, 234 94 R +3 , razona cuales de ellos son: a) Isótopos son aquellos núcleos que tienen el mismo número de protones, y por tanto definen al mismo elemento, pero difieren en el número de neutrones y por tanto tienen distinta masa, y de acuerdo en ello X e Y son isótopos al tener 90 protones y diferente número de nucleones. b) Isoeléctrónicos son aquellos átomos que tienen el mismo número de electrones, por tanto átomos en estado fundamental de distintos elementos nunca serán isoelectrónicos, pero sí pueden serlo sus iones. X e Y son isoelectrónicos porque son neutros y corresponden al mismo elemento. Por otro lado, el átomo R al perder 3 electrones para convertirse en su ión 3+ se queda solo con 91 electrones y en consecuencia es isoelectrónico con Z. Como puedes ver, las OEM de menor frecuencia, es decir de menor energía son las ondas de radio y las de mayor los rayos gamma. También puedes observar como hay una pequeña parte del espectro electromagnético que podemos detectar mediante el ojo. A esa zona se le llama visible y según la frecuencia de la OEM la vemos de un color u otro, de manera que realmente la diferencia entre una onda de radio, el color verde y un rayo X es simplemente su frecuencia. Un espectro de emisión es el espectro de la luz que emite un cuerpo, mientras que si hacemos pasar la luz blanca a través del cuerpo y analizamos la luz que deja pasar, el espectro se llama de absorción. Ambos son complementarios, quiere decir que los colores que le faltan a uno son justamente los que tiene el otro. Ejemplo 3: La plata natural está formada por dos isótopos de masas 107 y 109 que se encuentran en las proporciones de 56% y 44% respectivamente. Calcular al peso atómico de la plata. 43 44 1 1 1 = RH 2 − 2 λ ni n j • • • • Serie Lyman Balmer Paschen Bracket Pfund En un espectro atómico: • • • El conjunto de líneas espectrales que se obtiene para un elemento concreto es siempre el mismo, incluso si el elemento forma parte de un compuesto complejo, es decir que cada elemento produce su propio espectro diferente al de cualquier otro elemento, y por lo tanto el espectro de un elemento es como si fuera su huella digital, por eso inicialmente los químicos alemanes Kirchoff y Bunsen comenzaron a emplearlos como medio de análisis. Los espectros contienen rayas agrupadas en series espectrales que van desde el IR hasta el UV Cada serie está formada por infinitas rayas cada vez mas juntas hasta llegar al límite de la serie. Si se descompone al luz emitida por un tubo de descarga lleno de hidrógeno, se obtiene su correspondiente espectro, en el que se pueden distinguir sus series espectrales. Una de ellas, la serie Balmer, cae dentro del visible, otra en el UV y el resto están en el IR. RH es la constante de Rydberg = 1,09.107 m−1 n1 y n2 son números enteros. n1 determina la serie. Haciendo n1=1 se obtiene la serie Lyman, haciendo n1=2 se obtiene la serie Balmer, con n1=3 la serie Paschen, etc Limitando el valor de n1 para una serie concreta, el conjunto de rayas espectrales se obtiene dándole a n2 valores enteros consecutivos al valor de n1, es decir n2 = n1+1, n1+2, n1+3, .... ni 1 2 3 4 5 nj 2, 3, 4, ... 3, 4, 5, ... 4, 5, 6, … 5, 6, 7, … 6, 7, 8, … Región del esp. UV Visible IR IR IR El modelo atómico de Rutherford era incapaz de explicar los espectros discontinuos de los átomos porque según éste el electrón puede girar en cualquier órbita (cualquier valor del radio es bueno) y por tanto el espectro debería ser continuo, y además porque al tratarse de una carga acelerada debería radiar OEM de la misma frecuencia que la frecuencia de revolución con lo que terminaría cayendo sobre el núcleo. HIPÓTESIS DE PLANCK El físico alemán Max Planck en una conferencia el 14 de diciembre de 1900, que es una fecha histórica para la física, dijo que para poder explicar la radiación del cuerpo negro había que desechar la idea de que los cuerpos pueden absorber y emitir energía de forma continua. Hay que admitir que la energía se absorbe y emite en forma de pequeños paquetes de energía, que llamó “cuantos” (posteriormente Einstein los llamó fotones) y su energía es proporcional a su frecuencia: E = hν h = cte. de Planck = 6,62 ⋅ 10 −34 J ⋅ s Según esto, un cuerpo puede absorber o emitir un fotón, o dos, o tres, es decir n ⋅ hν donde n es un número entero, lo que quiere decir que “la energía está cuantizada”. • El sueco Rydberg encontró empíricamente la relación que existía entre la longitud de onda de cada raya en cada una de las series: 45 • Planck supuso que la radiación electromagnética era emitida por pequeños osciladores submicroscópicos que solo podían vibrar con múltiplos enteros de cierta frecuencia ν, y no con cualquiera, así que radiaban energía en múltiplos de hν. Como el número de osciladores es enorme y cada uno de ellos oscila con una frecuencia distinta, el cuerpo puede emitir todas las frecuencias y el espectro es continuo. 46 • 1 c 1 = hcR H 2 − 2 λ ni n j R´= h c R H = 2,16 ⋅ 10 −18 J Planck partiendo de esta idea, absolutamente nueva, consiguió una fórmula empírica que reproducía exactamente la curva experimental de la radiación el cuerpo negro. ∆E = E j − E i = hν = h Planck puso los cimientos de la física moderna, pero no recibió el premio Nóbel por su descubrimiento del cuanto hasta varios años después, cuando Einstein hizo uso de éste concepto para explicar el efecto fotoeléctrico, quedando la revolucionaria idea fuera de dudas. Por ejemplo, el salto que se muestra en la figura, correspondiente a la segunda raya de la serie Balmer, corresponde a un fotón de: 1 1 ∆E = E 4 − E 2 = 2,16 ⋅ 10 −18 2 − 2 = 4,06 ⋅ 10 −19 J = 2,54eV 4 2 E 4,06 ⋅ 10 −19 E = hν ⇒ ν= = = 6,13 ⋅ 1014 Hz (azul) h 6,62 ⋅ 10 −34 MODELO ATÓMICO DE BOHR La deducción teórica de la ecuación de Rydberg vino de mano de Bohr, que propuso un modelo atómico idéntico al de Rutherford, pero en el que el electrón solo puede girar en unas órbitas estacionarias, donde no emite energía, y que son aquellas en las que el momento angular del electrón es un múltiplo entero de h/2π. L = rmv = n Ejemplo 4: a) Razona si la siguiente afirmación es o no correcta: El ojo humano puede ver de color azul una onda electromagnética de frecuencia igual a 4,0 ⋅ 1014 Hz y de color rojo otra de h 2π donde n es un número entero que toma valores 1, 2, 3 ... e indica la órbita y se llama número cuántico principal. Las transiciones electrónicas se producen absorbiendo y luego emitiendo un fotón de energía igual a la diferencia de energía entre los niveles y dan lugar a los espectros discontinuos. Así por ejemplo en el átomo de hidrógeno, que tiene un protón en su núcleo y un electrón, el electrón estará girando en el nivel n=1, que es el nivel de menor energía. Sin embargo podemos comunicar una energía a ese electrón y excitarlo, por ejemplo calentándolo, iluminándolo o estableciendo una ddp y en ese caso la energía que adquiere el electrón le hará saltar hasta una órbita más externa. frecuencia 7,0 ⋅ 1014 Hz . b) La primera raya de la serie Lyman corresponde a un salto electrónico entre el nivel 2 y el nivel 1. Calcula la diferencia de energía entre esos niveles, sabiendo que la frecuencia de la raya es de 2,45 ⋅ 1015 Hz Dato: Constante de Plack = 6,62 ⋅ 10 −34 J ⋅ s a) La región correspondiente al visible del espectro electromagnético va desde el rojo, que es la radiación menos energética y por tanto de menor frecuencia, hasta el violeta, que es la radiación más energética. En consecuencia los valores de las frecuencias deben haberse cambiado, siendo la frecuencia menor 4,0 ⋅ 1014 Hz la del rojo y la mayor 7,0 ⋅ 1014 Hz la del azul. b) De acuerdo con la expresión de Plack, la energía correspondiente al fotón de luz emitida por el electrón al saltar de un nivel a otro de menor energía viene dada por E = hν por tanto es proporcional a la frecuencia: ∆E = E 2 − E1 = h.ν = 6,62 ⋅ 10 −34 ⋅ 2,45 ⋅ 1015 = 1,62 ⋅ 10 −18 J = 10,13eV Ejemplo Para dos elementos de números atómicos Z1 = 11 y Z2 = 16. a) Escribe, razonadamente, la configuración electrónica. b) En un momento determinado el último electrón de ambos elementos se encuentra en el subnivel 4s. Al volver al estado fundamental, uno de los elementos emite una raya roja, mientras que el otro la emite amarilla. Razona a cual de los elementos corresponde cada raya. En la figura se muestra como un fotón excita al electrón, que inicialmente se encuentra en el nivel mas bajo de energía, y lo manda hasta el nivel 4. Posteriormente vuelve a su estado fundamental emitiendo un fotón correspondiente a la serie Balmer y otro a la serie Lyman. La energía de los fotones es igual a la diferencia de energía entre los niveles entre los que salta: 47 48 E = mc 2 = p c MODELO ATÓMICO DE SOMMERFELD. NUMERO CUÁNTICO SCUNDARIO El modelo de Bohr explicaba el espectro del átomo de hidrógeno pero no el de los demás átomos con más electrones, donde aparecían rayas desdobladas, indicando que los niveles estaban desdoblados. Sommerfeld resolvió el problema diciendo que las órbitas podían ser circulares y elípticas y que los desdoblamientos de las rayas se debían a que los niveles estaban desdoblados en subniveles con órbitas con distintas excentricidades, introduciendo así el número cuántico secundario (l) para designar el subnivel y que toma valores desde 0 hasta n−1, así: nº cuántico principal (n) n=1 n=2 n=3 n=4 nº cuántico secundario (l) l =0 l = 0, 1 l = 0, 1, 2 l = 0, 1, 2, 3 subniveles S s, p s, p, d s, p, d, f • Si la luz es una onda se podrá caracterizar por su longitud de onda: E = hν = h • c λ Igualando ambas expresiones se deduce la relación entre la longitud de onda y el momento lineal de los fotones asociados a ella: λ= h p o bien que λ= h mv De Broglie hizo extensiva su hipótesis a todas las partículas en general, y en particular a los electrones diciendo: “A todo corpúsculo en movimiento se le puede asociar una onda, cuya longitud de onda es inversamente proporcional a su momento lineal” De esta forma se explica el desdoblamiento de las rayas espectrales. Por ejemplo, cuando el electrón se excite y salte hasta el nivel n=3 puede alojarse en cualquiera de los tres subniveles (s, p y d) que tiene, así que cuando vuelva a su estado inicial podrá emitir tres fotones de energía muy parecida, pero distinta y por eso en el espectro aparecen tres rayas muy juntas: La hipótesis de De Broglie no tenía ningún apoyo experimental y por tanto debía confirmarse, es decir habría que conseguir fenómenos de difracción con electrones, lo que probaría que las partículas llevan asociada una onda. Davisson y Germer, y poco después Thomson (hijo), consiguieron realizar experimentos de difracción con electrones haciendo incidir un haz de electrones sobre una superficie muy fina de níquel, obteniendo una figura de difracción similar a la que se obtiene por difracción de rayos X y a partir de la que podía calcularse la longitud de onda asociada a los electrones y que coincidía con la prevista por De Broglie. De Broglie, mediante su hipótesis pudo demostrar lo que hasta entonces nadie había podido: El porqué las órbitas del modelo atómico de Bohr estaban cuantificadas, es decir que solo eran posibles aquellas en las que el momento angular del electrón es un múltiplo entero de h / 2π h n=1, 2, 3, .... L = rmv = n 2π HIPÓTESIS DE De BROGLIE Durante el primer cuarto del siglo XX la física tenía un dilema sobre la naturaleza de la luz entre ondulatoria y corpuscular. Por una lado la radiación del cuerpo negro, el efecto fotoeléctrico, el efecto Compton y la interpretación de los espectros atómicos apuntaban hacia la naturaleza “cuántica” de la luz, mientras que los fenómenos de interferencias, difracción y polarización evidenciaban su naturaleza ondulatoria. De Broglie dijo que si el electrón lleva asociada una onda, solo podrá girar en aquellas órbitas para las cuales la onda sea estacionaria, lo que solamente puede ocurrir cuando la longitud de la circunferencia sea un múltiplo entero de λ, porque en caso contrario la onda se autodestruiría por sucesivas interferencias: En 1924, Luis De Broglie en su tesis doctoral hizo el siguiente razonamiento: • Si la luz está formada por corpúsculos, éstos se podrán caracterizar por su momento lineal como cualquier partícula: p=mc con lo que la ecuación de Einstein se podrá escribir como: 49 50 λp = h mpv λp λe λe = Sustituyendo λ por el valor de De Broglie h / mev ⇒ λp = λe me mp ⇒ λp < λe h mev PRINCIPIO DE INCERTIDUMBRE DE HEISENBERG h mv organizando: rmv = n h / mpv b) Si el protón y el electrón tienen el mismo momento lineal, ambos tendrán también la misma longitud de onda asociada, ya que λ = h / p . Evidentemente, como p = m p v p = m e v e para que ambas partículas tengan el mismo momento lineal deben tener distinta velocidad, porque tienen distinta masa. 2π r = nλ 2π r = n = h 2π Una aplicación práctica de la dualidad onda−corpúculo es el microscopio electrónico ideado por Müller. La limitación de un microscopio está en que no pueden resolverse imágenes mas pequeñas que la longitud de onda de la luz que emplea. Cuando empleamos luz del visible puede resolver hasta los 300 o 350 nm, así que no es posible ver algo que mida menos de eso. Como es de suponer, es imposible realizar una medida sin interaccionar de alguna manera con el sistema a medir, por ejemplo si para medir la temperatura de un líquido introducimos un termómetro en él, éste intercambiará calor con el líquido que manera que cuando alcance el equilibrio no nos dará la temperatura a la que realmente estaba el líquido. Pero claro el termómetro es muy pequeño y el error que introduce en la medida es insignificante. En el mundo microscópico, sin embargo, los errores son más importantes. Supongamos que existiera un supermicroscopio con el que fuera posible ver el átomo de hidrógeno. Como el poder de resolución del microscopio depende de la longitud de onda empleada y es mas o menos igual a ella, resulta que tendríamos que iluminar al átomo con una luz de o Los rayos X en principio podrían ser una solución, porque tienen longitudes de onda entre 10 y 0,01nm, pero no valen porque son muy difíciles de enfocar y dan lugar a imágenes muy borrosas. Los electrones sin embargo cuando se aceleran mediante un campo eléctrico pueden llegar a tener longitud de onda muy pequeñas, de hasta 0,001nm, (recuerda que de acuerdo con la expresión de De Broglie la longitud de onda es inversamente proporcional a la velocidad de los electrones λ = h / m v ) y los electrones son fáciles de enfocar utilizando campos eléctricos y magnéticos, como se hace en los tubos de TV. o aproximadamente λ = 1 A = 10 −10 m . Pero claro, un fotón de 1 A tiene una energía: E = hν = h c 3 ⋅ 108 = 6,6 ⋅ 10 −34 −10 = 1,98 ⋅ 10 −15 J = 12375 eV λ 10 Si tenemos en cuenta que el potencial de ionización (energía necesaria para arrancarle un electrón a un átomo) del átomo de hidrógeno es solo de 13,6 eV comprenderemos que la interacción con el átomo sería tan grande que de ninguna manera podríamos verlo como es en estado normal. El principio de incertidumbre formulado por Wrener Heisenberg dice que “es imposible conocer con exactitud y a la vez la posición y el momento lineal de una partícula. Cuanto mayor sea la sea la precisión con que conocemos su posición, mayor será el error con que podemos conocer su momento lineal y viceversa, de forma que el producto de las incertidumbres siempre será mayor o igual que h/2π.” Ejemplo 5: Razone si la longitud de onda de De Broglie de los protones es mayor o menor que la de los electrones en los siguientes casos: a) ambos tienen la misma velocidad. b) ambos tienen el mismo momento lineal? ∆x ⋅ ∆p ≥ a) Como sabemos la masa del protón es mucho mayor que la masa del electrón (algo más de 1800 veces mayor), por tanto si el protón y el electrón tienen la misma velocidad la longitud de onda del protón será menor: 51 h 2π Esta incertidumbre nada tiene que ver con los instrumentos de medida, sino que es intrínseca del hecho de medir. 52 Einstein extendió el principio de incertidumbre de Heisenberg a todas las parejas de magnitudes conjugadas, es decir que tuvieran las mismas dimensiones que la posición por el momento, es decir: ML2T−1, como ocurre con la energía y el tiempo, así que también puede escribirse como: h ∆E ⋅ ∆t ≥ 2π En el caso de la pelota: ∆p = m∆v = 0,1 ⋅ 1 = 0,1Kg ⋅ m / s ∆x ⋅ ∆p ≥ Ejemplo 6: a) Calcular la longitud de onda asociada a un electrón que se mueve con una velocidad de 6.106 m/s b) Calcular la longitud de onda asociada a una pelota de tenis de 100 g que se mueve con una velocidad de 100 m/s. Compara los resultados obtenidos. c) Si la velocidad del electrón y de la pelota estuvieran medidas con un error del 1% ¿Cuál es el error con que podría determinarse la posición del electrón y de la pelota?. Compara los resultados. a) La velocidad del electrón se calcula teniendo en cuenta que: λ= o h 6,62 ⋅ 10 −34 = = 1,22 ⋅ 10 −10 m = 1,22 A 6 − 31 mv 9,1 ⋅ 10 ⋅ 6 ⋅ 10 h 2π ⇒ ∆x ≥ h 6,62 ⋅ 10 −34 = = 10 −33 m 2π ⋅ ∆p 2π ⋅ 0,1 Como vemos, en el caso del electrón la incertidumbre es del orden de las distancias interatómicas, y por lo tanto es importante, pero en el caso de la pelota es absolutamente despreciable porque no es ni siquiera del tamaño de un núcleo, es decir que a efectos prácticos podríamos decir que sí podríamos determinar con precisión la posición de la pelota. En otras palabras, podemos decir que dada la pequeñez de la constante de Planck, la incertidumbre en nuestro mundo macroscópico es despreciable, pero no ocurre así en el mundo microscópico. DETERMINISMO Y PROBABILIDAD Como consecuencia del principio de incertidumbre de Heisenberg no podemos situar al electrón en órbitas sencillas y bien definidas y además conocer su velocidad como puede hacerse en el modelo de Bohr, que nos permite calcular el radio (posición) y la velocidad (momento). b) En el caso de la pelota, la longitud de onda asociada sería: λ= ∆v = 100 ⋅ 0,01 = 1m / s o h 6,62 ⋅ 10 −34 = = 6,62 ⋅ 10 −35 m = 6,62 ⋅ 10 − 25 A mv 0,1 ⋅ 100 Como puede verse, la longitud de onda del electrón es comparable a la de los rayos X y es del orden de las distancias interatómicas de los átomos en un cristal y por tanto es apropiada para producir fenómenos de difracción y poner de manifiesto las propiedades ondulatorias de la onda asociada al electrón. Sin embargo, la longitud de onda asociada a la pelota de tenis es tan extremadamente pequeña que en la naturaleza no existe nada comparable y por tanto, en la práctica, resulta imposible poner de manifiesto la onda asociada a la pelota. Schrodinger elaboró su mecánica cuántica ondulatoria partiendo de las ideas de De Broglie y suponiendo que los estados estacionarios de los átomos corresponden a ondas de materia estacionarias, a las que llamó función de onda ψ, que es una función de la posición y del tiempo. El significado de la función de onda ψ es probabilístico y nos da la probabilidad de encontrar al electrón en un elemento de volumen dV: P = ∫ Ψ 2 dV V c) Supongamos ahora que las velocidades anteriores se han obtenido con un error del 1%. En el caso del electrón el error cometido habría sido de: ∆v = 6 ⋅ 10 6 ⋅ 0,01 = 6 ⋅ 10 4 m / s Así que el error con que habríamos medido el momento lineal sería: ∆p = m∆v = 9,1 ⋅ 10 −31 ⋅ 6 ⋅ 10 = 5,46 ⋅ 10 4 −26 Supongamos el caso sencillo de una cuerda que está vibrando entre dos puntos. Como es natural, esos dos puntos entre los que vibra serán nodos y además solo podrá vibrar con unos determinados valores de λ, es decir que la longitud de onda está cuantizada ya que solo puede tomar valores para los que la longitud de la cuerda sea siempre un múltiplo entero de λ/2 Kg ⋅ m / s así que: ∆x ⋅ ∆p ≥ h 2π ⇒ ∆x ≥ Los valores de probabilidad oscilan entre 0 y 1. Es importante recalcar que ψ2 nos da una medida de la probabilidad de encontrar al electrón en un volumen dado, es decir, no donde está, sino donde es probable que esté, y por tanto no contradice el principio de incertidumbre. h 6,62 ⋅ 10 −34 = = 1,9 ⋅ 10 −9 m 2π ⋅ ∆p 2π ⋅ 5,46 ⋅ 10 − 26 53 54 λ 2 Por ejemplo dos modos posibles de vibración de la cuerda serían: NÚMEROS CUÁNTICOS L=n De la ecuación de Schrodinger se deducen tres números cuánticos que definen inequívocamente cada uno de los orbitales atómicos, es decir cada orbital se define con tres números cuánticos; n, l y m. Los dos primeros ya fueron introducidos por Bohr y Sommerfeld. El número cuántico m, llamado también número cuántico magnético, explica el efecto Zeeman que consiste en un desdoblamiento de las rayas espectrales cuando espectro se obtiene en presencia de un campo magnético. El número cuántico magnético toma valores desde –l ..0..+l En el caso de una partícula encerrada entre esas paredes, la ecuación de esas ondas es la que se representa por ψ, y la probabilidad de encontrar a la partícula entre esas paredes viene dada por ψ2: En cada orbital cabe un máximo de 2 electrones y estos de distinguen mediante el número cuántico de spín, que toma valores de + 21 y − 12 e indica el sentido de giro del electrón sobre sí mismo. Como puedes ver, para n=1 es más probable que la partícula se encuentre en el centro, sin embargo una interpretación clásica daría la misma probabilidad en cualquier lugar. Aplicando estos mismo conceptos al átomo se obtienen unas regiones de máxima probabilidad de encontrar al electrón que se llaman orbitales, por analogía con las desechadas órbitas de Bohr. Los orbitales son regiones del espacio, alrededor del núcleo, donde hay máxima probabilidad de encontrar al electrón, por ejemplo en el desechado modelo de Bohr, el electrón del hidrógeno está girando en una órbita perfectamente definida, mientras que según el modelo de la mecánica cuántica no se puede saber exactamente donde está ni que hace, sino que hay mucha probabilidad de encontrarlo dentro de una esfera, donde la probabilidad es máxima para valores del radio predichos por Bohr: Así que resumiendo tenemos que un electrón se define con 4 números cuánticos: • Número cuántico principal (n) Indica el nivel y describe el tamaño del orbital, por ejemplo: los orbitales para los cuales n=2 son más grandes que aquellos para los cuales n=1. Puede tomar cualquier valor entero empezando desde 1: n=1, 2, 3, 4, etc. • Número cuántico secundario del momento angular orbital (l) indica el subnivel. Puede tomar valores naturales desde 0 hasta n−1 (siendo n el valor del número cuántico principal). Por ejemplo si n=4, los valores de l pueden ser: l= 0, 1 ,2, 3. Siguiendo la antigua terminología de los espectroscopistas, se designa a los orbitales atómicos en función del valor del número cuántico secundario, l, como: l=0 l=1 l=2 l=3 55 subnivel s subnivel p subnivel d subnivel f • Número cuántico magnético (ml), determina la orientación espacial del orbital y es el que determina de definir el orbital. Puede tomar valores enteros desde −l hasta +l. Por ejemplo, si l=2, los valores posibles para m son: ml=−2,−1, 0, 1, 2 • Número cuántico de espín (s), indica el sentido de giro del electrón y define a cada uno de los dos electrones que caben en un orbital. Toma dos valores: +1/2 y −1/2. • Un orbital queda definido por los números cuánticos n, l y m. Mientras que un electrón necesita para quedar definido los 4 números: n, l, m y s. 56 Como ejemplo vamos a escribir todos los posibles estados de un electrón que esté en el nivel n=1 y en el n=2 n l m s orbital 1 0 0 1 0 0 −1, 0, +1 ± 12 ± 12 1 ± 2 , ± 12 , ± 12 1s 2s 2px, 2py, 2pz 2 (3,1,−1, ½) Nº electrones posibles 2 2 6 (2,2,1,−½) n = 3 → l = 0, 1, 2 ↓ m = −1, 0, 1 ↓ s = −1/2, +1/2 Correcto n = 2 → l = 0, 1 Imposible, el número cuántico l toma valores desde 0 hasta n−1, y por tanto su valor máximo sería 1, nunca 2. Ejemplo 7: E4B.S2009 n = 3 → l = 0, 1, 2 ↓ m = −2, −1, 0, 1, 2 ↓ s=−1/2, +1/2 Conteste a las siguientes cuestiones relativas a un átomo con Z=7 y A=14: a) Indique el número de protones, neutrones y electrones b) Escriba su configuración electrónica e indique el número de electrones desapareados en su estado fundamental. c) Cual es el número máximo de electrones para los que n=2, l=0 y m=0 ? (3,2,−2, ½) a) Teniendo en cuenta que el número atómico (Z), por definición, es el número de protones y que en número de masa (A) es el número de protones+neutrones: b) El electrón (3,1,−1, ½) está en el orbital definido por (3,1,−1) que corresponde a un orbital 3p. El electrón (3,2,−2, ½) está en el orbital (3,2,−2) que corresponde a un orbital 3d. Protones Neutrones Electrones Correcto =Z=7 = A – Z = 14 – 7 = 7 = nº Protones si es neutro = 7 ORBITALES ATÓMICOS b) Este apartado lo dejaremos para más adelante c) Tres números cuánticos definen un orbital, y en cualquier orbital caben como máximo 2 electrones con spines +1/2 y –1/2. (por cierto que el orbital definido por los números cuánticos n=2, l=0 y m=0 es el orbital 2s ) Ya hemos dicho qué se entiende por orbital y qué los define: • • • Ejemplo 8: E1A.S2006 Dados los conjuntos de números cuánticos: (2,1,2, ½); (3,1,−1, ½); (2,2,1,−½); (3,2,−2, ½) a) Razone cuáles no son permitidos. b) Indique en qué tipo de orbital se situaría cada uno de los electrones permitidos. Un orbital es una región del espacio, alrededor del núcleo, donde hay máxima probabilidad de encontrar al electrón Un orbital queda definido por los 3 números cuánticos n, l y m. En cualquier orbital caben un máximo de 2 electrones con espines +1/2 y –1/2. Ahora vamos a ver su forma, es la misma para todos los niveles, solo que cada vez son mayores, así por ejemplo en subnivel s, que tiene simetría esférica, de los niveles n=1, n=2 y n=3 sería: a) Como sabemos, los cuatro números cuánticos definen la posición de un electrón, pero deben ser coherentes con los valores que pueden tomar, así que empezaremos desde el número cántico principal viendo los posibles valores del resto: (2,1,2, ½) n = 2 → l = 0, 1 ↓ m= −1, 0, 1 Imposible, el número cuántico l=1, no puede dar lugar a un número cuántico m=2, porque m solo puede tomar valores desde –1 hasta +1. 57 58 Para recordar el orden energético de los subniveles ayúdate del siguiente esquema, en el que cada fila representa un nivel y en él se han representado los distintos subniveles (solo los necesarios) teniendo forma simétrica. Para averiguar la energía e cada subnivel no tienes más que seguir el orden de las flechas: m=0 s un orbital simetría l=0 esférica p l=1 d l=2 f l=3 m=−1, 0, 1 tres orbitarles de dos lóbulos según los ejes Siguiendo las flechas obtendrás el orden siguiente: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s ... m=−2, −1, 0, 1, 2 cinco orbitales multilobulares DISTRIBUCIÓN DE ELECTRONES. CONFIGURACIÓN ELECTRÓNICA m=−3,−2,−1,0,1,2,3 siete orbitales multilobulares El orden de llenado de los electrones en los átomos, llamado principio de construcción, obedece a tres reglas básicas: • Por último nos queda ver como es la energía de los distintos orbitales: • • • La energía de los nivel aumenta con el nivel, como ya sabemos por el modelo de Bohr, y por supuesto la energía de los subniveles asociados a cada nivel también va aumentando. Cuando un nivel se desdobla, parte de los subniveles que lo componen tienen menos energía que él, mientras que otra parte de ellos son más energéticos. Como los niveles cada vez están mas juntos, al desdoblarse a veces se solapan y los subniveles superiores tienen menos energía que algunos inferiores: • • Los electrones tratan siempre de ocupar los niveles y subniveles de menor energía, lo que supone una tendencia general de la naturaleza. Para recordar el orden energético recordaremos la regla nemotécnica anterior. Principio de excusión de Pauli: En cada orbital solo puede haber un máximo de dos electrones con spines opuestos, lo que se suele enunciar también como que “en un átomo no puede haber dos electrones con los cuatro números cuánticos iguales”. Principio de máxima multiplicidad de Hund: Cuando varios electrones entran en un mismo subnivel orientan sus espines de manera que haya el máximo de electrones desapareados, es decir que sus orbitales se llenan primero con electrones del mismo spín y cuando todos los orbitales están semillenos en la segunda vuelta empiezan a aparearse con electrones de spín contrario. Siguiendo estas tres sencillas reglas podemos construir una tabla de la siguiente forma: • • • • 59 Representamos mediante circulitos a los orbitales Vamos dibujando hacia abajo los niveles y en ellos los subniveles que hay en cada uno, así como el número de orbitales que hay en cada subnivel, recordando que caben dos electrones: uno arriba con spín + 1 2 y otro abajo con spín − 1 2 Empezamos a numerar desde arriba siguiendo el orden de llenado (regla nemotécnica) y teniendo en cuenta, que según la regla de Hund, cuando lleguemos a un subnivel con varios orbitales, primero numeramos los de arriba y luego los de abajo. Hemos colocado sobre cada número el elemento del mismo Número Atómico 60 l=0 s l=1 l=2 l=3 p d f Configuración electrónica: Es una especie de fórmula electrónica que indica los electrones que tiene un elemento o ión, así como su disposición en los distintos niveles, subniveles y orbitales. Para obtenerla no hay más que seguir las tres reglas básicas de llenado: • H 1 n=1 1 Que los electrones van entrando en los niveles y subniveles de menor a maor energía, es decir en el orden 1s 2s 2p 3s 3p 4s 3d 4p 5s 4f … (para recordarlo puedes utilizar el esquema energético) 2 Comienzas a colocar electrones, siguiendo el principio de exclusión de Pauli, y se indican en forma de exponente del subnivel. La suma de los exponentes deberá coincidir con el número de electrones a colocar que lógicamente será igual al número atómico del átomo en estado fundamental. 3 Los electrones en cada subnivel entran siguiendo las reglas de máxima multiplicidad de Hund, es decir, en primer lugar con los electrones del mismo spín. • O 2 He n=2 • Li 3 B C N 5 6 7 O OOO 4 Be 8 9 10 O F Ne Na 11 Al Si P 13 14 15 Sc Ti V Cr Mn 21 22 23 24 25 O OOO OOOOO 12 Mg 16 17 18 S Cl Ar 26 27 28 29 30 Fe Co Ni Cu Zn K 19 Ga Ge As 31 32 33 Y Zr Nb Mo Tc 39 40 41 42 43 Ejemplo 9: n=3 n=4 n=5 Escribir la configuración electrónica de un elemento, sabiendo que Z=7 ¿Qué elemento es? Para escribir la configuración electrónica de los estados fundamentales de cada átomo debemos tener en cuenta (1º) que los electrones se van colocando en los subniveles de menor a mayor energía (1s 2s 2p 3s 3p 4s 3d 4p 5s 4f …) y (2º) siguiendo el principio de exclusión de Pauli y (3º) las reglas de máxima multiplicidad de Hund hasta completar el número de electrones: 1s2 2s2 2p3 3s 3p 4s 3d 4p 5s 4f … La Ce Pr Nd Pm Sm Eu 57 58 59 60 61 62 63 O OOO OOOOO OOOOOOO 20 Ca 34 35 36 Se Br Kr 44 45 46 47 48 Ru Rh Pd Ag Cd 64 65 66 67 68 69 70 Gd Tb Dy Ho Er Tm Yb Rb 37 In Sn Sb 49 50 51 Lu Hf Ta W Re 71 72 73 74 75 Ac Th Pa U Np Pu Am 89 90 91 92 93 94 95 O OOO OOOOO OOOOOOO 38 Sr 52 53 54 Te I Xe 76 77 78 79 80 Os Ir Pt Au Hg 96 97 98 99 100 101 102 Cm Bk Cf Es Fm Md No l=0 s l=1 l=2 l=3 p d f 1 O n=1 2 n=6 Cs 55 Tl Pb Bi 81 82 83 Lr Rf O OOO OOOOO 56 Ba 84 85 86 Po At Rn N 103 104 105 3 O La configuración electrónica sería: 1s2 2s2 2p3 que obviamente corresponde a la posición que debe ocupar el nitrógeno. A veces se puede escribir de forma más detallada como 1s2 2s2 2px1py1pz1 (en este caso se hace notar claramente las reglas de máxima multiplicidad de Hund) Algunas veces se indica también escribiendo entre corchetes el gas noble previo y completando únicamente los electrones que le faltan, es decir: [He] 2s2 2p3 OOO 88 Ra n=8 7 OOO 4 Fr 87 n=7 5 6 O n=2 O 61 62 Ejemplo 10: E1B.S2008 Ejemplo 11: E3B.S2007 Para el ión Cl− (Z=17) del isótopo cuyo número másico es 36: a) Indique el número de protones, electrones y neutrones. b) Escriba su configuración electrónica. c) Indique los valores de los números cuánticos de uno de los electrones externos. Dadas las configuraciones electrónicas: A : 1s2 3s1 ; B : 1s2 2s3 ; C : 1s2 2s2 2p6 3s2 3p5; D : 1s2 2s2 2px2 2py0 2pz0 Indique razonadamente: a) La que no cumple el principio de exclusión de Pauli. b) La que no cumple el principio de máxima multiplicidad de Hund. c) La que, siendo permitida, contiene electrones desapareados. a) Protones Neutrones Electrones = Z = 17 = A – Z = 36 – 17 = 19 = nº Protones + 1 = 17+1 = 18 En primer lugar vamos a dibujar esas configuraciones electrónicas y después respondemos a las preguntas: b) 1 n=1 O 2 n=2 n=3 3 5 6 O OOO 4 8 9 10 11 13 14 15 a) El principio de exclusión de Pauli lo que dice es que no puede haber dos electrones con los 4 números cuánticos iguales, dicho de una forma mas simple: que no puede haber dos electrones ocupando el mismo sitio. 7 O OOO 12 16 17 18 b) El principio de máxima multiplicidad de Hund dice que cuando varios electrones entran en un mismo subnivel, sus orbitales se llenan primero con electrones del mismo spín, es decir que primero llenaremos los de arriba y cuando haya entrado un electrón en cada orbital empezaremos a aparearlos. OOOOO Cl Ar Configuración Disposición de electrónica electrones, según la c.e. La configuración electrónica (… siempre el mismo razonamiento) del cloro es Cl: 1s2 2s2p6 3s2p5 A : 1s2 3s1 Y la configuración electrónica de su ión, que tienen un electrón más es: Cl−: 1s2 2s2p6 3s2p6 Que coincide con la configuración electrónica del gas noble más próximo, que en este caso es el Argón. Sin embargo, aunque el ión cloruro y el argón tengan el mismo número de electrones y la misma configuración electrónica (se dice que son isoelectrónicos) no son iguales, porque en sus núcleos siguen teniendo 17 protones el cloruro y 18 el argón, que como dijimos es lo que realmente los identifica como tales elementos. c) El electrón más externo, obviamente es el número 18, el que tienen de más, y sus números cuánticos, como se deduce de la figura de la tabla, que como ves aquí también te ayuda bastante, son: l=0 m=0 n=1 l=1 O O (*) OOO m =−2 –1 0 1 2 n=3 O OOO (*) B : 1s 2s 3 C : 1s2 2s2 2p6 3s2 3p5 D : 1s2 2s2 2px2 2py0 2pz0 l=2 m = −1 0 1 n=2 2 + 12 n=3 (está en el nivel 3) l=1 (está en el subnivel p) m=1 (orbital px) s=−1/2 Pauli Nº electrones desapareados Hund √ √ 1 Litio √ 1 Cloro No puede haber 3 electrones en un subnivel s √ No se cumple Se cumple, porque el porque no hay último 2e con los 4 nº electrón cuánticos debería tener iguales el mismo spín que el anterior OOOOO − 12 63 64 LA TABLA PERIÓDICA El primer intento de ordenar los elementos conocidos son las tríadas de Dobereiner, quien en 1829 observó que había una serie de elementos que tenían propiedades muy parecidas y que ordenándolos por su masa atómica, resultaba que la masa del elemento central era mas o menos la media de la masa de los otros, así formó las siguientes tríadas: Litio Sodio Potasio Calcio Estroncio Bario Todos los elementos de un mismo grupo o familia tienen la misma configuración electrónica en la última capa, es decir, tienen los últimos electrones dispuestos exactamente de la misma forma, lo que nos lleva a decir que “las propiedades químicas de un elemento residen en la disposición de sus últimos electrones, llamados también electrones de valencia”. La diferencia de un elemento a otro de la familia está en el periodo donde tiene los últimos electrones. Azufre Selenio Telurio En 1864, Newlands se dio cuenta de que si ordenada a los elementos por sus masas atómicas, salvo con el hidrógeno, los elementos mostraban una cierta tendencia a repetir sus propiedades cada cierto número. Mendeleiev, en 1869, propuso un modelo agrupando a los elementos por sus masas atómicas y ordenándolos en columnas según que tuvieran las mismas propiedades químicas. Incluso no tuvo reparos para dejar huecos en su tabla prediciendo elementos que aun no se conocían. El modelo sistema periódico actual se debe a Henry Moseley, que demostró que muchas de las imprecisiones de las ordenaciones anteriores podían subsanarse si los elementos se ordenaban por su número atómico en lugar de por su masa. Ordenándolos según su número atómico y plegándolos cada vez que se repiten sus propiedades químicas el resultado fue elementos químicamente semejantes agrupados en familias o grupos y en periodos. A las columnas de la tabla periódica se les llama grupos y se numeran del 1 al 18. El grupo es el que determina la configuración electrónica de la última capa. A las filas de la tabla periódica se le llama periodos. El periodo coincide con el número cuántico principal donde el átomo neutro tiene los electrones más externos. Los elementos se clasifican en tres grandes grupos, sin contar el hidrógeno, según los orbitales en los que están sus electrones de valencia, es decir los últimos: • 1. Los orbitales s y los d del nivel anterior tienen energías muy parecidas 2. Las estructuras más estables son aquellas en las que los subniveles están llenos, semillenos o vacíos. (Por ese motivo los gases nobles son muy estables, porque tienen todos los subniveles llenos) Elementos representativos: s y p s1 s2 s2p1 s2p2 s2p3 s2p4 s2p5 s2p6 • • Las excepciones en la configuración electrónica del Como y del Cobre se deben a que: Metales alcalinos, familia del Litio Metales alcalino−térreos, familia del Berilio Térreos o familia del Boro Carbonoideos Nitrogenoideos Anfígenos, familia del Oxígeno Halógenos, familia del Flúor Gases nobles ( a excepción del Helio, que es 1s2) Elementos de metales de transición: d Elementos de metales de transición interna: f grupo 1 grupo 2 grupo 13 grupo 14 grupo 15 grupo 16 grupo 17 grupo 18 Cromo, debería ser 3d4 4s2 y es 3d5 4s1 Por ese motivo, al tener los electrones s y d energías muy parecidas, un electrón s salta al subnivel d, y de esa forma ambos subniveles están semillenos, lo que es una estructura estable. Eso mismo no ocurre, por ejemplo con el Carbono, porque en este caso los subniveles s y p tienen energías más distintas. grupos 3 a 12 65 66 Obviamente ambas magnitudes, el radio y el volumen atómico, varían correlativamente: • Dentro de una familia, aumenta hacia abajo, porque cada nuevo elemento de la familia tiene los electrones dispuestos exactamente igual, pero cada vez en una capa más externa y de mayor energía. Además, porque los electrones de cada nuevo elemento de la familia se encuentran con una capa llena más que hace de pantalla. • A lo largo de un periodo, a primera vista, podríamos pensar que todos los átomos son iguales porque todos los electrones entran en el mismo nivel, sin embargo a lo largo del periodo el radio va disminuyendo, ya que aunque los nuevos electrones van entrando en el mismo nivel del átomo (e incluso en un nivel inferior) simultáneamente va aumentando la carga nuclear lo que hace que cada vez el núcleo atraiga con más fuerza a sus electrones y por eso se contrae. No obstante, el gas noble ya es mayor porque tiene demasiados electrones (la capa llena) y la repulsión entre ellos pesa más que la atracción nuclear. 1. RADIO ATÓMICO y VOLUMEN ATÓMICO • No se puede calcular el tamaño exacto de los átomos debido, como hemos visto, a que la mecánica cuántica considera al electrón dentro de una nube difusa (orbital) y no girando con un radio definido como preveía Bohr. Sin embargo podemos definir el Radio atómico de un elemento como la mitad de la distancia entre los centros de dos átomos vecinos. En el caso de los elementos de transición, como ocurre en general a lo largo de un periodo, los volúmenes atómicos van disminuyendo hasta que llega un momento en el que hay tantos electrones en la nueva capa que los apantallamientos mutuos y las repulsiones se hacen importantes, hacen que aumenten de tamaño. • Si representamos el radio de los átomos en función del número atómico obtendremos una gráfica similar a la siguiente Un paréntesis para repasar la Ley de Coulomb, que dice que, el módulo de la fuerza con que se atraen o repelen dos cargas, según que tengan distinto signo o el mismo signo, es directamente proporcional al producto de sus cargas e inversamente proporcional al cuadrado de la distancia que las separa, siendo la dirección de la fuerza la recta que las une. F=K q ⋅ q´ r2 Puesto que el electrón tiene carga negativa y en el núcleo están los protones con carga positiva (1) (2) se atraerán con una fuerza tanto mayor cuanto mayor sea la carga nuclear o bien cuanto menor sea la distancia que los separa (radio del átomo). PROPIEDADES PERIÓDICAS De la disposición de los elementos en la tabla de Moseley, resulta que aparecen en columnas formando familias todos los de la misma configuración y por eso no es de extrañar que sus propiedades se repitan. Vamos a ver como varían algunas de ellas: El volumen atómico se define como el volumen que ocupa 1 mol de átomos del elemento y por tanto se calcula como: V= masa 1mol Pm (gr ) = densidad ρ (gr / cm 3 ) 67 68 Ejemplo 1: Ordena de mayor a menor tamaño a los átomos siguientes: Na, Be y Mg Una vez situados estos elementos en el sistema periódico se ha de hacer uso de las variaciones periódicas de esta propiedad ya comentadas. Importante: En los comentarios a los contenidos de selectividad se indica que “no se considera justificación las flechas que indican el orden de variación de las propiedades”, es decir, no vale para nada decir simplemente que el tamaño en una familia aumenta hacia abajo y en un periodo disminuye hacia la derecha, a menos que se acompañe de un razonamiento en los términos anteriores. • • Na (metal alcalino) y Mg (metal alcalino−térreo) ambos están en el mismo periodo. En un periodo el tamaño disminuye hacia la derecha porque los electrones entran en el mismo nivel a la vez que va aumentando la carga nuclear lo que hace que cada vez el núcleo los atraiga con más fuerza y se contraiga. Es predecible que rMg<rNa. Be y Mg se encuentran en la misma columna (familia). En una familia el tamaño aumenta hacia abajo porque tienen la misma distribución de sus electrones de valencia, pero cada vez en una capa más externa. Es predecible que rBe<rMg. Por tanto, el orden pedido sería: rBe<rMg<rNa. Fíjate como hemos utilizado la situación en la tabla para razonar el tamaño, pero además hemos añadido el porqué es así, y ese razonamiento es el que da validez a la respuesta Ejemplo 2: ¿Cuál de los siguientes iones y átomos es el más grande: S2−, S, O2−? • Los aniones tienen mayor tamaño que los átomos de los neutros, porque teniendo la misma carga positiva en el núcleo tienen electrones de más y por tanto les cuesta más retenerlos. Es predecible que, rS2− > rS. • S y O son elementos que se encuentran dentro de la misma columna y por tanto, tanto los átomos neutros como sus iones, tienen la misma distribución de sus electrones de valencia, pero como el azufre está por debajo del oxígeno esos electrones están en una capa más externa y por tanto su tamaño es mayor. Es predecible que rS2− > rO2−. • Por tanto, el ion más grande es el ion S2−. 2. RADIO IÓNICO El radio iónico es una magnitud muy importante para entender la estructura y estabilidad de los cristales iónicos. Su tamaño varía lo mismo que el radio atómico, pero además depende muchísimo de la carga del ión. • • Los iones positivos son siempre más pequeños que los átomos de los que derivan ya que al tener menos electrones y la misma la carga positiva en el núcleo éste se contrae disminuyendo su tamaño Los iones cargados negativamente son siempre mayores que los átomos de los que derivan, ya que a la misma carga nuclear le cuesta más retener un mayor número de electrones a lo que se suma el apantallamiento del resto de los electrones. 69 70 Las energías de ionización, en eV, de los elementos del segundo periodo son: 3. ENERGÍA DE IONIZACIÓN Es la energía necesaria para arrancar un electrón a un átomo en estado gaseoso y convertirlo en un ión positivo. Aunque la unidad internacional de energía es el julio, suele expresarse en electrón−voltios/átomo (eV/átomo). X ( g ) + E i → X (+g ) + e − Li 5,4 Be 9,3 B C N O F Ne 8,3 11,3 14,5 13,6 17,4 21,5 Observaciones: A la energía necesaria para arrancarle un segundo o tercer electrón se le llama segundo, tercer potencial de ionización… • El Litio (y los de su misma familia) tiene el valor más pequeño porque al perder su electrón pasaría a tener la configuración de un gas noble (en este caso del helio) • Por la misma razón, la segunda energía de ionización del Berilio, Magnesio, etc es pequeña, porque estos elementos al perder dos electrones pasan a tener configuración de gas noble. Sin embargo la segunda EI de Litio, Sodio, etc es muy grande porque supone romper esa estructura de gas noble. • Como ya hemos razonado antes, a lo largo de un periodo la EI va aumentando hacia la derecha pero, como vemos, esa tendencia se rompe con el Boro y con el Oxígeno. La explicación es muy sencilla: Recuerda que la configuración del Boro es 2s2p1 y que la del oxígeno es 2s2p4 y por tanto cuando pierdan un electrón sus subniveles pasan a estar “llenos, semillenos o vacíos”, que como sabemos son las estructuras más estables. • El flúor (y el resto de halógenos) tienen una EI muy elevada, además de porque son mas pequeños y por tanto sus electrones están más retenidos, porque solo les falta 1 electrón para tener la configuración de un gas noble, así que su tendencia no es precisamente a perder uno, sino todo lo contrario. Como es natural, cuanto más fácil sea quitarle un electrón a un átomo, tanto menor será su energía de ionización. Si tienes en mente la ley de Coulomb comprenderás que la fuerza con que el núcleo atrae al electrón es mayor cuando mayor sea la carga nuclear y, cuanto menor sea la distancia del electrón al núcleo, o sea su tamaño, así que: • • • Dentro de una familia disminuye hacia abajo debido a que el tamaño de los átomos es cada vez mayor, con lo que los electrones de valencia están cada vez más lejos y menos atraídos y por otro lado porque al tener más electrones aumenta el efecto pantalla. En un periodo tiende a aumentar al hacerlo el número atómico, ya que los átomos son cada vez más pequeños y tienen mayor carga nuclear con lo que los electrones están más retenidos. No obstante hay excepciones muy curiosas que ahora veremos. En cada periódico, los gases nobles tienen las energías de ionización más elevadas. Estos gases son elementos muy estables y sólo los más pesados de ellos muestran alguna tendencia a unirse con elementos para dar compuestos. La energía de ionización es una magnitud muy importante puesto que nos permite conocer la tendencia de los átomos a formar iones positivos y a entender el comportamiento de los enlaces iónicos. Como cuanto menor sea la EI mayor será la tendencia a formar iones positivos (electropositividad), podemos entender que los metales alcalinos y los alcalinotérreos formen iones positivos (los que están a la izquierda de la tabla), pero que los halógenos no los formen (los que están a la derecha). 71 72 Ejemplo 3: E3A.S2009 La siguiente tabla proporciona los valores de las energías de ionización (eV) de tres elementos 1ª 2ª 3ª 4ª Li 5,4 75,6 122,5 −−− Na 5,1 47,3 71,9 99,1 K 4,3 31,8 46,1 61,1 a) Por qué la primera energía de ionización disminuye del litio al potasio? b) Por qué la segunda energía de ionización de cada elemento es mucho mayor que la primera? c) Por qué no se da el cuarto valor de la energía de ionización del litio Ejemplo: 5 Ordena de menor a mayor energía de ionización a los elementos siguientes: Ne, Na, P, Ar y K. • • • a) Dentro de una familia disminuye hacia abajo debido a que el tamaño de los átomos es cada vez mayor, con lo que los electrones de valencia están cada vez más lejos y menos atraídos y por otro lado porque al tener más electrones aumenta el efecto pantalla. • b) Teniendo en cuenta que la configuración electrónica en la última capa de los alcalinos es ns1, se explica que la primera EI sea pequeña porque al perder el único electrón que tienen en la capa más externa pasan a tener estructura del gas noble que le precede, pero quitarle un segundo electrón supone precisamente romper esa estructura que es muy estable. c) El Litio tiene solamente 3 electrones (1s2 2s1) y por tanto es imposible quitarle un cuarto que no existe Na, P y Ar están en la misma fila de la tabla periódica, por lo que EINa<EIP<EIAr. Ne y Ar son de la misma familia, gases nobles, y como el Ar tiene un volumen mayor sus electrones de valencia estarán menos retenidos, así que su EI será menor que la del Ne. Es esperable que EIAr<EINe. De igual modo, el Na y el K que son también de la misma familia, metales alcalinos: EIK<EINa. A partir de estas observaciones concluimos que las energías de ionización siguen el orden EIK<EINa<EIP<EIAr<EINe. 4. AFINIDAD ELECTRÓNICA La Afinidad Electrónica, también llamada Electroafinidad, es la energía desprendida cuando un átomo en estado gaseoso capta un electrón y se convierte en un ión negativo. Suele expresarse en electrón−voltios/átomo (eV/átomo). X ( g ) + e − → X (−g ) + E af Todos los elementos tienen una energía de ionización, porque por muy sujetos que tengan sus electrones siempre podremos suministrar la energía necesaria para arrancarlos. Ejemplo 4: E5B.S2009 Considerando las configuraciones electrónicas de los átomos: A (1s2 2s2 2p6 3s1) y B (1s2 2s2 2p6 6p1). Razone si las siguientes afirmaciones son verdaderas o falsas: a) A y B representan elementos distintos. b) Se necesita energía para pasar e A a B. c) Se requiere una menor energía para arrancar un electrón de B que de A. Sin embargo, no todos los elementos tienen una energía de afinidad electrónica, porque muchos de ellos no van a captar un electrón por más que queramos. Es el caso de los gases nobles que ya tienen la estructura más estable posible, o los metales alcalinos o alcalinotérreos cuya tendencia es la contraria como hemos visto antes. a) El elemento A es un metal alcalino, concretamente el Sodio en su estado fundamental. El elemento B también corresponde al sodio, pero su electrón de valencia se encuentra excitado porque en lugar de estar en el subnivel 3s está en el 6p, que obviamente es de mayor energía. Cuando ese electrón retorne al nivel vacío de menor energía (3s) emitirá un fotón de energía E=hν, igual a la diferencia de energía entre ambos subniveles. b) Evidentemente, puesto que el subnivel 6p es más energético que el 3s, el electrón no va solo, hemos de aportarle la energía equivalente a la diferencia de energía entre ellos. c) Claro, puesto que arrancar un electrón significa mandarlo al nivel infinito, será más fácil mandarlo del 6º al infinito que desde el 3º. El ahorro energético que tendríamos es igual a la diferencia de energía entre ambos subniveles. La afinidad electrónica varía exactamente de la misma forma que la energía de ionización, ya que por las mismas razones que un átomo se opone a perder un electrón, por las mismas tiende a ganarlo, es decir, cuando sea pequeño y su carga nuclear grande • Dentro de una familia disminuye ligeramente hacia abajo debido a que el tamaño de los átomos es cada vez mayor y el núcleo presenta menor atracción por el nuevo electrón. • En un periodo aumenta al hacerlo el número atómico, ya que los átomos son cada vez más pequeños y el núcleo tiene mayor atracción sobre el nuevo electrón. No obstante de lo anterior, los elementos muy pequeños tienen una afinidad electrónica algo menor de lo esperado debido a que ese tamaño tan pequeño hace que el electrón que entra se repela por los electrones que ya hay. 73 74 La electronegatividad sirve para clasificar los elementos en metales o no metales, según sean poco o muy electronegativos. Los no metales, por ejemplo son los que, como hemos visto, tienen los mayores valores de energía de ionización, de afinidad electrónica y de electronegatividad y por eso tienden a formar iones negativos captando electrones y son oxidantes como veremos más adelante. Las afinidades electrónicas en eV de algunos elementos son: Además la electronegatividad es un concepto importantísimo para comprender el tipo de enlace que tendrá lugar entre dos átomos: Fíjate que los metales alcalinotérreos tienen AE cero, lo mismo que los gases nobles, porque tienen estructuras muy estables y por ese motivo no quieren un electrón más que venga a desestabilizarlos. Los primeros son ns2 np0 así que tienen un subnivel lleno y otro vacío, y los gases nobles ns2 np6 tienen la última capa llena. • • • Fíjate también que la familia del nitrógeno tiene valores anormalmente bajos, precisamente porque todos ellos tienen configuración ns2 np3, es decir tienen un subnivel lleno y otro semilleno, lo que es muy estable y por tanto no tienen ningún interés en admitir otro electrón, especialmente el nitrógeno. El enlace entre átomos iguales o de muy parecida electronegatividad es apolar, como ocurre por ejemplo en la molécula de oxígeno, O2. El enlace entre átomos que tienen electronegatividades muy distintas es iónico, como ocurre por ejemplo en el cloruro sódico, NaCl, En los casos intermedios el enlace es covalente con un componente más o menos polar, dependiendo de la diferencia de electronegatividades, como por ejemplo en el cloruro de hidrógeno, HCl. La dificultad para medir la afinidad electrónica ha llevado a definir una nueva magnitud llamada electronegatividad. La electronegatividad mide la tendencia que un átomo “que se encuentra enlazado” tiene para atraer a la pareja de electrones del enlace. Ejemplo 6: E2A.S2008 El número de protones en los núcleos de cinco átomos es el siguiente: A = 9; B = 16; C = 17; D = 19; E = 20 Razone: a) ¿Cuál es el más electronegativo? b) ¿Cuál posee menor energía de ionización? c) ¿Cuál puede convertirse en anión divalente estable? Hay varias escalas para medir la electronegatividad: a) Lo primero que vamos a hacer es situarlos en la tabla periódica: 5. ELECTRONEGATIVIDAD. • • La escala de Mulliken se hace tomando como valor la media aritmética de la energía de ionización y de la afinidad electrónica. La escala de Pauling, que es la más utilizada, toma valores entre 0,7 para el Cesio y 4 para el flúor. Se calcula a partir de las energías de enlace. Puesto que la electronegatividad está íntimamente relacionada con le energía de ionización y con la afinidad electrónica, varía como ellas, es decir que aumenta hacia la derecha de la tabla y disminuye hacia abajo en una familia porque aumenta al disminuir el tamaño de los átomos. Puesto que la electronegatividad aumenta hacia la derecha de la tabla porque el volumen de los átomos es menor y disminuye hacia abajo porque el volumen aumenta, podemos decir que el elemento más electronegativo es el flúor, el de número atómico Z=9. Además precisamente a éste elemento Pauling le asigno el máximo valor de 4,0 b) La energía de ionización varía igual que la electronegatividad, aunque son conceptos distintos, pero lo motivos por los que un átomo atrae electrones son los mismos por los que se resiste a que se los quitemos, por eso aumenta hacia la derecha porque los átomos se contraen y disminuye en una familia porque cada vez tienen mayor tamaño. (Esto, claro con las excepciones que hemos comentado, de que al perder electrones pasen a configuraciones más estables). 75 76 Por lo tanto el elemento con menor energía de ionización es el potasio (Z=19). Además el potasio al perder su único electrón de la capa más externa pasaría a tener la estructura del Argón, que es muy estable, mientras que su vecino el calcio, que tiene estructura ns2 si pierde un electrón tendría una estructura menos estable que la que tiene con el subnivel lleno. El calcio precisamente lo que tiende es a perder, no uno, sino los dos electrones para tener la configuración del Argón. bromo porque es de un nivel mayor y por tanto tiene mayor tamaño y sus electrones están menos retenidos. En ambos cuestiones, se ha preferido escoger unos ejemplos de elementos cercanos al cloro, en su mismo periodo y de su misma familia. Obviamente podríamos haber escogido a cualquiera, por ejemplo al helio que es el que tienen mayor energía de ionización de todos y al cesio que es el que la tiene mas pequeña. c) Puesto que la tendencia de todos los elementos es a tener la configuración electrónica del gas noble más próximo, la tendencia de cada uno de los elementos en cuestión sería: • • • • 6. VALENCIA. Flúor y cloro tienden a captar 1 electrón, convirtiéndose en los iones F− y Cl− con la misma configuración electrónica del neón y argón respectivamente Azufre tiende a captar 2 electrones, convirtiéndose en el ión S2−, con la misma configuración electrónica del argón Potasio a perder 1 electrón, convirtiéndose en el ión K+, con la misma configuración electrónica del argón Calcio a perder 2 electrones, convirtiéndose en el ión Ca2+, con la misma configuración electrónica del argón La valencia es la capacidad de un elemento químico para combinarse, es decir, el número de enlaces químicos que puede formar. Como veremos en el próximo tema, la valencia de un ión es igual al número de electrones que gana o pierde y la valencia de un átomo en general es igual número de electrones desapareados que tiene. Vamos a ver los elementos del segundo periodo. Li: 2s1 Ejemplo 7: E3A.S2006 La configuración electrónica de la capa de valencia de un elemento A es 3s2p5. a) Justifique si se trata de un metal o un no metal. b) Indique, razonadamente, un elemento que posea mayor potencial de ionización que A. c) Indique, razonadamente, un elemento que posea menor potencial de ionización que A. Be: 2s2 3s2p5 corresponde a un halógeno a) El elemento que en la última capa tiene configuración y al corresponder al nivel 3 se trataría del cloro. El cloro es un no metal típico por los siguientes motivos: • • La electronegatividad sirve para clasificar los elementos en metales o no metales, según sean poco o muy electronegativos y el cloro tiene una electronegatividad muy grande, porque esta muy a la derecha y arriba de la tabla periódica. La tendencia del cloro es a ganar un electrón, convirtiéndose en el ión Cl− con la 3s2p6 configuración igual a la del argón. b) El potencial de ionización es un concepto similar al de energía de ionización con la diferencia de que en lugar de medir la energía necesaria para arrancar un electrón mide el potencial (en voltios) necesario para arrancárselo. B: 2s2p1 C: 2s2p2 N: 2s2p3 El nitrógeno no tiene subniveles vacíos dentro del mismo nivel, así que para desaparear su electrón tendría que saltar de nivel y esa diferencia de energía no se compensa con la formación de un enlace más. Un elemento con mayor potencial o energía de ionización que el cloro por ejemplo es su vecino argón, ya que al tratarse de un gas noble y tener una estructura muy estable es muy difícil quitárselo porque supone desestabilizarlo. Otro ejemplo podía ser el flúor que está por encima y al ser más pequeño mantiene más retenido a su electrón que en el caso del cloro, que tiene mayor tamaño. c) Con menor energía de ionización que el cloro, por ejemplo, tenemos al azufre o al bromo, porque ambos tienen mayor tamaño. El azufre porque aunque es del mismo nivel, está a su izquierda, y tiene 1 protón menos así que los electrones están menos retenidos. El 77 como la diferencia de energía entre dos subniveles del mismo nivel es muy pequeña, el electrón puede saltar del s al p, dando lugar a 2 electrones desapareados. En este, y en los demás casos similares, la inversión de energía para hacer que el electrón salte se compensa con creces al formar dos enlaces. P: 3s2p3d0 El fósforo, aunque es de la misma familia que el nitrógeno, está en el tercer nivel y ya si tiene un subnivel d completamente vacío a donde puede saltar el electrón s. 78 7. IONES. O: 2s2p4 Ninguno de los dos electrones apareados del oxígeno pueden desaparearse porque no tiene un subnivel vacío en el segundo nivel. El oxígeno solo puede tener valencia 2, pero eso no le ocurre al resto de su familia. S: 3s2p4d0 El azufre, aunque es de la misma familia que el oxígeno, está en el tercer nivel y, lo mismo que pasaba con el fósforo, ya si tiene un subnivel d completamente vacío a donde puede saltar el electrón s. F: 2s2p5 Algunos elementos tienden a obtener la estructura electrónica más estable, igual a la de los gases nobles, ganando o perdiendo electrones hasta tener la misma configuración electrónica del gas noble más cercano. Aquellos elementos que tienen uno, dos o tres electrones más que un gas noble tienden a perderlos para igualar su estructura electrónica, así: • Los metales alcalinos con configuración en la última capa ns1 tienden a perder el último electrón pasando así a iones M+ isoelectrónicos con el gas noble anterior. • Los metales alcalino−térreos tienen en la última capa ns2 y por tanto su tendencia es a perder dos electrones pasando a iones M2+. • El Aluminio que tiene configuración 1s2 2s2 2p1 tiende a perder 3 electrones y se convierte en el ión Al3+ isoelectrónico con el Helio. Al contrario ocurre con los elementos a los que les falta uno o dos electrones para completar la estructura de un gas noble, como es el caso de los halógenos que tienden a ganar 1e− y de los anfígenos que tienden a ganar 2e−. Cl: 3s2p5d0 Aquí conviene hacer una aclaración importante: Los electrones no están en el aire, ni en una caja. Los electrones están formando parte de los átomos. Dejando clara esta obviedad puedes comprender que la tendencia a ganar o perder electrones de un elemento y convertirse en ion no solo depende de él mismo, sino también del elemento con quien se junte, ya que los que los electrones que un elemento pierda otro debe ganarlos y viceversa. Así, si por ejemplo, el berilio frente al cloro cederá sus dos electrones convirtiéndose en iones Be2+ y 2 Cl–, pero cuando el berilio se combina con hidrógeno lo hace compartiendo electrones, aunque es verdad que el par de electrones del enlace esté más cerca del berilio por tener mayor electronegatividad, pero sin llegar a formarse los iones. Ejemplo 8: E1A.S2009 Considere el elemento cuya configuración es 1s2 2s2 2p6 3s2 3p4. a) De qué elemento se trata? b) Justifique el periodo y el grupo del sistema periódico a los que pertenece c) Cual será la configuración de su ión más estable? a) Para averiguar de qué elemento se trata no hay más que empezar a contar hasta llegar a 2+2+6+2+4=16 que son los electrones que tiene. Llegaríamos hasta el lugar que ocupa el Azufre. b) Está en el periodo n=3, como muestra en la configuración electrónica que es su última capa, y al tener configuración s2p4 pertenece al grupo 16, del oxígeno, llamados anfígenos. c) Como vemos, al azufre le faltan 2 electrones para tener la configuración del gas noble más cercano, así que su tendencia es a captarlos convirtiéndose en el ión S2−. 79 80 TEMA 3 ENLACE QUÍMICO ENLACE QUÍMICO Y PROPIEDADES DE LAS SUSTANCIAS Vamos a tratar de explicar: • Enlace iónico • • Estudio energético del enlace iónico. Ciclo de Born-Haber. Energía reticular Propiedades de los compuestos iónicos Enlace covalente según la Teoría de Lewis Porqué la mayoría de los elementos se unen formando moléculas u otros tipos de agregaciones. Porqué se unen en unas proporciones definidas. Porqué, por ejemplo el átomo de hidrógeno es muy inestable y se une a otro formando una molécula diatómica, mientras que el helio (como el resto de los gases nobles) es muy estable y no se une a nadie. Lewis y Kossel propusieron la regla del octete: Puesto que todos los cuerpos en la naturaleza tienen al estado de mínima energía y máxima estabilidad: Covalencia Dobles y triples enlaces Enlace coordinado o dativo 1. todos los átomos tienden a tener la estructura del gas noble más próximo (1s2 o bien ns2p6) por ser la más estable. 2. la estructura de gas noble la consiguen ganando, perdiendo o compartiendo electrones de su ultimo nivel energético, llamado también nivel de valencia. Predicción a la geometría molecular mediante el método de la repulsión de los pares de electrones de la capa de valencia: RPECV El resultado: cuando dos o más átomos se unen es siempre una estructura más estable que la de los átomos separados. Existen los siguientes tipos de enlace: Enlace Covalente según la teoría del Enlace de Valencia Concepto de Hibridación • • • • • Hibridación sp Hibridación sp2 Hibridación sp3 Dobles y triples enlaces Hibridación y RPECV Polaridad de un enlace. Enlace iónico, se forma por atracciones electrostáticas Enlace covalente, se forma por compartición de electrones Enlace metálico, propio de los metales Enlace por Puente de Hidrógeno (entre moléculas) Enlace de Van der Waals (entre moléculas) ENLACE IÓNICO Momento dipolar de la molécula • Propiedades de los compuestos covalentes • • El enlace iónico, como su nombre indica, es un enlace entre iones de distinto signo que se atraen por fuerzas electrostáticas de Coulomb. Tiene lugar entre elementos de electronegatividades muy diferentes. Los compuestos iónicos son sólidos muy estables y forman redes tridimensionales llamadas cristales. Cuando se encuentra, por ejemplo el cloro (muy electronegativo) y el sodio (muy electropositivo) el resultado es que el sodio suelta el electrón que le está estorbando y lo toma el cloro que estaba deseándolo. El resultado es que el sodio se convierte en un ión positivo con la configuración del neón y el cloro se transforma en un ión negativo con la configuración del argón. Ambos han conseguido la estructura de un gas noble, pero se han convertido en iones de distinto signo y entonces se atraen. 81 Na: 1s2 2s2p6 3s1 → Na+: 1s2 2s2p6 Cl: 1s2 2s2p6 3s2p5 → Cl− : 1s2 2s2p6 3s2p6 82 Lo que también puede representarse escribiendo los electrones de la última capa alrededor del símbolo del elemento y agrupándolos tal como están en los orbitales: Vamos a estudiar entonces el caso del NaCl con mas detalle. La Reacción de Formación es aquella en la que como único producto se obtiene 1 mol del compuesto a partir de los elementos que lo componen, todos ellos en estado normal, es decir cómo se encuentran a 1 amt de presión y 25ºC de temperatura, así que en este caso: 1 2 Na(s) + El cloro tiene sus 8 electrones en la última capa, como el argón (por eso se llama regla del octete) y el sodio también, porque ha perdido su electrón que tenía en el nivel 3 y ahora tiene sus 8 electrones en el nivel 2 como el neón. • Como la atracción electrostática es en todas direcciones, cada ión tiende a rodearse de tantos del signo contrario como puede y viceversa, de manera que la fórmula NaCl solamente indica la proporción en que se encuentran en el cristal. • El número de iones que rodean a otro del signo contrario se llama índice de coordinación y está en función del tamaño de los iones y de que se conserve la neutralidad del cristal, así en el CsCl el Ic = 8 y cristaliza en una red cúbica centrada en el cuerpo, mientras que en el NaCl el Ic = 6 (ya que el sodio es más pequeño que el cesio y por tanto no puede rodearse de tantos iones de cloro) y cristaliza en una red cúbica centrada en las caras: • Cl2(g) → NaCl(s) Como la energía e ionización (EI) es la energía necesaria para arrancar un electrón a un átomo en estado gaseoso y convertirlo en un ión positivo, lo primero que habría que hacer es pasar el sodio de sólido a gas, para lo que se necesita una energía llamada de sublimación (S). Como la afinidad electrónica (AE) es la energía desprendida cuando un átomo en estado gaseoso capta un electrón y se convierte en un ión negativo. Ya tenemos al cloro en forma de gas, pero formando una molécula, así que habrá que suministrar una energía para romperla llamada energía de disociación (D). Una vez que tenemos los iones gaseosos se forma el cristal y al hacerlo se libera una gran cantidad de energía llamada energía reticular (Ur). El ciclo sería el siguiente: Na(s) + 1 2 Cl2(g) 1 2 S CsCl Ic = 8 NaCl NaCl(s) D Na(g) + Cl(g) EI Qf Ur AE Na+(g) + Cl−(g) Ic = 6 Recorriendo el ciclo podemos poner que la energía de formación o calor de formación del cristal de NaCl a partir del sodio y del cloro es: Qf = S + 1 2 D + EI + AE + Ur Estudio energético del enlace iónico. Ciclo de Born−Haber. Sabemos que es necesaria una cierta energía para quitar el electrón al sodio (energía de ionización), mientras que el cloro desprende una cierta energía al ganarlo (afinidad electrónica). A primera vista puede parecer razonable que el enlace tendrá lugar cuando la AE sea mayor que la EI, pero en la mayoría de los casos no ocurre así, de manera que debe haber otros factores para que el producto final sea mas estable. El sodio tiene una EI de 5,1 eV y el cloro tiene una AE de solo –3,6 eV (el signo menos indica que es una energía desprendida, mientras que la consideramos positiva cuando la energía la aportamos nosotros). Como vemos es mayor la energía que hay que aportar para formar el ion positivo que la que se recupera cuando se forma el negativo, luego algo más debe haber y que tiene que ver con los estados de agregación de la materia. 83 Criterio de signos: A la hora de sustituir cada energía por su valor hemos de tener en cuenta que las energía desprendidas se consideran siempre negativas ( Qf, AE y Ur), mientras que las que aportamos se consideran positivas ( S, D y EI) Ejemplo 1: Calcular la energía de formación del NaCl a partir de los siguientes datos: Calor de sublimación del sodio = 26 Kcal/mol Energía de disociación de la molécula de cloro = 57,6 Kcal/mol Energía de ionización del sodio = 119,6 Kcal/mol Afinidad electrónica del cloro = −87 Kcal/mol Energía de red del NaCl = −184 Kcal/mol Escribimos el ciclo de Born−Haber y de él deduciremos que: 84 Qf = S + Qf = 26 + 1 2 1 2 • D + EI + AE + Ur 57,6 + 119,6 – 87 – 184 = − 96,6 Kcal/mol • El signo menos del calor de formación del NaCl indica que esa energía se libera y que al formarse el cristal de NaCl a partir de sus componentes se ha ganado en estabilidad. • Energía reticular: Propiedades de los compuestos iónicos. Se ha definido la energía de red como la energía que se desprende al formarse un mol de cristal a partir de los correspondientes iones gaseosos. Representa el trabajo que debemos realizar para romper el cristal y separar los iones que lo forman, de manera que cuanto mayor sea la energía de red, más estable será el cristal. La energía que tenemos que hacer para separar dos cargas es igual al trabajo que haríamos para coger una de las cargas desde el punto A donde se encuentra (distancia del enlace) y llevarla hasta el infinito. Teniendo en cuenta que por definición WA →∞ ,nosotros = ∆Ep y que la energía potencial en el infinito es cero, resulta que el trabajo que debemos hacer es igual a menos la energía potencial que la carga tiene en el punto A: Ejemplo 2: E5B.S2007 Supongamos que los sólidos cristalinos CsBr, NaBr y KBr cristalizan con el mismo tipo de red. a) Ordénelos de mayor a menor según su energía reticular. Razone la respuesta. b) Justifique cuál de ellos será menos soluble. a) La energía de red es directamente proporcional a la carga de los iones e inversamente proporcional a la distancia que los separa, que supondremos la suma del radio de los iones, por tanto: • U r = WA →∞ ,nosotros = ∆Ep = Ep ∞ − Ep A = − K q ⋅ q´ rA • donde K es la constante de Coulomb y rA es la distancia a la que se encuentran las cargas. Como las cargas tienen signo contrario, al sustituir nos daría un valor Ur +, lo que indica que hemos de realizar un trabajo para separar los iones y romper el cristal. Si en vez de considerar dos cargas aisladas se les supone formando parte de una red habría que introducir unas correcciones, que tienen que ver con el tipo de red. La Ur de los fluoruros de la familia de los alcalinos va disminuyendo, porque el tamaño de flúor no varía y los tamaños de los iones de Li+, Na+, K+ van haciéndose cada vez mayores, y por tanto la distancia que los separa. Si tomamos el litio como metal fijo y nos fijamos en la Ur de los cristales que forma con los halógenos, vemos que va disminuyendo, por el mismo motivo anterior, ya que ahora hemos fijado el tamaño del litio y el que va aumentando es el de F−, Cl−, Br− En las dos últimas filas puedes ver como influye la carga de los iones haciendo que aumente la Ur. La carga de los iones no influye, porque en todos los casos es la misma, +1 para el catión y −1 para el anión. La distancia que separa los iones si influye porque es diferente. El tamaño del Br− no influye porque es el mismo en todos los casos, así que nos fijaremos solo en el tamaño de los cationes, que son todos de la misma familia, y por tanto: tendremos que: r Na < r K < r Cs. Como la Ur es inversamente proporcional a la distancia que separa los iones, tendremos que: Ur NaBr > Ur KBr > Ur CsBr De lo anterior se deduce que la energía de red: • • Aumenta con la carga de los iones Disminuye con el tamaño de los iones, ya que al estar muy empaquetados, la distancia que los separa puede suponerse como suma del radio de los dos iones. b) Como veremos enseguida, para disolver un cristal hay que romperlo, y por lo tanto aquel que tenga mayor energía de red será más difícil de disolver. En consecuencia el menos soluble será el NaBr, porque tiene mayor Ur, y el más soluble el CsBr por tener la Ur más pequeña. Comparación de las energías de red (Ur en KJulios / mol) de algunas sales Cargas 1/1 1/1 1/1 2/1 2/2 Sólido Ur Sólido Ur LiF 1036 LiCl 853 NaF 923 NaCl 786 KF 821 KCl 715 −− − MgF2 2957 MgCl2 2526 MgO 4070 MgS 3368 Sólido LiBr NaBr KBr Ur 807 747 682 Sólido LiI NaI KI MgBr2 2440 MgI2 Ur 757 704 649 2327 Como era de esperar y se confirma en los valores de la tabla, por ejemplo: 85 86 Una vez que hemos entendido la energía de red y el papel que juega en la estabilidad del cristal podemos estudiar las propiedades de los compuestos iónicos y predecirlas. 1. Forman redes cristalinas. Cada ion tiende a rodearse de iones de signo contrario, formando una red cristalina, pero no moléculas individuales. En una red cristalina el número de átomos es indefinido, mientras que en una molécula es limitado. Todos los cristales son muy estables como prueba que tienen elevados puntos de fusión 2. Puntos de fusión y de ebullición elevados. Puesto que fundir o evaporar un cristal supone romperlo y debido a las elevadas fuerzas electrostáticas que mantienen unidos los iones, estos compuestos son sólidos a temperatura ambiente y sólo se funden a elevadas temperaturas, tanto mayores cuanto mayor es la energía de red. 7. Conductividad eléctrica. Los compuestos iónicos no conducen la corriente eléctrica en estado sólido porque los iones están inmovilizados en la red, pero cuando se encuentran fundidos o en disolución, sus iones poseen libertad de movimiento y entonces son buenos conductores de la corriente. Si introducimos dos electrodos conectados a una fuente de corriente continua veremos, con la ayuda de un amperímetro, que conduce la corriente. Es el proceso llamado electrolisis, y lo estudiaremos más adelante. 3. Son duros. La dureza es la dificultad que ofrece un cuerpo a ser rayado, y como para rayar estos compuestos hay que romper un gran número de enlaces, se entiende que su dureza sea elevada, tanto mayor cuanto mayor es la energía de red. 4. Son frágiles. Esto es debido a que un golpe puede originar un desplazamiento de los planos de los iones y, al dejar enfrentados iones de igual signo, daría lugar a una fractura en el cristal por fuerzas repulsivas electrostáticas. Un claro ejemplo es el diamante, que es muy duro, pero a la vez muy frágil. Aunque las reacciones que tienen lugar en la electrolisis de una disolución acuosa de cloruro sódico no vienen al caso, sí que conviene saber que los aniones (iones negativos) son atraídos hacia el polo positivo (ánodo), donde se descargan, y los cationes (iones positivos) van hacia el polo negativo (cátodo) donde también se descargan. 5. Resistencia a la dilatación. Debido a que para dilatar un cuerpo es necesario disminuir en parte las fuerzas que unen los iones, también podremos afirmar que ofrecen cierta dificultad a la dilatación. Ejemplo 3: E6A.S2005 Teniendo en cuenta la energía reticular de los compuestos iónicos, conteste razonadamente: a) ¿Cuál de los siguientes compuestos tendrá mayor dureza: LiF o KBr? b) ¿Cuál de los siguientes compuestos será más soluble en agua: MgO o CaS? 6. Solubilidad. Los compuestos iónicos son solubles en disolventes polares (como el agua) e insolubles o poco solubles en disolventes orgánicos no polares (como el benceno). Se disuelven en disolventes polares, en primer lugar porque tienen una constante dieléctrica grande con lo que la fuerza de Coulomb disminuye y porque los dipolos de estos disolventes rodean a los iones de la red cristalina y los van "arrancando" de la red. Cuando el cuerpo está disuelto, cada ion queda rodeado de moléculas del disolvente, entonces se dice que el ion está solvatado a) Rayar un cristal supone romper parte de los enlaces que mantiene unidos los iones en el cristal, así que aquel que tenga mayor energía de red será más duro. La energía de red es proporcional a la carga de los iones, que es la misma en ambos casos (+1/−1), e inversamente proporcional a la distancia que los separa. Como el litio es menor que el potasio, y además el flúor es menor que el bromo, podemos asegurar que la distancia del enlace en el LiF es mucho menor que en el KBr, y que por tanto la energía de red del LiF>KBr o lo que es lo mismo, que el LiF es el más duro. b) Solvatar un cristal supone romperlo en los iones que lo forman, de manera que aquel que tenga mayor energía de red será más difícil de disolver. Razonando como antes sobre los factores que afectan a la Ur, y teniendo en cuenta que la carga de los iones es la misma (+2/−2), y como el magnesio es más pequeño que el calcio y el oxígeno más pequeño que el azufre, la distancia del enlace en el MgO es menor que en el CaS, así la energía red del MgO> el CaS o lo que es lo mismo, que el CaS es más soluble. La disolución del cristal lleva consigo un desprendimiento de energía por las interacciones de los dipolos del disolvente con los iones del cristal, que en caso de ser mayor que la energía de red se traduce en la demolición del cristal y su disolución. En caso contrario el cristal no se disuelve. 87 88 ENLACE COVALENTE SEGÚN LA TEORÍA DE LEWIS Hay sustancias que ni disueltas ni fundidas conducen la corriente, por lo que su enlace no debe tener naturaleza eléctrica. Imaginemos la molécula de cloro (Cl2), que está formada por dos átomos de cloro. Como sabemos la configuración del cloro, en su última capa es, Cl: 3s2 3p5. Así que le falta un solo electrón para tener la configuración del argón, pero ahora el cloro no está frente a un alcalino deseando de perder su electrón, sino que está frente a otro cloro que tiene exactamente la misma tendencia a ganarlo. ¿Cómo se las arreglan para tener cada uno la configuración de gas noble?. Lewis propuso que un átomo puede compartir sus electrones desapareados con otro átomo y de esa manera aparearlos, por ejemplo, el cloro tiene sus electrones de la última capa de la forma: de esa manera el cloro puede compartir su electrón desapareado con el otro cloro. Los electrones compartidos ya dejan de pertenecer al átomo original y ahora pertenecen “a la vez” a ambos átomos, a si que en realidad por cada electrón que comparten lo que pasa es que ganan uno. El resultado es que cada átomo consigue su octete, es decir, la configuración de gas noble, aunque no siempre es así. De forma genérica puede decirse que el número de enlaces covalentes que forma un átomo es igual al número de electrones desapareados que tiene, que se llama covalencia. (el hidrógeno, como sabemos no tiende a tener 8 electrones en su última capa, sino solamente 2, como el helio.) Dobles y triples enlaces: Algunas veces entre dos átomos se pueden compartir dos o tres electrones, dando lugar a enlaces dobles o triples. Ese es el caso, por ejemplo, de la molécula de oxígeno, donde un oxigeno comparte 2 electrones con el otro oxígeno. lo mismo ocurre con la molécula de monóxido de carbono (CO) en la que el carbono exhibe valencia 2, y por tanto solo tienen dos electrones desapareados que son los que enlaza con los dos desapareados del oxígeno: Por ejemplo la molécula de Cl2 o la de cloruro de hidrógeno (HCl) o la de agua serían: lo mismo ocurre también en la molécula de dióxido de carbono (CO2), solo que en este caso el carbono presenta valencia 4 y forma un doble enlace con cada oxígeno: • • Al par de electrones que forman el enlace se les suele representar por una raya. Los dos electrones que están apareados, como ves, se dibujan juntos y se llaman par no−enlazante, porque no dan lugar a enlace. En el etino o acetileno ( HC ≡ CH ) cada carbono comparte tres electrones con el otro carbono y el cuarto electrón lo comparte con el hidrógeno: Para explicar el tetracloruro de carbono y el metano habría que tener en cuenta que el carbono exhibe 4 valencias y que por tanto su disposición electrónica sería con 4 electrones desapareados: y las moléculas de CCl4 y CH4 serían: 89 90 Enlace coordinado o dativo: En algunas ocasiones puede ocurrir que un solo átomo sea el que comparte los dos electrones el enlace, mientras que el otro átomo no aporta ninguno. El enlace se representa por una flechita que apunta al átomo receptor. Dos ejemplos típicos son el ión hidronio (H3O+) y el ión amonio (NH4+). Según que el átomo central esté rodeado de dos, tres, cuatro, cinco o seis pares de electrones, tiene una forma, respectivamente, lineal, plana, triangular, tetraédrica, de bipirámide trigonal y octaédrica. Pares de Pares e− No−enlazantes Át.central Geometría Ejemplos − lineal BeH2, BeF2, CO2 − triangular plana AlH3, BF3 1 V SO2 − tetraedo CH4, NH4+ 1 pirámide trigonal NH3, H3O+ 2 V H2O, SCl2 5 − Bipirámide trigonal PCl5 6 − octaedro SF6 2 Como veremos más adelante, el ión hidronio es la forma en que se presentan los protones en agua, porque se solvatan reaccionando con el agua como se indica más arriba, pero también existen en el agua pura por reacción de dos moléculas de agua, dando lugar a un ión hidronio y a un hidroxilión: 2H2O ⇔ H3O+ + OH− Distribución e− Aplicada a un ejemplo concreto 3 El ión amonio, se forma de manera parecida. El nitrógeno del amoníaco tienen un par de electrones no−enlazantes y los aporta al enlace con un protón dando lugar al ión amonio. 4 Lo importante es que una vez formado el enlace dativo los enlaces son indistinguibles PREDICCIÓN A LA GEOMETRÍA MOLECULAR MEDIANTE EL MÉTODO DE LA REPULSIÓN DE LOS PARES DE ELECTRONES DE LA CAPA DE VALENCIA. La estructura de Lewis es un modelo útil para visualizar “en el plano del papel” la distribución de los pares de electrones de una molécula. El modelo de RPECV nos ayuda a predecir la geometría de las moléculas en el espacio. Se basa en la teoría de Lewis y en una idea muy simple: los pares de electrones que rodean al átomo central (sean pares de electrones enlazantes o no−enlazantes) se repelen entre sí y por tanto: • • • los pares de electrones de los enlaces que rodean a un átomo central se sitúan unos respecto de otros de tal manera que queden lo más alejados posible. adoptarán la distribución geométrica más simétrica posible para que la repulsión sea mínima. Los pares de electrones no enlazantes suelen ejercer una mayor repulsión sobre los pares enlazantes lo que se traduce en una cierta deformación de la estructura. Lo primero que hay que hacer es dibujar la estructura de Lewis y ver el número de pares de electrones que rodea al átomo central. Si respecto al átomo central hay algún enlace múltiple (doble o triple) se considera como uno sencillo, aunque teniendo en cuenta que, al estar formado por cuatro o seis electrones, la repulsión que ejerce sobre los pares de electrones de enlaces sencillos es mayor y se producirá cierta distorsión. 91 Pasos para predecir la geometría de una molécula por el método de RPECV: 1. Identificar al átomo central y determinar la covalencia que tiene. 2. Configuración electrónica de acuerdo a la covalencia que presenta en la molécula y distribución de los electrones de valencia. 3. Estructura de Lewis 4. Contar los pares de electrones alrededor del átomo central (sean enlazantes o noenlazantes) y según el número de pares se decide la geometría de la molécula para que, de acuerdo a la teoría de RPECV, la repulsión electrónica sea mínima. (Acuérdate que los dobles y triples enlaces cuentan como uno solo) 5. Si hay pares de electrones no−enlazantes se dibuja el orbital con dos puntitos. 6. Acuérdate que los pares no−enlazantes, debido a la repulsión electrónica deforman la molécula haciendo que se cierre y que los ángulos de los enlaces sean ligeramente menores 92 Ejemplo 1: E1A.S2008 Deduzca, según la teoría de Repulsión de Pares de Electrones de la Capa de Valencia, la geometría de las siguientes moléculas e indique la polaridad de las mismas: a) Amoniaco. b) Tricloruro de boro. c) Metano. c) La molécula de CH4 ya la hemos visto, y tiene estructura tetraédrica perfecta. a) 1.- En el amoníaco, NH3, el átomo central es el nitrógeno y su covalencia es 3. 2.- La configuración electrónica de la última capa del nitrógeno es 2s2p3 y como vemos tiene 3 electrones desapareados, por eso precisamente su covalencia es 3: ENLACE COVALENTE SEGÚN LA TEORÍA DEL ENLACE DE VALENCIA. Esta teoría, de Heitler y London, tiene su base en la mecánica cuántica y se basa en que: como vemos en la forma que tiene dispuestos los electrones, tiene un par no−enlazante (que serían los 2 electrones que están en el subnivel s) y tres pares enlazantes (los electrones en los subniveles px, py y pz) • Cada átomo puede formar tantos enlaces como pares de electrones tiene desapareados, lo que se llama covalencia. • Energéticamente, a medida que los átomos se acercan desde el infinito su energía potencial va disminuyendo hasta llegar a un mínimo que coincide con la distancia del enlace. Para distancias más pequeñas la energía aumenta muy rápidamente porque los núcleos se repelen. A distancias mayores a las del enlace también la energía es mayor, lo que equivale a separar los átomos. • Los átomos se van acercando hasta que los orbitales atómicos semillenos de cada átomo se “solapan” dando lugar al enlace a la distancia a la que la energía potencial es mínima. • Hay dos tipos de enlaces: Si el solapamiento tiene lugar entre orbitales s+s, s+p o p+p del mismo eje, entonces el solapamiento es máximo y el enlace se denomina σ. Cuando se solapan orbitales p+p paralelos, el solapamiento es más pequeño y el enlace se llama π y naturalmente son más débiles que los σ. 3.- La estructura de Lewis de acuerdo con esto sería: 4.- Como el nitrógeno tiene 4 pares de electrones (1 no−enlazante y 3 enlazantes), de acuerdo con la teoría de RPECV, para conseguir una mínima repulsión adoptará la estructura tetraédrica, de manera que el nitrógeno estaría en el centro de una pirámide y los enlaces estarían dirigidos hacia los vértices: 5.- Si en los 4 vértices del tetraedro hubiera un hidrógeno el ángulo de enlace sería de 109º28’ (como ocurre en el CH4) que es lo que corresponde a un tetraedro perfecto, sin embargo el nitrógeno tiene un par no−enlazante que comprime la molécula por repulsión (lo que se indica con la flechas en verde) y eso hace que el ángulo de enlace sea ligeramente menor, siendo realmente de 107º8’ b) Haciendo el mismo razonamiento, solo que ahora de forma más concisa: En la molécula de BCl3 al tener los tres enlaces iguales, el ángulo de enlace sería exactamente de 120º. Hay que tener en cuenta que la molécula de BCl3 es plana (tiene los 4 átomos en el mismo plano), mientras que la de NH3 no lo es. Tiene los tres hidrógenos en el mismo plano y el átomo de nitrógeno por encima: 93 94 Dobles y triples enlaces: Cuando dos átomos se enlazan mediante un doble o un triple enlace uno de ellos es de tipo σ, como los simples, y el resto siempre son del tipo π. Un enlace doble está formado por 1 σ + 1 π. Un enlace triple es 1 σ + 2 π. Imaginemos la molécula de oxígeno, que como sabemos tiene estructura 1s2 2s2p4 y tiene 2 electrones desapareados, y por tanto covalencia 2 y formará 2 enlaces. Cuando los dos átomo de oxígeno se acerquen: • • Vamos a ver como se formarían algunas moléculas de acuerdo con la teoría del Enlace de Valencia. Por ejemplo el hidrógeno, como sabemos tiene 1 electrón en su orbital 1s, de manera que se irían acercando los átomos hasta que se solapen los orbitales 1s de los hidrógenos, dando lugar a un enlace σ. Los orbitales p que tienen la misma dirección se solapan frontalmente sin problemas y dan lugar a un enlace σ. Los orbitales p que son paralelos, se solapan con más dificultad y forman un enlace del tipo π, que se representa con unas rayas uniendo los dos lóbulos de cada orbital. La molécula de nitrógeno se explica de la misma forma. El nitrógeno que tiene configuración estructura 1s2 2s2p3 y tiene 3 electrones desapareados, y por tanto covalencia 3 y formará enlaces. Uno de ellos, el que se forme por solapamiento de orbitales p en la misma dirección será σ y los dos restantes que se forman entre orbitales p paralelos serán del tipo π. ahora los electrones pueden moverse por esa nube mayor, lo que sería una especie de orbital molecular. El agua, donde el átomo central es el oxígeno, con una configuración 1s2 2s2p4 resulta que tiene dos electrones desapareados y que por tanto formará dos enlaces σ por solapamiento de éstos con los orbitales 1s del hidrógeno: CONCEPTO DE HIBRIDACIÓN De acuerdo con esto, en la molécula de agua el ángulo de enlace sería de 90º. La molécula de flúor, por ejemplo, teniendo en cuenta que tiene una configuración 1s2 2s2p5, resulta que el electrón desapareado y que por tanto formará enlace está en uno de los orbitales p, así que estos orbitales son los que se solaparían dando lugar a un enlace σ. El átomo central del metano (CH4) es el carbono que tiene configuración 1s2 2s2p2 y donde, como sabemos, un electrón 2s salta al nivel p, dando lugar a 4 electrones desapareados: 2s1px1py1pz1. Por ese motivo puede enlazarse con 4 átomos de hidrógeno. Hasta aquí todo normal, pero el estudio de los enlaces revela que todos son exactamente iguales, sin importar si el solapamiento tuvo lugar con un orbital s o un orbital p. Lo mismo puede decirse del BeCl2, o del AlH3, etc Esto hace pensar que “previamente” a la formación de un enlace covalente, los orbitales atómicos de la capa de valencia se combinan obteniéndose el mismo número de orbitales, pero ahora todos son idénticos, llamados híbridos. 95 96 Cada uno de los orbitales atómicos que se combina es diferente y tiene distinta energía (s, px, py, pz dxy…), mientras que los orbitales híbridos obtenidos son todos exactamente iguales y equivalentes. • En el CH4 el carbono forma 4 enlaces sencillos σ por lo que es necesario que hibriden los OA: s1 + px1 + py1 + pz1 → 4 híbridos sp3 semillenos. → 4 enlaces σ. • En el NH3, el nitrógeno debe formar 3 enlaces sencillos σ. Debe combinar (empezando siempre por el s) tantos OA como sea necesario hasta tener 3 semillenos. Puesto que en este caso el s está lleno (y no nos vale para enlazar) debe tomar: s2 + px1 + py1 + pz1 . Al haber tomado 4OA se forman 4 híbridos equivalentes, uno de ellos está lleno (como lo estaba el OA de partida) y por tanto no da lugar a enlace, formando solamente 3 enlaces σ. • Parecido ocurre en el agua. El oxígeno tiene el orbital 2s lleno y el px también lleno, así que para formar 2 enlaces debe combinar s2 + px2 + py1 + pz1 → 4 híbridos sp3 , dos de los híbridos estarán llenos y los otros dos semillenos que son los que formarán enlace. Ahora la pregunta sería ¿y cuántos OA se combinan en cada caso?. Se combinan tantos OA de la capa de valencia del átomo central, “comenzando siempre por el s (de menor energía)”, como enlaces σ (simples) deba formar, teniendo en cuenta que obviamente solo nos valen aquellos OA semillenos. Los orbitales atómicos que no hibridan quedan tal y como son. Así tenemos distintos tipos de híbridos: Hibridación sp: Si se combina un orbital s con uno p se obtienen dos orbitales híbridos equivalentes llamados sp, que es lo que ocurre con el berilio cuando forma BeCl2, BeBr2, Be(CH3)2, etc. • En primer lugar el berilio promociona uno de sus electrones 2s2 a un orbital 2p • Como el berilio debe formar 2 enlaces sencillos es suficiente con que se combinen 1s y el px. Como combinan 2 AO el resultado son 2 orbitales híbridos equivalentes llamados sp, que forman ángulo de 180º • Por último se solapan con los orbitales atómicos de los átomos con los que enlaza formando un enlace σ en cada solapamiento. Hibridación sp2: Si se combinan un orbital s con dos p se obtienen tres orbitales híbridos equivalentes llamados sp2, que es lo que ocurre cuando forma H3Al, BF3, etc. (SO2, el caso de enlaces múltiples lo trataremos a continuación) Tipo Orbitales moleculares que se combinan Orbitales híbridos Ejemplos sp BeCl2 BeBr2 Be(CH3)2 sp2 H3Al BF3 SO2 Hibridación sp3: Si se combinan un orbital s con tres p se obtienen cuatro orbitales híbridos equivalentes llamados sp3, que es lo que ocurre cuando forma CH4, NH3, H2O, etc. La diferencia entre los tres casos es que: 97 98 sp3 sp3d 3 2 sp d Dadas las moléculas de CF4 y NH3: a) Represente sus correspondientes estructuras de Lewis b) Establezca su geometría mediante la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. c) Indique la hibridación del átomo central CH4 NH3 H2O a) Para formar el tetrafluoruro de carbono, el carbono debe presentar 4 electrones desapareados, por lo que uno de los electrones 2s2 debe saltar a un orbital p vacío del mismo nivel: PCl5 El flúor que tiene configuración 2s2p5 tiene un electrón desapareado y por tanto cada átomo de flúor formará un enlace, por eso son necesarios 4 átomos para aparear a los 4 electrones del carbono: SF6 Como vemos cada átomo ha conseguido rodearse en su última capa de los mismos electrones que el gas noble neón. Pasos para predecir la hibridación del átomo central la geometría de una molécula: 1. Identificar al átomo central y determinar la covalencia que tiene. 2. Configuración electrónica de acuerdo a la covalencia que presenta en la molécula y distribución de los electrones de valencia. 3. Empezando por el orbital s se toman tantos orbitales atómicos como sean necesarios para poder formar los enlaces σ que tenga (enlaces simples). 4. Obtendremos tantos orbitales híbridos como OA hayamos combinado y su nombre hace referencia al número de OA de partida. (sp cuando se combinó s+px; sp2 cuando se combinó s+px+py; sp3 cuando se combinó s+px+py+pz, etc) 5. Los híbridos determinan las direcciones de los enlaces y por tanto la geometría que más tarde tendrá la molécula. (Los híbridos sp forman ángulo de 180º → lineal; los híbridos sp2 forman ángulo de 120º y están en un plano → estructura trigonal plana; los híbridos sp3 forman ángulos de 109º → estructura tetraédrica 6. Acuérdate que los pares no−enlazantes, debido a la repulsión electrónica deforman la molécula haciendo que se cierre y que los ángulos de los enlaces sean ligeramente menores Hibridación y RPECV: Como puedes ver, la hibridación de orbitales lleva a los mismos resultados que el método de Repulsión de Pares de Electrones de la Capa de Valencia (RPECV). La diferencia es que los orbitales híbridos se forman antes del enlace, como si el átomo se preparase para ello y la geometría de la molécula es una consecuencia de la propia hibridación. Por el contrario, el método de RPECV explica la geometría como una exigencia posterior al enlace para evitar al máximo la repulsión de los pares de electrones. En el amoníaco, el nitrógeno con una configuración 2s2p3 ya presenta los tres electrones desapareados necesarios para formar los tres enlaces con el hidrógeno. b) Vemos que el átomo central en ambas moléculas involucra a 4 pares de electrones, por lo que de acuerdo con el modelo de RPECV para que la repulsión sea mínima debe adoptar la estructura tetraédrica. La diferencia está en que mientras el carbono forma los 4 pares son enlazantes y forma 4 enlaces dirigidos hacia los vértices de un tetraedro perfecto, el nitrógeno tiene un par no−enlazante que hará que los ángulos de enlace se cierren ligeramente: c) Como ya hemos razonado, tanto el C como el N en esas moléculas involucran a 4 pares de electrones y por tanto combinan linealmente 1 orbital s con tres p dando lugar a híbridos equivalentes sp3 que apuntan hacia los vértices de un tetraedro. Al formar los enlaces se harían en esas direcciones, llegando a la misma conclusión que con el modelo de RPECV. Ejemplo 2: E4A.S2009 99 100 Dobles y triples enlaces: • • • Cuando dos átomos se enlazan mediante un doble o un triple enlace: Siempre uno de ellos es de tipo σ (como los simples) y el resto siempre son del tipo π. Se forman tantos híbridos como enlaces σ deba formar el átomo central. Los enlaces π se forman a partir de los OA semillenos que hayan quedado sin hibridar. Ejemplo 3: E3B.S2008 Vamos a ver la estructura del eteno (CH2=CH2). Lo primero, como siempre, es ver la disposición de los electrones del átomo central. Indique, razonadamente, cuántos enlaces π y cuántos σ tienen las siguientes moléculas: a) Hidrógeno. b) Nitrógeno. c) Oxígeno. Los tres elementos, como sabemos, son gaseosos y forman moléculas diatómicas. Como el carbono forma 3 enlaces sencillos, solo necesitamos 3 híbridos. Por tanto de los 4 OA que podrían combinarse basta con que combinen s1 + px1 + py1 , con lo que obtendremos tres híbridos sp2 (en verde) y nos quedará el orbital pz que al no haber participado mantiene su forma original de doble lóbulo en dirección del eje Z (en azul). Una vez que el átomo de carbono ha hibridado así, se une al otro carbono solapando un híbrido de cada uno para dar lugar al enlace σ y solapando el orbital pz de cada uno para dar lugar al enlace π. Ahora vamos a ver la estructura del etino (HC≡CH). El proceso es casi el mismo, solo que ahora el carbono forma 2 enlaces sencillos y solo necesitamos 2 híbridos. Por tanto de los 4 OA que podrían combinarse basta con que combinen s1 + px1 , con lo que obtendremos dos híbridos sp (en verde) y nos quedarán los orbital py y pz que al no haber participado mantienen su forma original de doble lóbulo en dirección de los ejes Y y Z (en azul). Para responder a la cuestión de forma razonada hay que partir de la configuración electrónica de cada átomo. A partir de ella deduciremos el número de enlaces que forman Del número de enlaces que tenga uno de ellos será simple, de tipo σ, y los restantes, si los hay, de tipo π Nº electrones Configurac. e− desapareados Enlaces Hibridación = nº de enlaces 1s1 1 1σ Ninguna (*) 1s2 2s2p3 3 1σ 2π sp 1s2 2s2p4 2 1σ 1π sp2 Forma molécula (*) Recuerda que la hibridación se forma por combinación lineal de orbitales atómicos. Como el hidrógeno solo tiene un orbital (1s) no tiene con quien combinarse. El enlace se forma por solapamiento del orbital 1s de cada hidrógeno. 101 102 POLARIDAD DE UN ENLACE. Ejemplo 4: E4B.S2006 El enlace iónico y el enlace covalente son dos casos extremos que tienen lugar entre átomos de electronegatividades muy diferentes o entre átomos de la misma electronegatividad, pero la mayoría de los casos están entre esos extremos. Dadas las siguientes moléculas: F2 , CS2 , C2H4 , C2H2 , H2O y NH3 . Indique en cuál o cuáles: a) Todos los enlaces son simples. b) Existe algún doble enlace. c) Existe algún triple enlace. a) Todos los enlaces son simples: F2 , H2O y NH3 b) Existe algún doble enlace: CS2 , C2H4 (CH2=CH2) c) Existe algún triple enlace: C2H2 (HC≡CH) Vamos a describir solamente la molécula de disulfuro de carbono (CS2), las restantes ya se han tratado suficientemente. Por cierto que esta molécula es exactamente igual que la de dióxido de carbono (CO2) • • • • El azufre, lo mismo que el oxígeno tiene dos electrones desapareados y por tanto covalencia 2. Como hay dos oxígenos, es necesario que el carbono presente valencia 4. Con cada oxígeno formará 2 enlaces (uno σ y otro π) El carbono en total forma 2 enlaces σ y otros 2 π. Como el carbono necesita formar 2 enlaces π, en su hibridación necesita reservar 2 orbitales atómicos que no hibridarán. Por tanto la hibridación solo puede ser entre el subnivel s y uno p, dando dos híbridos sp, con lo que la molécula ya sabemos que será lineal. • Cuando dos átomos de cloro de unen mediante un enlace covalente, como ambos átomos tienen la misma electronegatividad, los electrones del enlace estarán a la mitad de la distancia entre los dos núcleos. Se dice que la molécula es apolar. • Cuando el enlace tenga lugar entre dos átomos distintos, como en el HCl, los electrones del enlace estarán más cerca del átomo más electronegativo, porque tira de ellos con más fuerza, de manera que la nube electrónica se deformará (porque es más probable encontrarlos en las inmediaciones del átomo más electronegativo), dando lugar a un dipolo y se dice que la molécula es polar. • Es muy importante tener en cuenta que a pesar de que una molécula sea polar, sigue siendo eléctricamente neutra porque en conjunto tiene las mismas cargas positivas que negativas, lo que ocurre es que las tiene repartidas de forma desigual, así en las en las proximidades del átomo más electronegativo hay un predominio de carga negativa (δ–) mientras que en torno al átomo menos electronegativo hay un predominio de carga positiva (δ+). Se ha formado un dipolo. Aclararemos que en física, un dipolo no es más que dos cargas iguales de distinto signo, (+q y –q) separadas una distancia d. A la magnitud que lo mide se le llama momento dipolar (µ), que es un vector y tiene de módulo el producto de la carga por la distancia que las separa, y su dirección y sentido apunta hacia la carga negativa. Se mide en Debye, 1D = 3,34.10−30 C.m Según esto, podemos clasificar los enlaces, en covalente puro cuando tiene lugar entre dos átomos de la misma electronegatividad, iónico puro cuando la diferencia de electronegatividades es muy grande y el resto, que son la mayoría de los casos, será una mezcla de ambos. Pauling estimó que para una diferencia de electronegatividades de 1,7 el enlace será 50% covalente y 50% iónico. 103 104 molécula enlace Polaridad del enlace Cl2 Covalente puro o apolar Los electrones del enlace están equidistantes de los núcleos, porque la electronegatividad es la misma. HCl Covalente polar Los electrones del enlace están más cerca del elemento más electronegativo. El enlace es polar. Iónico puro El átomo más electronegativo se ha llevado al electrón del más electropositivo y ahora no está compartido. Se han convertido en iones. NaCl Momento dipolar de la molécula: • Puesto que el momento dipolar es un vector, puede ocurrir que una molécula no tenga momento dipolar neto, aunque sus enlaces individualmente considerados sí lo posean; tal es el caso del Be2Cl o del CO2, en el que cada doble enlace C=O está polarizado, pero la molécula, al ser totalmente lineal, no lo está: O=C=O. Los dipolos, aunque globalmente son neutros, pueden interaccionar exactamente igual que las moléculas con carga neta, aunque la energía de esa interacción será comparativamente menor dado que la carga presente también lo es. Ejemplo 5: E2B.S2007 Dadas las moléculas BF3 y PF3: a) ¿Son polares los enlaces boro−flúor y fósforo−flúor? Razone su respuesta. b) Prediga su geometría a partir de la teoría de Repulsión de Pares de Electrones de la Capa de Valencia. c) ¿Son polares esas moléculas? Justifique su respuesta. a) El flúor es el elemento más electronegativo de todos, así que sea cual sea el elemento que se enlace con el flor dará lugar a un enlace polarizado, lógicamente, tanto más cuanto mayor sea la diferencia de electronegatividad. Por tanto en este caso los dos enlaces están polarizados. En el enlace B→F algo más que el P→F, puesto que la electronegatividad del boro es 2 y la del fósforo 2,1. b) Pasando por alto los razonamientos, la hibridación en el caso del B es sp2 y la geometría triangular plana, mientras que el fósforo hibrida sp3 con una par no−enlazante y da lugar a una estructura tetraédrica: • • Exactamente igual le ocurre a la molécula de BF3, que al ser triangular plana y los tres átomos iguales, aunque los enlaces están polarizados B→F, globalmente dan momento dipolar nulo para la molécula. Y lo mismo puede decirse para el CH4, que tiene estructura tetraédrica. Los 4 enlaces están polarizados H→C, pero como están dirigidos hacia los vértices de un tetraedro regular su resultante es nula, y el momento dipolar del metano es cero. c) Aunque todos los enlaces están polarizados, como hemos razonado, en el caso del BF3 el momento dipolar de la molécula será nulo, porque sería la suma de tres vectores iguales, contenidos en el mismo plano y que forman ángulo de 120º. Sin embargo en el caso del PF3 sí que tiene momento dipolar no nulo porque la suma de los tres vectores no es nula al no estar los tres vectores en el mismo plano. Resumiendo: Para que una molécula sea polar debe ocurrir que: 1º Tenga enlaces polares y 2º que además que no tenga simetría que haga que los momentos dipolares de los enlaces se anulen. Comprender la polaridad de los enlaces y el momento dipolar de las moléculas ha sido de gran ayuda para establecer su geometría. Por ejemplo, sabemos que los enlaces del agua están polarizados, ya que la electronegatividad del oxígeno es 3,5 frente a la del hidrógeno que es de 2,1, y además sabemos que el agua tiene un momento dipolar no nulo. Eso nos lleva necesariamente a que los enlaces del agua son en V, ya que si fuera lineal el momento dipolar de ambos enlaces se anularía: 105 106 FUERZAS INTERMOLECULARES: PROPIEDADES DE LOS COMPUESTOS COVALENTES • • Es muy fuerte: El hecho de que el enlace covalente tenga lugar por compartición de electrones hace que sea muy fuerte, mucho más que el enlace iónico. Por tanto los compuestos covalentes son más estables que los iónicos. Forman moléculas aisladas: Los compuestos iónicos, como hemos visto, forman grandes redes, y la fórmula solamente indica la proporción en la que los iones se encuentran en el cristal, mientras que los compuestos covalentes forman moléculas aisladas, siendo las fuerzas que mantienen unidas unas moléculas a otras fuerzas muy pequeñas. Bajos P. Fusión y Ebullición: Puesto que la fuerza de cohesión entre moléculas es muy débil, en general los compuestos covalentes suelen se gaseosos o líquidos y cuando son sólidos tienen bajos puntos de fusión y de ebullición. Los puntos de fusión y ebullición de los compuestos iónicos son elevados porque fundirlos o evaporarlos supone romper el cristal, es decir romper los enlaces iónicos que los forman, sin embargo cuando se funde o evapora un compuesto covalente no se rompen los enlaces sino que simplemente se rompen las pequeñas fuerzas que mantienen unidas unas moléculas a otras y por ese motivo son muy bajos y la mayoría de estos compuestos son líquidos o gases a temperatura ambiente. No son solubles en agua: Como los compuestos covalentes puros no son polares no se disuelven en agua, aunque sí en disolventes no polares. Por el mismo motivo no conducen la corriente eléctrica. Naturalmente a medida que aumenta la polaridad del enlace se van haciendo más conductores • • Ya hemos visto que el enlace covalente da lugar a moléculas aisladas. Algunos compuestos covalentes son líquidos y sólidos, por tanto sus moléculas deben estar unidas unas a otras por algún tipo de enlace o de lo contrario serían totalmente independientes, es decir gaseosas. Estas fuerzas que mantienen unidas las moléculas deben ser muy débiles porque los compuestos covalentes tienen puntos de fusión y ebullición relativamente bajos. Las fuerzas entre moléculas son de naturaleza dipolar, es decir, se deben a la atracción electrostática entre dipolos. Los casos mas característicos son el enlace por puente de hidrógeno y las fuerzas de Van der Waals. FUERZAS DE VAN DER WAALS Son fuerzas de atracción dipolo−dipolo que tienen lugar entre moléculas. Estas fuerzas tienen lugar tanto si las moléculas son polares como si son apolares. • • Entre moléculas polares, como cloruro de hidrógeno, se comprende fácilmente que esos dipolos permanentes se atraigan por fuerzas electrostáticas. También tienen lugar entre moléculas apolares, como el cloro, y ello se explica teniendo en cuenta que en el continuo movimiento de los electrones hay momentos en los que se produce una distribución no uniforme de la carga, lo que provoca un dipolo instantáneo, que es capaz de producir dipolos inducidos en las moléculas circundantes. Las fuerzas de Van der Waals son muy débiles y aunque son fuerzas electrostáticas, curiosamente aumentan al aumentar el volumen molecular, porque cuanto más alejados se encuentren los electrones del núcleo más fácil será que se deformen las capas electrónicas externas dando lugar a dipolos instantáneos. Eso explica que los puntos de fusión y ebullición de las moléculas de los halógenos aumenten al bajar en la familia: F2 Cl2 Br2 I2 P.F P.E Estado (ºC) (ºC) en C.N −223 −188 Gas −102 −34 Gas −7 59 Líquido 114 185 Sólido Ejemplo 2: E3B.S2009 Dala la molécula de CCl4: a) Represéntela mediante estructura de Lewis b) ¿Porqué la molécula es apolar si los enlaces están polarizados? c) ¿Porqué a temperatura ambiente el CCl4 es líquido y el CI4 es sólido? 107 108 Ejemplo 4: E5A.S2008 b) El carbono hibrida sp3 y por tanto la molécula de CCl4 tiene estructura tetraédrica. El enlace C−Cl está polarizado porque el cloro tienen mayor electronegatividad que el carbono, pero al ser todos los enlaces iguales y tener simetría tetraédrica el momento dipolar de la molécula, que es el resultante de los cuatro enlaces resulta nulo. Indique qué tipo de enlace hay que romper para: a) Fundir cloruro de sodio. b) Vaporizar agua. c) Vaporizar n−hexano. a) Fundir cloruro de sodio: El Na y Cl está unido mediante enlace iónico y por tanto forma una red cristalina que habrá que romper, para lo que se necesita gran cantidad de energía b) Vaporizar agua. En el H2O el enlace es covalente y por tanto forma moléculas que están unidas entre sí por fuerzas de Van der Vaals y además por puente de hidrógeno, ya que el oxígeno es muy electronegativo c) Vaporizar n−hexano: Los enlaces son covalentes aunque estén algo polarizados debido a la diferencia de electronegatividad entre carbono (2,5) e hidrógeno. Las moléculas están unidas solamente por fuerzas de Van der Waals que son muy débiles, y por tanto fáciles de separar. c) Las moléculas de CCl4 están unidas entre sí mediante fuerzas de Van de Walls, lo mismo que las de CI4 y la fuerzas de estas uniones entre moléculas es la que determina el estado de agregación. Como las fuerzas de Van de Waals aumentan con el tamaño molecular, porque de esa forma las nubes electrónicas se deforman con más facilidad dando lugar a dipolos instantáneos, es predecible que sean mayores en el CI4 y por tanto que sea un sólido, mientras que en el CCl4 las fuerzas son más pequeñas y las moléculas tengan más libertad para moverse, siendo un gas. El razonamiento que hemos hecho justifica que, en condiciones normales, el NaCl sea un sólido, el agua es un líquido y el n−hexano es una gas. Ejemplo 3: E5A.S2009 a) Justifique la naturaleza del enlace que se formará cuando el oxígeno se combine con calcio b) Justifique la naturaleza del enlace que se formará cuando el oxígeno se combine con hidrógeno c) ¿Cuál de los dos componentes formados tendrá mayor punto de fusión? Razónelo ENLACE POR PUENTE DE HIDRÓGENO Si se analizan los puntos de ebullición de los hidruros de la familia del oxígeno veremos que aumentan progresivamente con el tamaño molecular tal como se representa en la figura: a) Puesto que el oxígeno es un elemento bastante electronegativo y el calcio es electropositivo, es predecible que el enlace tendrá un mayor porcentaje iónico. El calcio con estructura [Ar] 4s2 tiende a perder los dos electrones de su última capa transformándose en el ión Ca2+ con estructura del argón. El Oxígeno, con estructura [He] 2s2p4 tiene tendencia a ganar dos electrones para alcanzar la estructura del neón, transformándose en el ión O2−. b) Como l diferencia de electronegatividad entre el oxígeno y el hidrógeno no es muy grande el enlace tendrá mayor porcentaje covalente (aunque polar) y se formará por solapamiento de los orbitales. Concretamente el oxígeno hibrida sp3 y tiene dos pares no−enlazantes y dos pares enlazantes que son los que solaparán con los orbitales 1s de los dos hidrógenos. c) Como el CaO tiene carácter iónico formará una red, mientras que el H2O que tiene carácter covalente formará moléculas aisladas. Es evidente que es mucho más difícil fundir el CaO, porque ello supone romper la red (que además es bastante estable porque la carga de los iones es 2/2) mientras que separar las moléculas de agua es mas fácil porque solamente está unidas por puentes de hidrógeno y fuerzas de Van der Waals y ambas son muy débiles. 109 Por extrapolación el agua debería ser un gas a temperatura ambiente y su punto de ebullición debería ser de –80ºC, y sin embargo es un líquido y su PE son 100ºC. Al mismo resultado llegaríamos si se analizan los puntos de fusión. Para explicar que tanto el PF como el PE del agua sean anormalmente altos, lo primero que se le ocurre a cualquiera es pensar que las moléculas de agua están unidas entre sí por fuerzas mayores a las de Van der Waals como en el resto de los hidruros. Estas fuerzas son el enlace o puente de hidrógeno que se representa por una línea de puntos. 110 ENLACE METÁLICO Los metales son un conjunto de elementos que tienen unas propiedades muy características: La explicación de esta atracción entre moléculas es la siguiente: • • • Los elementos muy electronegativos tiran hacia sí de los electrones del enlace dejando una carga positiva residual muy grande en torno al hidrógeno. Debido a la pequeñez del átomo de hidrógeno éste puede acercarse mucho al otro elemento haciendo que la fuerza atractiva sea grande. (recuerda que la fuerza de atracción es inversamente proporcional al cuadrado de la distancia) En el caso del oxígeno del agua, además hay otra razón: que el oxígeno es pequeño y tiene dos pares de electrones no enlazantes, lo hace que la carga residual esté bastante concentrada. El enlace por puente de hidrógeno se forma entre el hidrógeno y los elementos muy electronegativos, como el F, O, N y Cl, siendo su fuerza de mayor a menor en este orden, como su electronegatividad (en el caso del HF es el responsable de que realmente esta molécula sea un dímero a temperatura ordinaria H2F2). Es el responsable de los PF y PE anómalamente altos de todos estos hidruros y de que sean líquidos a temperatura ambiente. • • • • • • • • • • • Todos son sólidos, a excepción del mercurio que es líquido. Densidad elevada Brillo metálico Buenos conductores de la electricidad Buenos conductores del calor Emiten electrones al calentarlos (efecto termoiónico) Emiten electrones al iluminarlos (efecto fotoeléctrico) Ductilidad (facilidad para ser estirados en hilos) Maleabilidad (facilidad para laminarlos) Tenacidad (son difíciles de romper) Los PF y PE son variables de unos a otros, pero en general son altos Como estas propiedades no pueden explicarse mediante el enlace diferente iónico o covalente, es evidente que debe haber otro las pueda explicar y se conoce como enlace metálico. Vamos a pensar en el sodio que, como sabemos, tiene un solo electrón en la última capa y tiene configuración [Ne] 3s1. Podríamos pensar que formase un enlace covalente con otro sodio, con lo que se obtendrían moléculas de Na2 gaseoso, cosa que no ocurre, porque el sodio es un sólido en CN, y además porque al compartir un electrón no conseguiría una configuración especialmente estable. La explicación es que el átomo de sodio comparte su electrón, por solapamiento de su orbital 3s con tantos átomos de sodio como puede, dando lugar a una red, en la que el electrón puede moverse libremente de uno a otros átomos. Es como si hubiera una nube de electrones que se mueven entre los iones positivos de la red. El enlace hidrógeno, como las fuerzas de Van der Waals, es debido a la atracción dipolo−dipolo entre moléculas, pero no se trata de un enlace entre átomos y no debe confundirse con el iónico o el covalente que hemos estudiado y que son mucho más fuertes. El enlace de hidrógeno tiene lugar en todo tipo de moléculas, siempre entre hidrógeno y un elemento muy electronegativo. Por ejemplo entre dos moléculas de un ácido carboxílico o entre un grupo carboxilo y otro amino. Precisamente este motivo es el responsable de la estructura en doble hélice del ADN. El sodio forma una red cúbica centrada en el cuerpo, similar a la del CsCl, pero donde naturalmente alrededor de cada sodio hay otros 8 sodios, y de forma parecida se comportan el resto de los metales Ejemplo 1: E2B.S2008 Razone si son verdaderas o falsas las siguientes afirmaciones: a) Algunas moléculas covalentes son polares. b) Los compuestos iónicos, cuando están fundidos o en disolución, son buenos conductores de la electricidad. c) El agua tiene el punto de ebullición más elevado que el resto de los hidruros de los elementos del grupo 16. Una explicación mas detallada del enlace metálico la tenemos en la teoría de bandas, que dejaremos para los temas de ampliación, pero ahora nos vale este modelo simple para explicar las propiedades de los metales: • 111 Al formar redes similares a las redes cristalinas se explica que sean sólidos con densidad elevada, ya que son redes muy compactas. 112 • • Que los electrones se muevan libremente entre los restos positivos de la red explica que sean buenos conductores de la electricidad, ya que aunque los electrones se mueven aleatoriamente, la libertad que tienen para moverse hace que la existencia de un campo eléctrico los oriente creando una corriente (en el sentido contrario al campo). Lo mismo se explica su conductividad térmica y que con relativa poca energía puedan arrancarse del metal como ocurre al calentarlos o iluminarlos. La ductilidad, maleabilidad y tenacidad se explican también porque al ser todos los restos del mismo signo y estar compactados por la nube de electrones, cuando el metal se golpea los restos se recolocan sin que haya repulsiones como pasaba en los cristales iónicos, donde al enfrentarse los iones del mismo signo hacía que se rompiera el cristal: TEORÍA DE BANDAS. CONDUCTORES, SEMICONDUCTORES Y AISLANTES Como hemos visto, en los metales los electrones de valencia no están sujetos a sus átomos respectivos, sino que pueden moverse libremente entro de la estructura metálica y por eso son buenos conductores. Por el contrario en los cuerpos aislantes todos los electrones están fuertemente ligados a sus respectivos átomos, de forma que habría que aplicar campos eléctricos muy grandes para arrancarlos. Entre una y otra situación se encuentran los semiconductores, los cuales a bajas temperaturas son aislantes y se vuelven conductores al aumentar la temperatura. (El efecto de la temperatura en los metales es justo el inverso, ya que al aumentarla, aumenta la energía cinética de los electrones y el número de choques entre ellos y los restos positivos, con lo que se entorpece la corriente y conduce peor.) Vamos a ver como se puede explicar mediante la teoría de bandas: Sabemos que los electrones de un átomo están ocupando unos determinados niveles de energía (n=1, 2, 3..) los cuales se componen a su vez de subniveles (s, p, d, f..) y éstos de orbitales, en cada uno de los cuales caben 2 electrones como máximo. Cuando muchos átomos se aproximan, entonces sus orbitales atómicos (OA) se combinan para dar un número igual de orbitales moleculares (OM), la mitad de ellos de menor energía y la otra mitad de mayor energía que los de partida, es decir más inestables: Ejemplo 5: E2B.S2009 Razone sobre la veracidad o falsedad de las siguientes afirmaciones: a) La molécula de BF3 es apolar aunque sus enlaces está polarizados b) El cloruro de sodio tiene menor punto de fusión que el cloruro de cesio c) El cloruro de sodio sólido no conduce la corriente eléctrica y el cobre sí Los n orbitales atómicos son, naturalmente, todos iguales y equivalentes y a partir de ellos se obtienen n orbitales moleculares que se diferencian tan poco en energía que se suceden de forma casi continua y por eso se le llama banda. a) Verdad. Al ser el flúor mucho más electronegativo que el boro, tirará de los electrones hacia sí, y el enlace F−B estará polarizado. No obstante el boro, que es el átomo central, hibrida sp2 y por tanto la molécula de BF3 es triangular plana y la suma vectorial de los momentos dipolares de los tres enlaces da un vector nulo, con lo que la molécula es apolar De acuerdo con esto, los electrones están restringidos a moverse en determinadas bandas y para pasar de unas a otras deben absorber o emitir energía, de forma parecida a lo que ocurre con los electrones en los átomos aislados. b) Falso, ya que la energía de red necesaria para romper el cristal de NaCl es mayor que para romper el CsCl, porque ésta es inversa a la distancia que separa los átomos y al ser el ión del sodio más pequeño que el del cesio, su energía de red es mayor. Conductores: Para explicarlo vamos a utilizar al litio, que como sabemos tiene 3 electrones: 2 en el nivel 1s y 1 en el nivel 2s, este último es el electrón de valencia. La situación para el litio sería: c) Verdad a medias. Es verdad que el cobre siempre es un buen conductor porque al tener un enlace metálico dispone de una nube de electrones que pueden moverse con facilidad entre los restos positivos del metal. Sin embargo el NaCl no conduce la corriente en estado sólido, pero sí se funde o se disuelve entonces sí que es conductor (conductor de segundo orden) porque una vez que rompamos la red el resultado son los iones que naturalmente al tener carga conducen. En este caso, la banda de valencia (la que contiene a los últimos electrones) está semillena y por tanto pueden moverse saltando a los OM vacíos con relativa facilidad siendo conductor. En este caso la banda de valencia hace de banda de conducción. 113 114 • Algunas veces la banda de valencia está vacía, como le pasa a los metales alcalino−térreos, pero en esta situación puede ocurrir dos casos: a) Que la banda que sigue en energía a la banda de valencia esté solapada con ella, con lo que los electrones pueden moverse por la que está vacía y por eso se le llama banda de conducción: Debido a los “huecos”. Cuando un electrón deja la banda de valencia, een el lugar que ocupaba deja un hueco que puede ser ocupado por otro electrón y así sucesivamente. Vamos a representar un cristal de silicio, que tiene una estructura tetraédrica como el diamante, pero que para más facilidad la vamos a dibujar en el plano. Puede verse como cada átomo de silicio forma cuatro enlaces covalentes con los cuatro átomos vecinos: b) Que la banda de valencia llena y la banda vacía que le sigue estén separadas por una zona prohibida muy pequeña, de manera que a temperatura ambiente los electrones tienen energía suficiente para saltarla y moverse por la banda vacía: Aislantes: En los aislantes la banda de valencia se encuentra llena y la que le sigue se encuentra separada por una zona prohibida muy grande, de forma que incluso a temperatura elevada los electrones son incapaces de superarla. Los electrones no pueden saltar a la banda vacía, que sería la de conducción, y el material es aislante. Semiconductores extrínsecos: El silicio y germanio son semiconductores naturales o intrínsecos, pero se puede mejorar su rendimiento añadiendo unas determinadas impurezas en su proceso de fabricación, proceso que se llama dopaje. Se pueden obtener así dos tipos de semiconductores: de tino n y de tipo p. Semiconductores de tipo n: Se obtienen añadiendo pequeñas cantidades de elementos del grupo 15 (nitrogenoideos), como por ejemplo arsénico, ya que tiene 5 electrones en la última capa. Al ser muy parecido encaja en la red, pero como solo puede formar 4 enlaces con los silicios vecinos, el quinto electrón queda suelto y puede moverse a temperatura ambiente por la red de silicio. Semiconductores: Para estos, como el silicio y el germanio la situación es similar a la de los aislantes, pero la zona prohibida es mas pequeña (de 1,1 eV para el silicio y 0,7 eV para el germanio). El resultado es que los electrones, cuando la temperatura es baja no pueden pasar a la banda de conducción y por tanto se comportan como aislantes. Sin embargo cuando la temperatura aumenta (o se establece un campo eléctrico adecuado, o por efecto fotoeléctrico) los electrones adquieren energía suficiente para saltar a la banda de conducción, dentro de la que ya pueden moverse, con lo que tendríamos un conductor. En este caso la conductividad es debida a esos electrones sobrantes y por eso se les llama semiconductores de tipo n. Si aumentamos la temperatura empezarán a romperse enlaces covalentes con lo que tendremos nuevos electrones libres y huecos, tal como se explicó antes. La conductividad eléctrica tiene lugar por dos mecanismos distintos: • Debida a los electrones que saltan a la banda de conducción, dentro de la que pueden moverse. 115 116 Semiconductores de tipo p TEMA 4 Se obtienen cuando se añaden pequeñas cantidades de elementos del grupo 13 (térreos), como por ejemplo Boro, los cuales tienen solo tres electrones de valencia. ENERGÍA DE LAS REACCIONES QUÍMICAS. ESPONTANEIDAD. El boro encaja en la red del silicio, pero como tiene un electrón menos en uno de los enlaces covalentes queda un hueco, el cual a temperatura ambiente puede ser ocupado por otro electrón próximo que a su vez dejará otro hueco y así sucesivamente. Puede decirse que la conducción tienen lugar por huecos. Como los huecos son portadores de carga positiva a estos semiconductores se les llama de tipo p. Termoquímica. Conceptos previos. Trabajo Energía. tipos de energía Concepto de sistema Funciones de estado Primer principio de la termodinámica Calor de reacción a volumen constante Calor de reacción a presión constante. Entalpía Ecuaciones termoquímicas En los semiconductores de tipo n, los electrones libres se encuentran en una banda muy próxima a la de conducción, pudiendo saltar fácilmente a ella y volverse conductores. En los de tipo p lo que hay es una banda vacía muy próxima a la banda de valencia, por lo que los electrones de valencia pueden saltar fácilmente a ella y conducir. Poniendo en contacto un semiconductor de tipo p con otro de tipo n se obtiene un diodo, y uniendo tres semiconductores, como si fuera un bocadillo, se obtiene un transistor pnp o bien npn. 117 Diagrama entálpico Entalpía o calor de combustión Entalpía o calor de disociación Entalpía o energía de enlace Entalpía de una reacción Entalpía o calor de cambio de estado Entalpía o calor de disolución Ley de Hess Entalpía de formación Segundo principio de la termodinámica. Entropía Energía libre de Gibbs Espontaneidad de las reacciones químicas Energía libre estándar 118 TERMOQUÍMICA. CONCEPTOS PREVIOS. donde, m es la masa del cuerpo, ce es una constante característica del cuerpo llamada calor específico, e ∆T es la variación de temperatura. En las reacciones químicas las transformaciones que afectan a la materia, por lo general, van acompañadas de un intercambio de energía cuyo estudio macroscópico es el objeto de la termodinámica. (No confundas el calor con la temperatura porque con cosas diferentes. La temperatura es una medida de la energía cinética media de las partículas de un cuerpo, mientras que el calor es la energía que se transfiere espontáneamente del cuerpo que está a mayor temperatura al que está a menor temperatura hasta que ambos tienen la misma. Físicamente un cuerpo tiene temperatura, pero no tiene calor. Observa la relación anterior e imagina dos cuerpos de la misma masa a los que comunicamos el mismo calor. Resulta evidente que la variación de temperatura de cada uno dependerá de su calor específico. Por eso, cuando le da el sol al agua, que tiene ce grande, aumenta poco su temperatura, pero si le da el mismo calor a la arena, que tiene ce pequeño, su temperatura aumenta mucho y nos quema.) La energía es la capacidad que tiene un sistema para producir un trabajo. (El trabajo y todas las formas de energía se miden en Julios, aunque hay otras unidades como la caloría, eV, etc.) El trabajo, por definición es igual al producto escalar de la fuerza por el vector desplazamiento. Suponiendo que la fuerza sea constante, para un desplazamiento lineal ∆x: • W = F ⋅ ∆x ⋅ cos α si la fuerza y el desplazamiento tienen la misma dirección y sentido, α=0 y su coseno es 1, pero si tienen sentido contrario, α=180 y su coseno es –1. Quiere decir que el trabajo puede ser positivo o negativo. En las reacciones donde intervienen gases el trabajo lo puede realizar: la presión atmosférica cuando el sistema se comprime o bien la presión de los gases que se producen en la reacción cuando el sistema se expande. El dibujo corresponde a una reacción en la que hay más moles de gases al final que al principio y por tanto el volumen que ocupan los productos es mayor del que ocupaban los reactivos, por ejemplo, podría tratarse de la combustión del alcohol etílico, donde hay 3 moles de gases al principio y 5 al final: CH3CH2OH(l) + 3O2(g) → 2CO2(g) + 3H2O(g) Teniendo en cuenta que, por definición, la presión (que se debe a los continuos choques de las moléculas del gas contra la superficie que los encierra) es igual a la fuerza por unidad de superficie (P=F/S) Como en todas las reacciones se rompen enlaces y se forman otros nuevos, según sea el balance energético de los enlaces rotos y formados, el resultado puede ser que en la reacción se absorba energía o se desprenda, normalmente en forma de calor. La cantidad de calor desprendido o absorbido en una reacción se llama calor de reacción igual a la energía de enlaces rotos menos enlaces formados. El calor de reacción es característico para cada reacción, aunque depende de la presión y temperatura, por lo que suele tabularse para las Condiciones Estándar de 1 atm y 25ºC. Cuando en una reacción se desprende calor se llama exotérmica Cuando absorbe calor para que tenga lugar se llama endotérmica. Un sistema es una pequeña parte del universo separada de lo que lo rodea por unas paredes reales o imaginarias. Los sistemas se clasifican en : • Wgas = F ⋅ ∆x = P ⋅ S ⋅ ∆x = P ⋅ ∆V • Wgas = P ⋅ ∆V • De la misma manera que si una fuerza no produce desplazamiento no realiza trabajo, si una reacción transcurre a volumen constante tampoco hay trabajo. Hay muchas formas de energía y todas pueden convertirse entre sí y en trabajo. Las más importantes son: • • • • Energía cinética: Debida al movimiento de un cuerpo. Energía potencial: Debida a la posición de un cuerpo en un campo conservativo. Energía electromagnética: Debida a la interacción del campo eléctrico y el magnético. Calor o Energía térmica: El calor es una energía "que se transfiere espontáneamente" entre dos cuerpos que se encuentran a diferente temperatura, hasta que ambos alcanzan el equilibrio térmico, es decir tienen la misma temperatura. El calor que gana el cuerpo que está a menor temperatura o que pierde el que estaba a mayor temperatura es: Energía química: Asociada a los enlaces entre átomos y entre moléculas, por tanto es una especie de energía potencial debida a la fuerza que los mantiene unidos. Abiertos: pueden intercambiar materia y energía con exterior. Por ejemplo una reacción en un recipiente abierto Cerrados: pueden intercambiar solo energía con el exterior. Por ejemplo una reacción en un recipiente cerrado Aislados: no pueden intercambiar ni materia ni energía con el exterior. Por ejemplo una reacción en un recipiente cerrado y a su vez dentro de un termo. También se clasifican en homogéneos o heterogéneos, según que la composición de todo el sistema sea la misma o varíe. Un gas sería un sistema homogéneo y una mezcla de agua y hielo sería uno heterogéneo. El estado global o macroscópico de un sistema se define mediante unas variables llamadas Funciones de Estado que tienen un valor independiente del camino seguido por el sistema para llegar a ese estado. Son funciones de estado la Presión, el Volumen, la Temperatura, la Composición y Concentración de cada componente, la Energía Interna, la Entalpía, la Entropía y la Energía Libre de Gibbs. El trabajo y el calor no son funciones de estado, puesto que su valor depende del camino seguido en la evolución del sistema, sin embargo como veremos, en el caso de que la reacción tenga lugar a volumen constante o a presión constante el calor sí sería FE. PRIMER PRINCIPIO DE LA TERMODINÁMICA q = m ⋅ c e ⋅ ∆T 119 120 El primer principio enunciado por Clausius dice que “la energía total de un sistema aislado permanece constante”. Por tanto, no es más que una forma alternativa de enunciar la ley de conservación de la energía, “la energía ni se crea ni se destruye”. experimentas (∆U) porque será igual a los billetes que ingreses (+q) más las monedas que ingreses (+W) más los billetes que saques (−q) y más las monedas que saques (−W) Ejemplos de signos del calor: Cada molécula posee una energía característica que depende principalmente de los enlaces de sus átomos y se llama energía interna (U) y es la suma de la cinética y de la potencial de todas las partículas que la forman. • • La energía interna es una función de estado porque solamente depende de la naturaleza de los reactivos y de los productos. No es posible conocer su valor, aunque es posible calcular las variaciones en un proceso en función del calor y del trabajo intercambiado. Supongamos una reacción cualquiera A + B → C + D. Como cada compuesto tiene su propia energía interna característica, la energía interna de los reactivos será UA+UB y la energía interna de los productos UC+UD. Ahora puede ocurrir dos cosas: que disminuya la energía interna y en tal caso en la reacción se desprenderá energía que sobra o bien puede ocurrir que aumente la energía interna en cuyo caso la reacción absorberá la energía que falta. Como termodinámicamente la energía se transfiere en forma de calor o mediante la realización de un trabajo el primer principio se escribe como: • • Ejemplos de signos del trabajo: En la mayoría de las reacciones el único trabajo es debido a una variación del volumen, y como hemos visto antes W = P∆V . Aquí tenemos dos posibilidades: • Reacciones en las que los productos ocupen menos volumen que los reactivos, es decir que disminuya el volumen. Obviamente esa contracción se debe al trabajo realizado por la presión atmosférica, así que es un trabajo que se hace desde fuera sobre el sistema y de acuerdo al criterio de signos, el trabajo es positivo. Un ejemplo sería la síntesis de amoníaco: N2(g) + 3 H2(g) → 2 NH3(g) • Reacciones en las que los productos ocupen más volumen que los reactivos. En este caso el trabajo de expansión lo hace la propia reacción. Como el trabajo lo hace la reacción de acuerdo al criterio de signo es negativo, por ejemplo: 2 C(s) + O2(g) → 2 CO(g) ∆U = q + W Se lee que la variación de la energía interna de un sistema (energía interna de los productos menos la energía interna de los reactivos) será igual a la suma del calor y del trabajo transferidos con el sistema. Criterio de signos: Algunas veces para que ocurra una reacción química necesitamos aportar energía (en forma de calor o de trabajo) y otras veces con la reacción se libera energía (en forma de calor o de trabajo), por tanto necesitamos adoptar un criterio de signos tanto para el calor como para el trabajo según se hagan desde fuera sobre la reacción o según que se desprendan en la reacción. El criterio de signos de la IUPAC considera positivo todo lo que entra al sistema porque suma (calor o trabajo) y negativo lo que sale. Las reacciones endotérmicas son aquellas en las que se absorbe calor, es decir, tenemos que aportar calor desde fuera para que ocurran. En este caso, de acuerdo al criterio de signos, el calor es positivo. Un ejemplo sería la descomposición térmica del carbonato de calcio: CaCO3 + q → CaO + CO2 Las reacciones exotérmicas son aquellas que desprenden calor, es decir, el calor sale de la reacción como si de un producto más se tratara. De acuerdo al criterio de signos el calor liberado es negativo. Un ejemplo es la combustión del metano: CH4 + 2 O2 → CO2 + 2 H2O + q Ahora bien, si te fijas en cualquiera de los dos supuestos, por ejemplo veamos el primero. Si los productos ocupan menos volumen que los reactivos (∆V=‒), la presión atmosférica ha debido realizar un trabajo externo sobre el sistema para comprimirlo con lo que, de acuerdo con el criterio de signos, al entrar trabajo al sistema la energía interna debe haber aumentado (∆U=+). Quiere decir que, para “adaptar” el primer principio al criterio de signos debemos escribirlo como: ∆U = q − P∆V De esta forma cuando haya un aumento de volumen el trabajo restará (porque lo hace el sistema) y cuando haya una contracción el trabajo sumará (porque lo hace la presión atmosférica. Ten en cuenta que si disminuye el volumen ∆V es negativo y menos por menos es más). De esa forma la expresión es equivalente a ∆U = q + W y se adecua al criterio de signos. Para entenderlo, imagina que la energía interna es el dinero que tienes en tu bolsillo. Nadie puede saber cuánto tienes, pero sí podemos conocer la variación del dinero que 121 Naturalmente, aunque este criterio de signos es el recomendado por la IUPAC, podríamos adoptar el contrario y en ese caso el primer principio se escribiría con el segundo término sumando. 122 CALOR DE REACCION A VOLUMEN CONSTANTE Cuando una reacción se lleva a cabo en un recipiente cerrado a volumen constante, obviamente ∆V=0, por tanto el primer principio de la termodinámica nos quedaría que: Ejercicio 1: Si una reacción absorbe un calor de 100 J y realiza un trabajo de 70 J en expandirse ¿cuánto vale la variación de energía interna? ∆U = q v La aplicación del primer principio es muy sencilla. Imagínate que el sistema es tu pantalón y la energía interna el dinero que tienes en un momento. El dinero que entra lo consideras positivo (porque suma al que ya tienes) y el que sale negativo. Bueno, pues si en un bolsillo metes 100€ y del otro sacas 70€, ¿cuál será la variación de dinero del sistema? Obviamente +30€. es decir, que a volumen constante (proceso isócoro): • • El calor de reacción a volumen constante es igual a la variación de energía interna el sistema El calor de reacción a volumen constante es una función de estado, puesto que U lo es. CALOR DE REACCION A PRESIÓN CONSTANTE. ENTALPÍA Lo que has hecho ha sido sumar, pero teniendo en cuenta los signos, según que el dinero entre y sume al que ya hay (positivo) o salga y nos reste, así, tu cuenta ha sido: ∆Dinero=100+(−70)=30 €. Fíjate que no hemos podido saber el dinero que tenías en el pantalón, solo hemos calculado su variación. Eso pasa con le energía interna, que no podemos calcular su valor solo sus variaciones. La mayoría de las reacciones ocurren en recipientes abiertos y por tanto a presión constante, la atmosférica. Para el estudio de estos procesos a presión constante, y en los que generalmente el volumen varía, se define una magnitud llamada Entalpía como: Utilizando las magnitudes que vienen al caso sería: H = U + PV ∆U = q + W = 100 − 70 = 30 Julios • • • esta reacción correspondería a una reacción endotérmica (absorbe calor) en la que intervienen gases y hay más moles de gases en los productos que en los reactivos (de ahí el trabajo de expansión) Muchas veces el calor se mide en calorías. En este caso debes ponerlo en julios, que es la unidad internacional, teniendo en cuenta que 1 J = 4,18 calorías La entalpía es una energía, puesto que U y PV tienen dimensiones de energía La entalpía es una función de estado porque U, P y V lo son. No se puede conocer la entalpía de un estado del sistema, porque no se puede conocer U, pero sí la variación de entalpía entre dos estados del sistema Si escribimos el primer principio para una reacción que tiene lugar a presión constante (por tanto el calor en juego le llamaremos qp): ∆U = q p − P∆V despejando q p = ∆U + P∆V = U 2 − U 1 + PV2 − PV1 = H 2 − H 1 = ∆H q p = ∆H lo que quiere decir que en una reacción a presión constante el calor de reacción: • El calor de reacción a presión constante es igual a la variación de entalpía • El calor de reacción a presión constante es una función de estado, puesto que la entalpía lo es. • El primer principio podemos escribirlo también como ∆U = ∆H − P∆V 123 124 RELACIÓN ENTRE Qv y Qp ECUACIONES TERMOQUÍMICAS Teniendo en cuenta que el primer principio de la termodinámica puede escribirse como ∆U = ∆H − P∆V y teniendo en cuenta que q v = ∆U y que q p = ∆H podemos escribir que: Una ecuación termoquímica no es más que una ecuación normal, en la que además se escribe la energía que se pone en juego, por ejemplo: C(s) + O2(g) → CO2(g) + 393,5 kJ q v = q p − P ∆V • En las reacciones en que solo intervienen sólidos y líquidos, como las variaciones de volumen son despreciables, tenemos que ∆U = ∆H o bien que q v = q p • En las reacciones donde intervienen gases, si tenemos en cuenta la ecuación general de los gases perfectos, W = P∆V = ∆nRT, el primer principio puede escribirse como más arriba o bien como ∆U = ∆H − ∆nRT o bien q v = q p − ∆nRT Quiere decir que en aquellas reacciones donde intervengan gases el calor de reacción a volumen y a presión constante son diferentes, siempre y cuando haya variación en el número de moles de gases de reactivos y de productos. Por ejemplo: Quiere decir que por 1 mol de carbono reacciona con 1 mol de oxígeno y da lugar a 1 mol de dióxido de carbono y se desprende un calor de 393,5 kJulios. Es por tanto una reacción exotérmica. Sin embargo es más frecuente escribirlo de la siguiente forma: C(s) + O2(g) → CO2(g) En una reacción exotérmica el calor se desprende y por eso, de acuerdo con el criterio de signos, ∆Ho es negativo. A veces también suelen combinarse ambos conceptos y la reacción sería: C(s) + O2(g) → CO2(g) + 393,5 kJ H1 C(s) + O2(g) → CO2(g) 2 C(s) + O2(g) → 2 CO (g) En la primera reacción hay 1 mol de reactivos gaseosos y un mol de productos gaseosos, por tanto al no haber variación del número de moles qv = qp. Eso es predecible ya que, de acuerdo con la hipótesis de Avogadro, al haber antes y después el mismo número de moles (si no varía la presión ni la temperatura) ocupan el mismo volumen. Dicho de otra forma, el volumen no varía aunque la reacción no se haga en un recipiente cerrado. En la segunda reacción hay una variación de moles gaseosos de ∆n = 2−1 = 1mol, por tanto los calores no son iguales. En este caso: qv = qp – 1.RT. Como vemos el calor a volumen constante es menor, y también es predecible, ya que al haber más moles de gases al final, el sistema ocupa un volumen mayor, de acuerdo con Avogadro, por tanto el sistema debe realizar un trabajo para expandirse ( W = P∆V = ∆nRT ) y por eso la energía resultante es menor. (Siempre que haya más moles de gases al final que al principio ∆n será positivo, corresponderá a una expansión del sistema y el trabajo restará, siendo qv < qp ) 125 ∆Ho = −393,5 kJ ∆Ho = −393,5 kJ H2 ten en cuenta que si se desprende calor es porque la energía de los reactivos es mayor que la de los productos y por tanto desciende la entalpía. Puedes comprenderlo mejor mirando el siguiente diagrama entálpico: Por el contrario, en una reacción endotérmica se absorbe calor, y por tanto la energía de los productos es mayor que la de los reactivos y en consecuencia ∆H es positiva: 126 Como sabemos, la variación de entalpía es el calor puesto en juego a presión constante q p = ∆H , y podemos particularizarlo para diferentes situaciones, así: • Entalpía o calor de combustión de una sustancia es la energía desprendida cuando arde completamente 1 mol de sustancia a la presión de 1 atmósfera. La entalpía de combustión de algunas sustancias es: Sustancia Hidrógeno Carbono Metano Etanol Reacción de combustión H2(g) + 1/2 O2(g) → H2O(l) C(s) + O2(g) → CO2(g) CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(g) CH3CH2OH(l) + 3O2(g) →2 CO2(g) + 3H2O(g) ∆Hcombust − 286 kJ/mol − 390 kJ/mol − 880 kJ/mol − 1360 kJ/mol Es muy importante reparar que se define como energía que se desprende cuando se quema “1 mol”, y que por tanto debemos procurar que el coeficiente de la sustancia sea 1. Por la misma razón observa que las unidades de ∆H en la tabla son kJ/mol, y sin embargo las unidades cuando se añade a la reacción son solo kJ, porque en este caso ya se está teniendo en cuenta el coeficiente y por tanto los moles que se han quemado: H2(g) + 1/2 O2(g) → H2O(l) 2 H2(g) + O2(g) → 2 H2O(l) pero para • Entalpía o calor de disociación de una sustancia es la energía necesaria para descomponer 1 mol de sustancia en los átomos que la forman “en estado gaseoso.” Sustancia Hidrógeno Nitrógeno Oxígeno Flúor Cloro • ∆Ho = −286 kJ ∆Ho = 2*(−286 kJ) Ecuación de disociación H2(g) → 2 H(g) N2(g) → 2 N(g) O2(g) → 2 O(g) F2(g) → 2 F(g) Cl2(g) → 2 Cl(g) ∆Hdisociac. + 436 kJ/mol + 946 kJ/mol + 494 kJ/mol + 50 kJ/mol + 240 kJ/mol Entalpía o energía de enlace de un enlace puede definirse de dos formas: Es la energía necesaria para romper 1 mol de dichos enlaces y separar los átomos “en estado gaseoso". Es un concepto similar a la energía de red de un cristal. CH4(g) + 1660 kJ → C(g) + 4H(g) ∆H = + 1660 kJ Pero también puede definirse como: Es la energía que se desprende cuando se forma 1 mol enlaces a partir de los átomos en estado gaseoso. C(g) + 4H(g) → CH4(g) + 1660 kJ ∆H = – 1660 kJ De cualquiera de las dos reacciones anteriores se deduce que, puesto que el metano tiene 4 enlaces C−H, la energía del enlace C−H será cuarta parte de la energía de la reacción, igual a 415 kJ/mol. En el caso del enlace H–H coincide con la entalpía de disociación porque es exactamente lo mismo, pero no es lo mismo la energía de los enlaces O–O o del N–N que la energía de disociación del O2 o del N2, ya que los átomos de estas 127 moléculas están unidos por un doble y triple enlace respectivamente. Sin embargo las entalpías de enlace O=O y N≡N sí que coinciden con las respectivas entalpías de disociación de O2 y N2. Enlace H−H C−H N−H O−H C−C C−N C−O N−N O−O Energía (kJ/mol) 436 415 390 460 347 285 352 159 146 Enlace C=C C=N C=O N=N O=O C≡C C≡N N≡N Energía (kJ/mol) 610 615 730 418 494 830 887 946 Obviamente cuanto mayor sea la energía de un enlace más fuerte y más estable es. Por otro lado hay que tener en cuenta que los valores tabulados corresponden a energías medias, porque dependiendo de la moléculas la energía de estos enlaces puede variar ligeramente. A partir de las energías de enlace puede calcularse la entalpía de una reacción, puesto que como sabemos en una reacción se rompen unos enlaces y se forman otros nuevos, de manera que podemos decir que: ∆Hreacción = ∑ EnlacesRotos − ∑ EnlacesFormados (en realidad esto es solo cierto para reacciones en las que solo intervienen gases, puesto que cuando se forman sólidos o líquidos además intervienen las energías de unión entre moléculas, cosa que no ocurre en los gases) Ejemplo: E2A.S2008 Para la siguiente reacción: CH4(g) + 4 Cl2(g) → CCl4(g) + 4 HCl(g) Calcule la entalpía de reacción estándar utilizando: a) Las entalpías de enlace. b) Las entalpías de formación estándar. Datos: Entalpías de enlace en kJ/mol: (C−H) = 415; (Cl−Cl) = 244; (C−Cl) = 330; (H−Cl) = 430. ∆Hºf[CH4(g)]=−74’9 kJ/mol, ∆Hºf [CCl4(g)]=−106’6 kJ/mol, ∆Hºf [HCl(g)]=−92’3 kJ/mol. a) Teniendo en cuenta que la entalpía de la reacción es igual a la suma de los enlaces rotos menos los formados: ∆Hreacc = ∑ EnlacesRotos − ∑ EnlacesFormados teniendo en cuenta que se rompen 4 enlaces C−H y 4 enlaces Cl−Cl y se forman 4 enlaces C−Cl y 4 enlaces H−Cl ∆Hreacc = (4*C−H + 4*Cl−Cl) – (4*C−Cl + 4*H−Cl) 128 Sabemos que la entalpía es una función de estado, es decir, que no depende de los pasos intermedios, sino solamente de las sustancias iniciales y finales. Ello permitió a Hess decir que: Cuando una reacción puede escribirse como suma de varias reacciones, la entalpía de la primera es igual a la suma de la entalpía de las reacciones intermedias. ∆Hreacc = (4*415 + 4*244) – (4*330 + 4*430) = –404 kJ b) La entalpía de la reacción, también se puede calcular de forma parecida, como veremos más adelante, como la suma de la entalpía de formación de los productos menos la suma de la entalpía de formación de los reactivos: ∆H°reacc = ∑∆H°f (productos) − ∑∆H°f (reactivos) Por ejemplo la combustión del carbono hasta formar CO2 puede tener lugar en un solo paso como: ∆H1 = −393,5kJ C(s) + O2(g) → CO2(g) ∆H°reacc = (∆H°CCl4 + 4*∆H°HCl) – (∆H°CH4 + 4*0) o bien puede realizarse en los dos pasos siguientes: C(s) + ½O2(g) → CO(g) ∆H°reacc = (–106,6 + 4*−92,3) – (–74,9) = –400,9 kJ • Entalpía o calor de disolución de una sustancia es la energía intercambiada cuando se disuelve 1 mol de sustancia La variación de entalpia cuando se disuelve una sustanciar puede considerarse como la suma de dos energías: la energía requerida para romper determinados enlaces (soluto-soluto y disolvente-disolvente) y la energía liberada para la formación de nuevos enlaces (soluto-disolvente), por tanto puede ser que ∆HDisolución sea negativa o positiva. Sustancia Ecuación de disolución en agua H2SO4(conc) H2SO4 (conc) +2 H2O →2 H3O+ + SO4= − 74,8 kJ/mol LiCl (s) LiCl(s) → Li + Cl − 37,0 kJ/mol NaCl (s) NaCl(s) → Na+ + Cl− KCl (s) KCl(s) → K + Cl NH3 (g) NN3(g) + H2O → NH4 + OH LiNO3(s) LiNO3(s) → Li + NO3 NaNO3(s) NaNO3(s) → Na + NO3 KNO3(s) KNO3(s) → K+ + NO3− + + + 3,9 kJ/mol − + 17,2 kJ/mol + + NH4+ − − + NH4NO3(s) NH4NO3(s) → • − Puesto que la suma de las dos últimas reacciones es igual a la primera, puede escribirse que: ∆H1 = ∆H2 + ∆H3 − 96,0 kJ/mol HCl (g) + H2O → H3O + Cl − CO(g) + ½O2(g) → CO2(g) ∆H3 = −283,0kJ ∆Hdisolución HCl (g) + ∆H2 = −110,5kJ − 30,5 kJ/mol + 1,3 kJ/mol − + NO3 + 34,9 kJ/mol − + 25,7 kJ/mol NaOH(s) NaOH(s) → Na+ + OH− − 44,0 kJ/mol KOH(s) KOH(s) → Na+ + OH− − 57, 6 kJ/mol Entalpía o calor de cambio de estado de una sustancia es la energía intercambiada cuando 1 mol de sustancia cambia de estado de agregación. LEY DE HESS 129 130 qv = qp – ∆nRT Ejemplo: E6A.S2009 Dadas las siguientes ecuaciones termoquímicas: N2(g) + 2 O2(g) → 2 NO2(g) ∆H1=−67,78 kJ 2 NO(g) + O2(g) → 2 NO2(g) ∆H2=−112,92 kJ a) Calcule la entalpía de formación del monóxido de nitrógeno, en las mismas condiciones de presión y temperatura b) Determine la cantidad de calor, a presión constante, que se desprende en la combustión de 90 g de monóxido de nitrógeno, en las mismas condiciones. Masas atómicas. N=14, O=16 c) Calcular el calor que se desprende, a volumen constante, en la combustión de 90 g de monóxido de nitrógeno. (Suponga que todas las entalpías se midieron a 1 atm y 25ºC) Dato: R = 8’3 J·K−1·mol−1. ½ N2(g) + ½ O2(g) → NO(g) ∆H Ejemplo: E2A.S2009 En condiciones estándar, en la combustión de 1 gramo de etanol se desprenden 29,8 kJ y en la combustión de 1 gramo de ácido acético se desprenden 14,5 kJ. Calcule: a) La entalpía de combustión estándar del etanol y la del ácido acético. b) La variación de entalpía estándar de la siguiente reacción; CH3CH2OH + O2 → CH3COOH + H2O a) La entalpía estandar de cualquier sustancia se refiere siempre al calor de reacción de 1 mol de sustancia, por tanto los valores que nos presentan referidos a 1 gramo tendremos que multiplicarlos por la masa molecular de cada campuesto. f Como es fácil de ver, esta reacción se puede obtener sumando las dos reacciones siguientes: (Fíjate que las hemos dividido por dos, y también sus entalpías) Además tendremos en cuenta que, de acuerdo con el criterio de signos de la IUPAC, al decirnos que “se desprende calor” eso quiere decir que ambas reacciones son exotérmicas y que por tanto su entalpía es negativa, de manera que las entalpías por gramo serían −29,8 kJ/gr y −14,5 kJ/gr para el etanol y acético respectivamente. ½ N2(g) + O2(g) → NO2(g) ∆H1=−67,78 / 2 kJ NO2(g) → NO(g) + ½ O2(g) ∆H2=+112,92 / 2 kJ −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− ½ N2(g) + ½ O2(g) → NO(g) ∆Hof = +22,57 kJ Pm CH3CH2OH = 46 gr/mol → ∆H°Comb, CH3CH2OH = 46gr/mol*−29,8 kJ/gr = −1370,8 kJ/mol Pm CH3COOH = 60 gr/mol → ∆H°Comb, CH3COOH = 60gr/mol*−14,5 kJ/gr = −870 kJ/mol b) El calor de reacción a presión constante, es decir la entalpía, se calcula como un balance más de la reacción, sin más que tener en cuenta que al ser la entalpía negativa quiere decir que se trata de una reacción exotérmica, por tanto: b) Si escribimos las reacciones de combustión del etanol y del ácido acético, para las que acabamos de calcular su entalpía estandar, tendremos: 2 NO(g) + O2(g) → 2 NO2(g) + 112,92 kJ ∆H2=–112,92 kJ 2.30g NO −−−−−−−−−−−−−−−−−−−−−−−− 112,92 kJ 90 g NO −−−−−−−−−−−−−−−−−−−−−−−− x de donde x = 169,38 kJ es la energía desprendida en la combustión de 90g de monóxido de nitrógeno (óxido nítrico) a presión constante: ∆U = qp – p∆V CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O ∆H°1=−1370,8 kJ CH3COOH + 2 O2 → 2 CO2 + 2 H2O ∆H°2=−870,0 kJ por otro lado, la reacción de oxidación del alcohol hasta ácido acético es CH3CH2OH + O2 → CH3COOH + H2O c ) Teniendo en cuenta que 2 NO(g) + O2(g) → 2 NO2(g) a volumen constante: ∆U = qv – p∆V qv = 169,38kJ – (–1mol).8,3J.K−1.mol−1.298K = 171,85 kJ Para esta reacción el calor a volumen constante es mayor que el calor a presión constante. La explicación es que al haber menos moles de gases, el sistema, cuando trabaja a presión constante, se comprime por el trabajo realizado desde fuera (por la presión atmosférica (igual a ∆nRT) y por eso el calor desprendido es mayor en esa cantidad, porque estamos haciendo trabajo sobre el sistema. a) La reacción de formación del monóxido de nitrógeno, es aquella en la que como único producto se forma un mol de NO a partir de los elementos que lo componen en estado normal, es decir a 25ºC y 1amt. o → ∆H°3 Si te das cuenta verás que si a la primera reacción le sumamos la opuesta a la segunda qv = qp – p∆V = qp – ∆nRT obtendremos la tercera, por tanto: ∆H°3=∆H°1−∆H°2 CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O ∆H°1=−1370,8 kJ 2 CO2 + 2 H2O → CH3COOH + 2 O2 ∆H°2=+870,0 kJ −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− CH3CH2OH + O2 → CH3COOH + H2O ∆H°3=−1370,8+870,0=−500,8kJ Si en la reacción hubiese el mismo número de moles de gases antes y después, los calores a volumen y presión constante serían iguales, pero en este caso finalmente hay dos moles de productos e inicialmente hay 3 moles: así que ∆n = 2–3 = –1. Sustituyendo: 131 132 ENTALPIA DE FORMACIÓN Como hay muchísimas reacciones y nos llevaría toda la vida calcular el calor de reacción de cada una, se ha definido el concepto de entalpía normal de formación, ∆H of como la entalpía de una reacción imaginaria en la que, como único producto, se forme 1 mol de compuesto a partir de los elementos que lo componen, todos ellos en estado normal, es decir como se encuentran a 1 amt de presión y 25ºC de temperatura. Por ejemplo, la reacción de formación del metanol sería: ∆H of = −238,6kJ C(s) + ½ O2(g) + 2H2 → 1 CH3OH(l) Como ves, el único producto es 1mol de metanol y como reactivos están los elementos que lo forman, en estado normal. Como se trata de una reacción teórica imaginaria, rara vez ocurre así en la práctica. Así, por ejemplo, el metanol no se obtiene de esa forma, sino haciendo reaccionar monóxido de carbono con hidrógeno: CO(g) + 2H2 → CH3OH(l) ∆Hreacc = −128,1kJ Pero esta reacción (mediante la que se obtiene el metanol industrialmente) no es la reacción de formación, porque el producto final no se obtiene a partir de los elementos en estado normal. Es evidente que la entalpía de formación de cualquier elemento en estado normal es cero, ya que sería: C(s) → C(s) ∆H of = 0 Conociendo las entalpías normales de formación de todas las sustancias que intervienen en una reacción es fácil calcular la entalpía de la reacción sin más que tener en cuenta que aplicando la ley de Hess resulta que: ∆H°reacc = ∑∆H°f (productos) − ∑∆H°f (reactivos) Compuestos inorgánicos H2O(g) H2O(l) HF(g) HCl(g) NaCl(s) CaO(s) CaCO3(s) CO(g) CO2(g) NO(g) NH3(g) SO2(g) SO3(g) NaOH(s) ∆H f kJ/mol 0 −241,8 −285,8 −268,6 −92,3 −411,0 −635,1 −1206,9 −110,5 −393,5 +90,4 −46,2 −296,1 −395,2 ‒425,6 Compuestos orgánicos Metano Etano Eteno Etino Propano n−Butano n−Hexano Benceno Metanol Etanol Ac. fórmico Ac. acético Cloroformo Ejemplo: E1B.S2009 Considere la reacción de combustión del etanol. a) Escriba la reacción ajustada y calcule la entalpía de reacción en condiciones estándar. b) Determine la cantidad de calor, a presión constante, que se libera en la combustión completa de 100 gr de etanol, en las mismas condiciones de presión y temperatura. Datos: ∆Hºf[C2H5OH(l)]=−277,7kJ/mol, ∆Hºf[CO2 (g)]=−393,5kJ/mol, ∆Hºf[H2O(l)]=−285,8kJ/mol Masas atómicas: C=12, H=1, O=16 a) Puesto que los alcoholes, al igual que los hidrocarburos, arden formando dióxido de carbono y agua: CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O Como conocemos las entalpías normales de formación de todas las sustancias que intervienen en una reacción, la entalpía de la reacción es: ∆H°reacc = ∑∆H°f (productos) − ∑∆H°f (reactivos) ∆H°reacc = (2*∆H°CO2 + 3*∆H°H2O) – (∆H°CH3CH2OH) ∆H°reacc = (2*−393,5 + 3*−285,8) – (−277,7) = −1366,7 kJ b) Como el calor a presión constante es igual a la entalpía, y en esas condiciones de presión y temperatura ya la hemos calculado para esa reacción, no hay más que hacer un balance normal considerando que por cada mol de etanol (46gr) se desprenden 1366,7 kJ CH3CH2OH + 3 O2 → 2 CO2 + 3 H2O + 1366,7 kJ ∆H°=−1366,7 kJ 46 gr etanol −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 1366,7 kJ x 100 gr etanol −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− de donde tenemos que se desprenderían 2971,1 kJ de energía en forma de calor ∆H f kJ/mol 0 −74,9 −84,7 +52,3 +226,8 −103,8 −124,7 −167,2 +49,0 −238,6 −277,6 −409,2 −487,0 −131,8 SEGUNDO PRINCIPIO DE LA TERMODINÁMICA. ENTROPÍA El primer principio de la termodinámica nos dice que la energía total de un sistema aislado permanece constante y nos permite relacionar los diferentes tipos de energía con el trabajo y el calor. Por tanto nos permite calcular las variaciones de energía en una reacción, pero no nos permite conocer si la reacción será espontánea o no. Hay muchísimos procesos que ocurren de forma espontánea, pero nunca al revés, como por ejemplo la expansión de un gas (si se rompe una botella de butano el gas sale espontáneamente, pero jamás ocurre lo contrario), o la disolución de una sal en agua, o la evaporación de un líquido, y muchísimas reacciones químicas. Observando todos estos procesos se puede llegar a la siguiente conclusión: “en todo proceso espontáneo el desorden del sistema y sus alrededores siempre aumenta”. 133 134 Para medir el grado de desorden de un sistema se define una nueva magnitud, que es una función de estado, y se llama Entropía. La entropía (S), por tanto, es una magnitud que mide el grado de desorden molecular de un sistema. Ejemplo: Calcular la variación de entropía cuando se pasan 50 gr de agua a 0ºC a hielo a 0ºC, sabiendo que el calor latente de fusión del hielo es 334000 J/Kg. Para pasar de agua a 0ºC a hielo a 0ºC hay que quitar calor del sistema, por tanto el calor es negativo conforme al criterio de signos: La entropía aumenta, en cualquier sustancia, siempre que se produce un cambio del estado sólido a líquido y de líquido a gas, ya que como puede verse se produce un aumento del desorden molecular del sistema. ∆S = q − m ⋅ c f − 0,050 ⋅ 334000 = = = −61,2 J /º K T T 273 como vemos en ese proceso disminuye la entropía, aunque claro está que habremos tenido que poner en contacto el agua con otro cuerpo que estuviese a mucha menor temperatura, y en conjunto la entropía sí que habrá aumentado. S(sólido) < S (líquido) < S(gas) Al disolverse un cristal igualmente se rompe el orden que existía en el mismo, con lo que aumenta la entropía. S(cristal) + S(disolvente) < S(disolución) Al mezclarse dos gases aumenta el desorden y la entropía. ENERGIA LIBRE DE GIBBS. ESPONTANEIDAD DE LAS REACCIONES A primera vista pudiera parecer que solo los procesos exotérmicos pueden tener lugar de forma espontánea y que los procesos endotérmicos nunca tendrán lugar a temperatura ordinaria. Esto no es así, como prueba la fusión del hielo o la descomposición del carbonato amónico en bicarbonato y amoniaco. ∑S(gases puros) < S(mezcla gases) Lo mismo que ocurre con la energía interna (U) y con la entalpía (H), la entropía es una función de estado que no podemos calcular en un momento dado, pero sí sus variaciones en aquellos procesos que son reversibles. La variación de entropía, para un proceso reversible, es igual al calor recibido por el sistema a temperatura constante dividido por esa temperatura. Sus unidades son J/ºK Esto nos lleva a pensar que por un lado los sistemas tienden espontáneamente al estado de menos energía (a disminuir su entalpía) y por otro lado al máximo desorden (a aumentar su entropía). La magnitud termodinámica que combina a ambas se llama Energía libre de Gibbs (G) y para un proceso a presión y temperatura constante, que es lo habitual en el laboratorio, es igual a: q Proceso reversible T y en los procesos irreversibles se cumple que : q ∆S > Proceso irreversible T El segundo principio de la termodinámica se enuncia diciendo que “en todos los procesos espontáneos se produce un aumento de la entropía total del universo” ∆G = ∆H – T ∆S ∆S = ∆Suniverso > 0 Es muy importante tener en cuenta que la entropía de un sistema puede disminuir, basta con que el sistema pierda calor (recuerda que el calor perdido es negativo), sin embargo, lo que exige el segundo principio es que en el conjunto sistema + ambiente la entropía aumente. Eso ocurre, por ejemplo cuando enfriamos agua hasta convertirla en hielo. La energía libre de Gibbs es una función de estado, y solo podemos calcular su variación, siendo la magnitud que nos indica la espontaneidad de los procesos químicos: ∆G < 0 ∆G =0 ∆G >0 proceso espontáneo equilibrio proceso no espontáneo Solamente son espontáneos aquellos procesos para los que la variación de energía libre de Gibbs es negativa. Los procesos para los que la variación es positiva no lo son, pero sí los inversos. En la reacción de descomposición del carbonato amónico, tenemos: (NH4)2CO3 (s) → NH4HCO3 (s) + NH3 (g) ∆Suniverso = ∆Ssistema + ∆Sambiente > 0 ∆H = 40 kJ como vemos, la reacción es endotérmica, sin embargo, la molécula de carbonato amónico se rompe y además uno de los productos resultantes es un gas, con lo que aumenta el 135 136 desorden y la entropía aumenta lo suficiente como para que a la temperatura ambiente el segundo término (– T∆S) pese más que el primero (∆H) y entonces ∆G sea negativo y en consecuencia la reacción es espontánea. Influencia de la temperatura en la espontaneidad Teniendo en cuenta que la espontaneidad de una reacción, a presión y temperatura constante, solo depende de que su variación de energía libre sea negativa y que ésta vienen dada por : ∆G = ∆H – T∆S Como vemos, la temperatura juega un papel muy importante, pero solamente en aquellas reacciones en las que los dos términos de la ecuación tengan distinto signo, lo que ocurrirá cuando ∆H y ∆S sean ambas positivas o ambas negativas. En este caso: • A temperaturas muy bajas, como el segundo término puede considerarse despreciable, puede decirse que solo las reacciones exotérmicas serán espontáneas • A temperaturas muy grandes, el primer término puede despreciarse frente al segundo, por lo que serán espontáneas aquellas reacciones que supongan un aumento de la entropía. Sin embargo: • En aquellas reacciones exotérmicas y en las que además aumente la entropía serán espontáneas con independencia de la temperatura. • Y al contrario, aquellas reacciones endotérmicas en las que disminuya la entropía no son espontáneas con independencia de la temperatura ∆G = ∆H – T∆S Que el proceso sea exotérmico supone que la variación de entalpía es negativa, con lo que a muy baja temperatura será siempre espontáneo. Ahora bien, si la temperatura aumenta podrían darse dos casos: 1. que la variación de entropía fuese negativa, con lo que el segundo sumando sería positivo y si aumenta la temperatura suficientemente podrá hacer que ∆G sea positivo y la reacción deje de ser espontánea 2. que la variación de entropía fuese positiva, con lo que el segundo sumando sería negativo, reforzando aun más al primero y entonces ∆G sería siempre negativa y el proceso espontáneo a cualquier temperatura. b) Un aumento del desorden, es decir de la entropía supone que el segundo término de la ecuación anterior siempre es negativo, y por tanto que a altas temperaturas como pesará más que el primer término, dará una ∆G negativa y el proceso será espontáneo. Ahora bien, a bajas temperaturas pueden darse dos casos: 1. que la reacción sea exotérmica, es decir que ∆H sea negativo, en cuyo casi siempre ∆G será negativa y el proceso espontáneo 2. que la reacción sea endotérmica, es decir que ∆H sea positivo, con lo cual si la temperatura se hace muy pequeña la energía libre puede llegar a ser positiva y el proceso dejar de ser espontáneo. c) Ya se ha explicado anteriormente que al depender la espontaneidad de que ∆G sea negativo, en los casos en que los dos términos de la ecuación anterior están enfrentados (exotérmica con disminución de entropía o bien endotérmica con aumento de entropía) una variación de temperatura puede variar el signo de la ecuación y por tanto la espontaneidad. lo que podemos resumir en el siguiente cuadro: ∆H ∆S + + − − − + + − ∆G + − − + − + Resultado A baja Tª no es espontáneo A alta Tª es espontáneo A baja Tª es espontáneo A alta Tª no es espontáneo Espontánea siempre No espontánea siempre Ejemplo Ejemplo: E5B.S2009 2 NH3 (g) → N2(g) +3H2(g) El proceso de formación del amoniaco gaseoso a partir de sus elementos es exotérmico. Razone: a) ¿Cómo varía la entropía de este proceso? b) ¿será siempre espontánea la síntesis de amoniaco? c) Serán iguales los calores de formación a presión constante y a volumen constante? H2O (l) → H2O (s) 2N2O (g) → 2N2(g) + O2(g) 3O2 (g) → 2O3 (g) a) La síntesis del amoniaco tiene lugar de acuerdo con la reacción: Ejemplo: E4A.S2009 N2 + 3 H2 → 2 NH3 a) Explique si un proceso exotérmico será siempre espontáneo. b) Indique si un proceso que suponga un aumento de desorden será siempre espontáneo. c) ¿Por qué hay procesos que son espontáneos a una determinada temperatura y no lo son a otra temperatura? ∆H = <0 observa en la estequiometría de la reacción que 4 moléculas sencillas, formadas por dos átomos, pasan a formar 2 moléculas más organizadas, donde a cada nitrógeno se unen 3 hidrógenos que ocupan posiciones determinadas. Por tanto parece evidente que al aumentar el orden disminuya la entropía, es decir ∆S<0 a) Un proceso espontáneo es aquel para el que la variación de energía libre de Gibbs es negativa, que para un proceso a presión y temperatura constante viene dada por: b) Como la energía libre de Gibbs viene dada por ∆G = ∆H − T∆S, resulta que sustituyendo los dos incrementos negativos tendremos una situación como la siguiente: 137 138 Ejemplo: E5B.S2008 ∆G = −a + T.b La conversión de metanol en etanol puede realizarse a través de la siguiente reacción (sin ajustar): CO(g) + H2(g) + CH3OH(g) → C2H5OH(g) + H2O(g) a) Calcule la entalpía de reacción estándar. b) Suponiendo que ∆H y ∆S no varían con la temperatura, calcule la temperatura a la que la reacción deja de ser espontánea. Datos: ∆Hºf [CO(g)]=−110’5 kJ/mol, ∆Hºf [CH3OH (g)]=−201’5 kJ/mol, ∆Hºf [C2H5OH(g)]=−235’1 kJ/mol, ∆Hºf [H2O (g)]=−241’8 kJ/mol. Variación de entropía de la reacción: ∆Sº=−227’4 J·K−1. se ve claramente que para valores pequeños de temperatura el conjunto será negativo y la reacción espontánea, pero si la temperatura aumenta y con ella el peso del segundo sumando, el resultado total será positivo y la reacción no será espontánea. c) Sabemos que la relación entre el calor de reacción a volumen constante y a presión constantes es: q v = q p − P∆V o bien, teniendo en cuenta la ecuación de los gases perfectos que: a) La reacción ajustada sería: q v = q p − ∆nRT CO(g) + 2 H2(g) + CH3OH(g) → C2H5OH(g) + H2O(g) por tanto, como en la síntesis del amoniaco inicialmente hay 4 moles de gases y finalmente hay 2 moles, tenemos un incremento de −2 moles para la reacción, con lo que no pueden ser iguales porque hay una disminución de volumen: Como conocemos las entalpías normales de formación de todas las sustancias que intervienen en una reacción, la entalpía de la reacción es: ∆H°reacc = ∑∆H°f (productos) − ∑∆H°f (reactivos) q v = q p + 2RT ∆H°reacc = (∆H°C2H5OH + ∆H°H2O) – (∆H°CO + ∆H°CH3OH) ∆H°reacc = (−235,1 −241,8) – (−110,5 −201,5) = –164,9 kJ Ejemplo: E1B.S2008 b) La espontaneidad de la reacción viene dada por el signo de la variación de la energía de Gibbs, que es igual a: ∆G = ∆H – T∆S, Razone si las siguientes afirmaciones son verdaderas o falsas: a) Las reacciones espontáneas transcurren a gran velocidad. b) La entropía del sistema disminuye en las reacciones exotérmicas. c) El calor de reacción a presión constante es igual a la diferencia entre la entalpía de los productos y de los reactivos. ∆G = –164900 + 227,4.T la espontaneidad de esta reacción, como ya hemos razonado en ejercicios anteriores, viene muy determinada por el valor de la temperatura, porque al ser exotérmica y venir acompañada de una disminución de entropía hace que los términos de la ecuación de Gibbs estén enfrentados, como puede verse claramente. a) Falso, la espontaneidad de una reacción viene determinada porque la variación de energía libre de la misma sea negativa, pero nada tiene que vez con la velocidad de de reacción. La reacción es espontánea a temperaturas ordinarias y alcanzará el equilibrio cuando la variación de energía de Gibbs sea cero, lo que tendrá lugar para una temperatura dada por: 0 = −164900 + 227,4.T → T = 725 ºK = 452 ºC b) Falso, que una reacción sea exotérmica significa que los productos son más estables que lo reactivos y por tanto lleva consigo un desprendimiento de energía, normalmente en forma de calor, pero nada tiene que ver con la variación de entropía. De hecho hay reacciones exotérmicas en las que la entropía aumenta y reacciones en las que disminuye. Para valores superiores de temperatura dejaría de ser espontánea c) Verdad, ya que el calor de reacción a presión constante es igual a la entalpía, y la entalpía de una reacción puede obtenerse como la suma de la entalpía de los productos menos la de los reactivos. 139 140 TEMA 5 ENERGIA LIBRE DE FORMACIÓN Exactamente de la misma forma que se definen las entalpías normales de formación, ∆H of pueden definirse Energías libres de formación estándar ∆G como la energía libre de una reacción imaginaria en la que, como único producto, se forme 1 mol de compuesto a partir de los elementos que lo componen, todos ellos en estado normal, es decir como se encuentran a 1 amt de presión y 25ºC de temperatura. Por ejemplo, la reacción de formación del metanol sería: EQUILIBRIO QUÍMICO. o f C(s) + ½ O2(g) + 2H2 → CH3OH(l) ∆G of = −166,3kJ Es evidente que la entalpía de formación de cualquier elemento en estado normal es cero, ya que sería: C(s) → C(s) ∆G of = 0 Conociendo las energías libres de formación de todas las sustancias que intervienen en una reacción es fácil calcular la energía libre de la reacción sin más que tener en cuenta que : ∆G°reacc = ∆G°f (productos) − ∆G°f (reactivos) ∆G of kJ/mol −227,85 −236,4 −16,58 −94,95 −130,73 −53,04 −79,65 −382,76 −1262,59 −1124,98 −747,68 −893,76 −136,81 −393,06 Compuestos orgánicos Metano Etano Eteno Etino Propano n−Butano n−Hexano Benceno Metanol Etanol Ac. fórmico Ac. acético Cloroformo CCl4 velocidad de una reacción orden de la reacción Teoría cinética de las colisiones Factores que influyen en la velocidad de reacción Como ves, el único producto es el metanol y como reactivos están los elementos que lo forman, en estado normal, sin embargo como ya sabes, esa reacción rara vez ocurre así en la práctica. Compuestos inorgánicos H2O (g) H2O (l) NH3 (g) HCl (g) HCl (aq) HBr (g) HNO3 (l) NaCl Na2SO4 CaCO3 CaCl2 Ca(OH)2 CO CO2 Cinética química ∆G of kJ/mol naturaleza de los reactivos estado físico de los reactivos concentración de los reactivos presión entre sustancias gaseosas la temperatura los catalizadores. Equilibrio químico. ley de acción de masas kc y kp relación entre kc y kp grado de disociación Equilibrios heterogéneos Factures que afectan al equilibrio. ley de le chatelier −50,62 −32,78 +68,1 +209,2 −23,41 −15,65 +35,0 +124,5 −165,67 −168,05 efecto de la temperatura efecto de la concentración efecto de la presión Variación de la constante de equilibrio con la temperatura. Relación entre kp y la energía libre de gibb REACCIONES DE PRECIPITACIÓN −391,15 −66,72 −63,8 Producto de solubilidad solubilidad Efecto del ion común 141 142 CINÉTICA QUÍMICA Las leyes de la termodinámica nos permiten conocer si una reacción es espontánea o no, pero nada sobre la velocidad con que transcurre. Es muy importante conocer como transcurren las reacciones porque en algunos casos nos interesa acelerarlas y otras veces retardarlas. La velocidad de una reacción se define como: • la variación del número de moles de uno los reactivos que desaparece en la unidad de tiempo, o bien como el número de moles de uno de los productos que se forma por unidad de tiempo. Su unidad será moles/seg • Normalmente en lugar de expresar las cantidades en moles se suele hacer en concentración y en tal caso las unidades serán de moles/L.seg • De acuerdo con esto, la velocidad de reacción del compuesto A sería: vA = d[ A] dt N2 + 3 H2 → 2 NH3 La velocidad de reacción de cada compuesto sería: • • • En primer lugar, es evidente que la velocidad de reacción de los reactivos es negativa, puesto que como se van gastando, la variación de concentración siempre será negativa, mientras que para los productos la velocidad es positiva puesto que se van formando y cada vez hay más. Por otro lado, como la proporción en que reaccionan es diferente, es evidente que la velocidad con que desaparece cada reactivo y se forma el producto también es diferente, ya que por cada mol que desaparece de N2 desaparecerían 3 moles de H2, es decir, que la velocidad con que desaparece el H2 es triple que la del N2. Por tanto, para unificar las velocidades de todos los compuestos y para que no haya ambigüedad, se define la velocidad unitaria de cada compuesto como: La variación de su concentración con respecto al tiempo, dividida por su coeficiente estequiométrico y precedida de signo menos si se trata de velocidad de reactivos. Entonces: d[ N 2 ] 1 d[ H 2 ] 1 d[ NH 3 ] =− = dt 3 dt 2 dt Experimentalmente puede comprobarse que la velocidad de una reacción es proporcional al producto de las concentraciones de reactivos (velocidad directa) o de productos (velocidad inversa) elevados a unos exponentes. v directa = k ⋅ [ N 2 ]α [ H 2 ]β y que Para el proceso: 2 NO(g) + 2 H2(g) → N2(g) + 2 H2O(g) La ecuación de la velocidad es v = k.[NO]2.[H2] a) Indique el orden de la reacción con respecto a cada uno de los reactivos. b) ¿Cuál es el orden total de la reacción? c) Deduzca las unidades de la constante de velocidad b) El orden de la reacción es la suma del orden de reacción de todos los reactivos, de manera, que en este caso seria 2+1 = 3. d[ N 2 ] d[H 2 ] d[ NH 3 ] ; v H2 = ; v NH 3 = dt dt dt v=− Ejemplo: E3B.S2009 a) La velocidad de reacción directa puede escribirse como proporcional a la concentración de cada reactivo elevado a un exponente que se llama orden de reacción del reactivo, por tanto, según se deduce de la ecuación de la velocidad: el orden de reacción del NO es 2 y el del hidrógeno es igual a 1. (Como vemos no tienen porqué coincidir con los coeficientes estequiométricos, que son 2 y 2 respectivamente) Imagina la reacción: v N2 = • Los exponentes y las constantes de proporcionalidad se determinan experimentalmente • Los exponentes se llaman orden de reacción del reactivo y no tienen porque ser iguales a los coeficientes de la ecuación, pueden ser enteros o fraccionarios. • La suma de los coeficientes se llama orden de la reacción. • Las velocidades de reacción directa e inversa son distintas y solo son iguales cuando se llega al equilibrio. c) La velocidad de la reacción se define como la variación de la concentración de una especie con respecto al tiempo, dividida por su coeficiente estequiométrico y precedida de signo menos si se trata de velocidad de reactivos, obviamente tiene dimensiones de: moles/L.seg, y como las concentraciones tienen dimensiones de: moles/L, resulta que sustituyendo las unidades en la ecuación de la velocidad nos quedaría que: 2 moles moles moles = k ⋅ L ⋅ seg L L de donde: k= L2 moles 2 ⋅ seg E3B.S2013 3.- Para la reacción A(g) → B(g) + C(g) el valor de la constante de velocidad a una cierta temperatura es 1,5·10−3 L·mol−1·s−1. a) ¿Cuál es el orden de la reacción? b) ¿Cuál es la ecuación de velocidad? c) A esa misma temperatura, ¿cuál será la velocidad de la reacción cuando la concentración de A sea 0,242 M? a) El orden de reacción directa es la suma de los exponentes de las concentraciones de todos los reactivos. Teniendo en cuenta que solo hay un reactivo coincidirá con su orden de reacción y será el exponente de la concentración de ese reactivo. v inversa = k´⋅[ NH 3 ] γ 143 144 La ecuación de velocidad es v = k ⋅ [ A]α . Puesto que todas las ecuaciones deben las mismas unidades (en realidad dimensiones) en ambos lados de la igualdad, si tenemos en cuenta que la velocidad se mide en M/s y que la constante tiene por unidades L·mol−1·s−1 podemos poner que: moles L moles = ⋅ L ⋅ seg moles ⋅ seg L α → moles 2 moles = L2 L TEORÍA CINÉTICA DE LAS COLISIONES La teoría cinética nos dice que las moléculas de los líquidos y gases están en continuo movimiento y por tanto chocando entre sí, pero si en cada choque tuviese lugar una reacción todas las reacciones serían instantáneas, cosa que no ocurre. α La teoría de Lewis, completada más tarde por Eyring, supone que para que tenga lugar una reacción deben darse tres condiciones: → α=2 b) La ecuación de la velocidad es: v = 1,5 ⋅ 10 −3 ⋅ [A] 2 c) Sustituyendo en la ecuación de la velocidad cuando la concentración es 0,242 M tenemos que: v = 1,5 ⋅ 10 −3 ⋅ [0,242] 2 = 8,78 ⋅ 10 −5 moles / L ⋅ seg 1. Las moléculas de reactivos deben chocar y además hacerlo con una energía mínima llamada energía de activación, suficiente para romper los enlaces. Ejemplo: Escribe la ecuación de la velocidad para la reacción aA + bB → cC en los siguientes supuestos: a) Si se duplica la concentración de A y se duplica, también, la concentración de B, la velocidad de reacción aumenta 4 veces. b) Si se duplica la concentración de A, manteniendo igual la concentración de B, la velocidad aumenta 4 veces, mientras que si se mantiene la concentración de A y se duplica la de B la velocidad de reacción se hace el doble. a) La ecuación general de la velocidad es v = k ⋅ [A] α [ B]β supongamos que la concentración inicial de A es X y la inicial de B es Y, de acuerdo con el primer supuesto: inicialmente: Si [A]=2X y [B]=2Y α Observa en el gráfico que a pesar de tratarse de una reacción exotérmica (y que por tanto la energía potencial de los productos es menor que la de los reactivos), es necesario el aporte de energía para que se inicie la reacción. De forma similar sería el diagrama para una reacción endotérmica: β v = k⋅X Y 4 v = k ⋅ ( 2 X ) α ( 2Y ) β se deduce fácilmente que para que ello sea posible α=1 y que β=1, por tanto la ecuación de la velocidad sería v = k ⋅ [ A]1 [ B]1 y el índice de la reacción sería 1+1=2 b) supongamos, igual que antes, que la concentración inicial de A es X y la inicial de B es Y, de acuerdo con el segundo supuesto: inicialmente: Si [A]=2X y [B]=Y v = k ⋅ Xα Yβ 4 v = k ⋅ ( 2 X) α Y β → α=2 Si [A]=X y [B]=2Y 2 v = k ⋅ X α ( 2Y ) β → β=1 por tanto tendremos que v = k ⋅ [A] 2 [ B]1 y el orden de reacción es 2+1=3 145 146 2. Para que el choque sea efectivo debe tener una orientación adecuada, y a los choques que producen reacción se les llama choques eficaces. Si todos los choques fueran eficaces las reacciones serían instantáneas e incluso explosivas, pero solo una fracción ínfima de los choques entre las moléculas de los reactivos se hace con la orientación adecuada. FACTORES QUE INFLUYEN EN LA VELOCIDAD DE REACCIÓN 1. Naturaleza de los reactivos. Puesto que en la reacción deben romperse los enlaces de los reactivos, cuanto más estables sean mayores energías de activación necesitarán. Y mucho más cuando se trate de romper dobles o triples enlaces, por ejemplo: C(s) + O2(g) → 2 CO2(g) Además, como para que ocurra una reacción debe producirse un choque eficaz entre las moléculas de reactivos, aquellas reacciones que requieren de tres o más choques simultáneos son más difíciles que las que solo requieren uno. 2 H2(g) + O2(g) → 2 H2O(g) 3. Cuando tiene lugar un choque eficaz se forma una especie de agregado intermedio llamado complejo activado, que inmediatamente se descompone dando lugar a los productos de reacción. Podría decirse que la energía de activación de la reacción es la energía necesaria para formar el complejo activado. 2. Estado físico de los reactivos. Puesto que las reacciones se producen por choques, es evidente que las reacciones entre gases y líquidos serán más fáciles que las que tienen lugar entre sólidos y que en este último caso influirá muchísimo el grado de división de las partículas (porque cuanto más triturada esté mayor superficie ofrecerá a los choques.) Las reacciones más rápidas son las que tienen lugar entre iones en disolución porque además de encontrarse en disolución no requieren de ruptura de enlaces. Eso explica que la reacción entre cloruro sódico con el nitrato de plata de lugar a un precipitado de cloruro de plata casi instantáneamente. Ag+(aq) + Cl−(aq) → AgCl (s) 3. Concentración de los reactivos. Cuanto mayor sea la concentración de los reactivos mayor será la posibilidad de que choquen adecuadamente, aumentando la velocidad de reacción. Si la velocidad de reacción es proporcional al número de choques, y estos son, a su vez, proporcionales a la concentración de cada uno de los reactivos es comprensible que, por ejemplo, para la reacción N2 + 3 H2 → 2 NH3 v = k ⋅ [ N 2 ]α [H 2 ]β Una vez alcanzado el equilibrio, los coeficientes de cada concentración coinciden con los coeficientes de reacción, así que: v equilibrio = k ⋅ [ N 2 ][H 2 ]3 Que es la ley de acción de masas de Guldberg y Waage y se cumple para los equilibrios de las reacciones homogéneas, es decir, donde los reactivos estén en la misma fase (gaseosa o en disolución), pero no cuando hay sólidos de por medio, ya que la reacción en este caso solo tiene lugar por los choques con las moléculas de la superficie del sólido. 4. Presión entre sustancias gaseosas. Ya que un aumento de la presión provoca un aumento n de la concentración. ( PV = nRT de donde P = RT ) V 147 148 Como puedes ver, y ya hemos indicado, el NO2 que hace de catalizador ha modificado el mecanismo de la reacción, haciendo que trascurra por otra vía más rápida, y al final del proceso se recupera, de manera que globalmente el proceso parece el mismo. 5. La temperatura. El aumento de temperatura, por un lado hace que: • aumente la velocidad de las moléculas y el número de choques, con lo que aumentará la velocidad de reacción • por otro lado hace que aumente el porcentaje de moléculas con la energía de activación necesaria. Muchas reacciones orgánicas que tienen lugar en fase acuosa se catalizan en medio ácido. Heterogéneos: cuando se encuentran en distinta fase. Normalmente estos catalizadores son metales de transición como Ni, Pd, Pt o óxidos de ellos como Fe2O3 (que cataliza la síntesis de amoníaco), Cr2O3, etc 6. Los catalizadores. Los catalizadores son sustancias que, aunque se encuentren en cantidades muy pequeñas, modifican mucho le velocidad de la reacción. • Los catalizadores cambian el mecanismo de la reacción, haciendo que transcurra de otra forma con una energía de activación menor En la combustión de las gasolinas se producen una pequeña parte de CO y de NO que son gases tóxicos. Actualmente los coches van provisto de un catalizador de paladio que favorece la reacción para que se forme CO2 y N2 que son menos tóxicos: NO + CO → N2 + CO2 (hay que tener cuidado de utilizar gasolina sin plomo, porque el plomo envenena fácilmente al catalizador al recubrirlo, con lo que pierde su actividad) Enzimas o biocatalizadores: Son proteínas que continuamente están catalizando todas las reacciones que tienen lugar en los seres vivos. Lo más significativo es que son altamente específicos, de manera que muchos de ellos catalizan solamente una reacción específica, hasta el punto que uno de los modelos para explicar su funcionamiento es el de la llave y su cerradura. • Como puede verse en el esquema, los catalizadores no alteran las funciones termodinámicas ∆H y ∆G, por lo tanto no pueden desplazar los equilibrios. Lo único que hacen es conseguir que se llegue antes a ellos. Por tanto una catalizador jamás hará que ocurra un proceso que termodinámicamente sea imposible. • Los catalizadores se recuperan al final de la reacción, por lo que globalmente es como si no hubiesen intervenido. • Los catalizadores alteran también la velocidad de reacción inversa, ya que como puede verse en la figura, al disminuir la energía de activación, ha disminuido los obstáculos que había cuando la reacción transcurre hacia un lado, pero también hacia el otro. Precisamente porque afecta por igual a la velocidad directa y a la inversa, los catalizadores no influyen en el equilibrio de la reacción Los catalizadores pueden ser de varios tipos: Homogéneos: son aquellos que se encuentran en la misma fase que los reactivos, como por ejemplo el dióxido de nitrógeno en la oxidación del SO2, que es el proceso clave de la formación de ácido sulfúrico: SO2 + ½ O2 → SO3 EQUILIBRIO QUÍMICO. LEY DE ACCIÓN DE MASAS La mayoría de las reacciones químicas no ocurren en su totalidad hasta que se gasta uno de los reactivos, tal como supusimos al realizar cálculos estequiométricos, sino que llegan a un equilibrio. • En el equilibrio la velocidad con la que se forman los productos es igual a la velocidad con que reaccionan para volver a formar los reactivos iniciales. • El equilibrio de una reacción, por tanto, es un equilibrio dinámico ya que los procesos continúan. • En el equilibrio coexisten cantidades de todos los reactivos y productos en concentraciones que guardan una relación constante, siempre que no se alteren las condiciones de presión y temperatura. Supongamos la reacción que tiene lugar entre el yodo y el hidrógeno a alta temperatura, para formar yoduro de hidrógeno. H2(g) + I2(g) ⇄ 2 HI(g) este proceso es muy lento catalizado por NO2, la reacción transcurre rápida. El proceso que tiene lugar es: SO2 + NO2 → SO3 + NO NO + ½ O2 → NO2 149 Al comienzo podemos decir que la reacción evoluciona hacia la derecha ya que hay muchas moléculas de H2 y de I2 con lo que se favorecen los choques entre ellas, pero la velocidad irá disminuyendo a medida que van gastándose y como precisamente la concentración de HI va aumentando también aumentará la velocidad en que la reacción transcurre en sentido inverso, y así hasta llegar un momento en que se igualen y se alcance el equilibrio dinámico, como se muestra en la figura: 150 Teniendo en cuenta que, de acuerdo con la ley de Dalton de las presiones parciales, a cada gas se le puede aplicar la ecuación de los gases porque ejerce una presión como si estuviese solo y ocupase todo el volumen: Si el volumen para todos los gases es el mismo (V), porque lo ocupan todo como si estuviesen solos, la ecuación de los gases para el gas i , del que hay ni moles y ejerce una presión pi, sería: p i V = n i RT → De acuerdo con la ley de Guldberg y Waage, en el equilibrio la velocidad de la reacción es proporcional a la concentración de las especies “en el equilibrio” elevada a un exponente igual a su coeficiente estequiométrico: Kp = ni RT = M i RT V p dD ⋅ p cC (M D RT ) d ⋅ (M C RT ) c M dD ⋅ M cC (RT ) d + c M dD ⋅ M cC = = ⋅ = ⋅ (RT ) ∆n = Kc ⋅ (RT ) ∆n p aA ⋅ p bB ( M A RT ) a ⋅ (M B RT ) b M aA ⋅ M bB (RT ) a + b M aA ⋅ M bB v inversa = k´[HI] v directa = k [H 2 ][I 2 ] pi = 2 Kp = Kc ⋅ (RT ) ∆n como en el equilibrio ambas velocidades deben ser iguales: Como puedes ver, en aquellas reacciones donde no haya variación del número de moles las constantes Kc y Kp son iguales. k [HI] = k´ [H 2 ][I 2 ] 2 K= donde hemos tenido en cuenta que el cociente entre las constantes de velocidad directa e inversa debe ser, a su vez, otra constante que se llama constante de equilibrio y que como aquellas es constante para una temperatura determinada, pero que depende mucho de ella. Por otro lado, si escribimos la ecuación de los gases para el gas i , del que hay ni moles y ejerce una presión pi, y la escribimos también para el conjunto de los gases, de los que hay n=n1+n2+… moles y ejercen una presión total P=p1+p2+… p i V = n i RT A esa expresión se la conoce como ley de equilibrio o ley de acción de masas (LAM), que para una ecuación general se escribiría como: P V = n RT aA + bB ⇄ cC + dD K= pi = [C]c [D]d [A]a [B]b Kp = Daría igual escribir la expresión invertida, pero por convenio internacional se escribe así, poniendo en el numerador las concentraciones de los productos y en el denominador las de los reactivos, todas ellas elevadas a sus respectivos coeficientes estequiométricos. ni P = xiP n donde xi es la fracción molar del gas i p dD ⋅ p cC ( x D P) d ⋅ (x C P) c x dD ⋅ x cC (P) d + c = = ⋅ = Kx ⋅ P ∆n p aA ⋅ p bB ( x A P) a ⋅ (x B P) b x aA ⋅ x bB (P) a + b Kp = Kx ⋅ P ∆n La constante de equilibrio expresada en función de las concentraciones, tal como hemos indicado, se llama explícitamente Kc. No obstante en las reacciones entre gases es frecuente expresarla también en función de las presiones parciales de cada gas en el equilibrio, así tendríamos: p 2HI Kp = p H2 ⋅ p I2 151 152 [CO] = [Cl2] = Ejemplo E1B.S2009 En un matraz de 2L, en el que se ha practicado previamente el vacío, se introducen 0,40 moles de COCl2 y se calienta a 900ºC, estableciéndose el siguiente equilibrio: COCl2 (g) ⇄ CO(g) + Cl2(g) Sabiendo que a esa temperatura el valor de Kc es 0,083, calcule: a) Las concentraciones de cada una de las especies en el equilibrio. b) El grado de disociación del fosgeno en esas condiciones. b) El grado de disociación, que se presenta con la letra α, se define como la fracción de 1 mol en que se disocia un compuesto. (también se entiende el grado de disociación como el tanto por uno que se disocia, de manera que si por ejemplo un reactivo se disocia el 60%, entonces α=0,6) Por tanto, como de 0,40 moles iniciales de fosgeno se han disociado 0,188 moles, estableciendo una simple proporción: a) Supongamos que reaccionan (se descomponen en este caso) x moles de fosgeno y se forman x moles de CO2 y x moles de Cl2 y se alcanza el equilibrio. Podíamos poner que: COCl2 (g) ⇄ CO(g) + Cl2(g) moles iniciales moles en el eq.(*) concentrac. eq. fracc. molares ni/nTot Presiones parciales 0,40 0 0 0,40 − x x x 0,40 − x 2 0,40 − x 0,40 + x x 2 x 2 x 0,40 + x o bién pi=xi.PTot 0,40 moles COCl 2 se han disociado 0,188 moles = 1 mol COCl 2 α de donde α = 0,47 El ejercicio también podría plantearse directamente en términos del grado de disociación, de manera muy similar. Simplemente habría que tener en cuenta que si partimos de no moles iniciales, de acuerdo con la definición de grado de disociación, el número de moles que se descomponen serían noα que es lo que pondríamos en lugar de x : es decir: si de no moles se disocian x moles 1 mol se disocian α moles por definición x = noα molesTot=0,40+x COCl2 (g) ⇄ CO(g) + Cl2(g) x 0,40 + x 0,40 − x x x RT RT RT PTot=(0,40+x)RT 2 2 2 0,40 − x x x PTot PTot PTot 0,40 + x 0,40 + x 0,40 + x piV=ni.RT → pi=Mi.RT x 0,188 = = 0,094 moles / litro 2 2 moles iniciales no = 0,40 0 0 moles en el eq. no – noα noα noα concentrac. eq. n o (1 − α) V n oα V n oα V de donde: [CO][Cl 2 ] = Kc = [COCl 2 ] (*) Si la reacción fuese del tipo 2A+B⇄2C+D, los moles en el equilibrio serían respectivamente: a−2x, b−x, 2x, x Realmente no es preciso completar toda esta tabla, ello dependerá de los datos y de lo que nos pregunten, pero con ella prácticamente que podremos resolver cualquier tipo de problema. de donde α = 0,47 n o α n o α 0,4α 0,4α ⋅ ⋅ V V = 2 2 = 0,083 n o (1 − α ) 0,4(1 − α) 2 V la constante de equilibrio Kc es: Kc = [CO][Cl 2 ] = [COCl 2 ] x x ⋅ 2 2 = 0,083 0,40 − x 2 Ejemplo EJB.S2010 de donde, x=0,188 moles de fosgeno que han reaccionado hasta llegar al equilibrio. Por lo tanto las concentraciones en el equilibrio son: [COCl2]= 0,40 − x 0,40 − 0,188 = = 0,106 moles / litro 2 2 En un recipiente de 1 litro de capacidad, en el que previamente se ha hecho el vacío, se introducen 0,1 mol de NO, 0,05 moles de H2 y 0,1 mol de agua. Se calienta el matraz y se establece el equilibrio: 2 NO(g) + 2 H2(g) ⇄ N2(g) + 2 H2O(g) Sabiendo que cuando se establece el equilibrio la concentración de NO es 0,062M, calcule: a) La concentración de todas las especies en el equilibrio. b) El valor de Kc a esa temperatura. a) Como vemos en la reacción, reaccionan 2x moles de NO con 2x moles de H2 y dan x 153 154 moles de N2 y 2x moles de H2O, por tanto: 2 NO(g) + 2 H2(g) ⇄ N2(g) + 2 H2O(g) moles iniciales 0,1 (p )(p ) (p ) (p ) 2 Kp = 0,05 moles en el eq.(*) 0,1 − 2x 0,05 − 2x concentrac. eq. 0,1 − 2 x 1 0,05 − 2x 1 0 x 1 H 2O 2 NO 0,1 x N2 2 = H2 0,780 ⋅ (5,658) 2 = 15,94 ( 2,542) 2 (0,492) 2 a la misma conclusión habríamos llegado utilizando la relación que existe entre ambas constantes de equilibrio, y teniendo en cuenta que, para esta reacción, inicialmente hay 4 moles y al final se obtienen 3 moles, de manera que ∆n = 3−4 = −1 2x + 0,1 2x + 0,1 1 Kp = Kc ⋅ (RT ) ∆n = 653,6 ⋅ (0,082 ⋅ 500) 3−4 = 15,95 0,062 M de donde x = 0,019 moles, y por tanto las concentraciones de cada especie en el equilibrio es: Ejemplo E2B.S2009 El CO2 reacciona con el H2S a altas temperaturas dando sulfuro de carbonilo según: CO2(g) + H2S(g) ⇄ COS(g) + H2O(g) Se introducen 4,4 g de CO2 en un recipiente de 2,5 litros a 337ºC y una cantidad suficiente de H2S para que, una vez alcanzado el equilibrio, la presión total sea de 10 atm. En la mezcla en equilibrio hay 0,01 mol de agua. Calcule: a) El número de moles de cada una de las especies en equilibrio b) El valor de las constantes Kc y Kp a esa temperatura Datos: Masas atómicas: C=12; O=16; R=0,082 atm.L.K−1.mol−1. [NO] = 0,062 moles/L 0,05 - 2 ⋅ 0,019 = 0,012 mol/L 1 0,019 = 0,019 mol/L [N2] = 1 2 ⋅ 0,019 + 0,1 [H2O] = = 0,138 mol/L 1 [H2] = a) El número de moles iniciales de CO2 es 4,4/44 = 0,1 moles. Suponiendo que reaccionan x moles de CO2 con x moles de H2S, podremos poner que: b) La constante de equilibrio de las concentraciones es: Kc = [N 2 ][H 2 O]2 [NO]2 [H 2 ]2 = CO2(g) + 0,019 ⋅ (0,138) 2 = 653,6 (0,062) 2 (0,012) 2 moles iniciales H2S(g) ⇄ COS(g) + H2O(g) 0,1 b moles en el eq. 0,1 − x A continuación vamos a calcular la constante Kp, suponiendo que el equilibrio se estableció a una temperatura de 500ºK. Para ello, en primer lugar vamos a calcular las presiones parciales de cada gas, teniendo en cuenta la ecuación de los gases: concentrac. eq. n NO R T = [NO]R T = 0,062 ⋅ 0,082 ⋅ 500 = 2,542atm V nH p H 2 = 2 R T = [H 2 ]R T = 0,012 ⋅ 0,082 ⋅ 500 = 0,492atm V n N2 p N2 = R T = [N 2 ]R T = 0,019 ⋅ 0,082 ⋅ 500 = 0,780atm V nH O p H 2O = 2 R T = [H 2 O]R T = 0,138 ⋅ 0,082 ⋅ 500 = 5,658atm V 0,1 − 0,01 2,5 b−x b − 0,01 2,5 0 0 x 0,01 2,5 x = 0,01 moles H2O 0,01 2,5 p NO = El número de moles de cada una de las especies en equilibrio es sencillo, como se deduce del planteamiento: molesCO2 = 0,1−0,01 = 0,09 moles molesCOS = molesH2O = 0,01 moles [CO2] = 0,09/2,5 = 0,036 mol/L [COS] = [H2O] = 0,004 mol/L Sin embargo, con este razonamiento, no podemos saber los moles en el equilibrio de H2S porque no sabemos la cantidad inicial de H2S (hemos supuesto que inicialmente había b moles de H2S). (la presión total, la que mediría un barómetro, es la suma de todas las presiones parciales. También podríamos obtenerla como PV=Σn.RT, donde Σn es la suma de todos los moles de todas las especies en el equilibrio) de donde Kp es: Como sabemos la presión total ejercida por todos los gases, la forma más sencilla es aplicar la ecuación de los gases a todos, teniendo en cuenta que l número total de moles 155 156 en el equilibrio es: ntot = (0,1–x)+(b–x)+x+x = 0,1+b Ptot V = n tot RT → 10 ⋅ 2,5 = (0,1 + b) ⋅ 0,082 ⋅ 610 como ves las constantes Kc y Kp de la reacción son iguales, como era de suponer ya que en la reacción no hay variación del número de moles de gases (∆n=0) y ambas constantes est relacionadas mediante: Kp = Kc ⋅ ( RT) ∆n → b = 0,4 moles con lo que molesH2S = b–x = 0,4–0,01 = 0,39 moles y [H2S] = 0,39/2,5 = 0,156M Otro procedimiento mas laborioso, pero que conviene que comprendas seria considerar que la presión total es la suma de la que ejercen las 4 especies que hay en equilibrio, (puesto que las 4 sustancias están en fase gaseosa), es de 10 atm. Teniendo en cuenta la ecuación de los gases y que la presión parcial que ejerce un gas es la presión que ejerce como si ocupara todo el volumen, tenemos que: Ejemplo E4B.S2009 p i V = n i R T de donde: p CO 2 = n CO 2 V El proceso Deacon tiene lugar según: 4HCl(g) + O2(g) ⇄ 2 Cl2(g) + 2 H2O(g) A 390ºC se mezclan 0,080 moles de HCl y 0,100 moles de O2 y cuando se establece el equilibrio hay 0,034 moles de Cl2 y la presión total es de 1atm. Calcule: a) La constante Kp a esa temperatura b) El volumen del recipiente que contiene la mezcla. Dato: R = 0,082 atm.L.K−1.mol−1. R T = [CO 2 ]R T = 0,036 ⋅ 0,082 ⋅ ( 273 + 337) = 1,8 atm n COS R T = [COS]R T = 0,004 ⋅ 0,082 ⋅ ( 273 + 337) = 0,2 atm V nH O = 2 R T = [H 2 O]R T = 0,004 ⋅ 0,082 ⋅ ( 273 + 337) = 0,2atm V p COS = p H 2O a) Como vemos 4 moles de HCl reaccionan con 1 de O2 y forman 2 de Cl2 y 2 de H2O, por tanto: Teniendo en cuenta que, como hemos dicho, la presión total es la suma de las presiones que ejerce cada gas por separado, y que vale 10 atm, tenemos que: p CO 2 + p SH 2 + p COS + p H 2O = 10 moles iniciales V R T = [SH 2 ]R T = [SH 2 ]⋅0,082 ⋅ (273 + 337) = 7,8 atm de donde: [SH 2 ] = 0,156 moles/L, o bien que el número de moles en equilibrio es molesSH2 = 0,156*2,5 = 0,39 moles SH2 y el número de moles iniciales era 0,39+0,01 igual a 0,4 moles de H2S. p COS ⋅ p H 2O p CO 2 ⋅ p SH 2 = 0,100 − x 0 2x 0 2x moles en el eq. 0,012 0,083 0,034 0,034 concentrac. eq. 0,012 V 0,083 V 0,034 V 0,034 V Vamos a calcular las presiones parciales de cada gas teniendo en cuenta que de la Ley de Dalton de sobre las presiones parciales se deduce que la presión parcial de un gas es igual a la presión total por su fracción molar: n pi = i P n [COS][H 2 O] = 0,004 ⋅ 0,004 = 2,85 ⋅ 10 −3 [CO 2 ][SH 2 ] 0,036 ⋅ 0,156 Kp = 0,100 Puesto que no conocemos el volumen y sí conocemos la presión total y podemos obtener fácilmente el número total de moles en el equilibrio simplemente sumando los moles de cada especie: ntotal = 0,012+0,083+0,034+0,034 = 0,163 moles Con todo esto el valor de las constantes de equilibrio sería: Kc = O2(g) ⇄ 2 Cl2(g) + 2 H2O(g) Como en el equilibrio hay 0,034 moles de Cl2, haciendo 2x=0,034 se deduce que x=0,017, por tanto el número de moles en el equilibrio de cada especie es: de donde p SH 2 = 7,8 atm y a partir de este dato utilizando la misma expresión anterior podemos calcular la concentración que en el equilibrio de H2S : n SH 2 0,080 moles en el eq. 0,080 − 4x 1,8 + p SH 2 +0,2 + 0,2 = 10 p SH 2 = 4HCl(g) + 0,2 ⋅ 0,2 = 2,85 ⋅ 10 −3 1,8 ⋅ 7,8 p HCl = 157 n HCl 0,012 P= 1 = 0,074atm n tot 0,163 158 p O2 = n tot n Cl 2 P= 0,083 1 = 0,509atm 0,163 Ejemplo E3B.S2009 0,034 P= 1 = 0,209atm n tot 0,163 nH O 0,034 = 2 P= 1 = 0,209atm n tot 0,163 p Cl 2 = p H 2O n O2 A 30ºC y 1atm el N2O4 se encuentra disociado en un 20% según el siguiente equilibrio: N2O4(g) ⇄ 2 NO2(g) Calcule: a) El valor de las constantes Kp y Kc, a esa temperatura b) El porcentaje de disociación a 30ºC y 0,1atm de presión total Dato: R = 0,082 atm.L.K−1.mol−1. Y la constante de equilibrio en función de las presiones parciales es: Kp = p 2Cl 2 ⋅ p 2H 2O p 4HCl ⋅ p O 2 a) Que el N2O4 está disociado el 20% quiere decir que el grado de disociación es α = 0,2, por tanto si inicialmente había no moles de N2O4 quiere decir que se han descompuesto x=noα moles, así que: N2O4(g) ⇄ 2 NO2(g) 0,209 2 ⋅ 0,209 2 = = 125 0,074 4 ⋅ 0,509 b) Sabiendo el número de moles y la presión, podemos calcular muy fácilmente el volumen sin más que aplicar la ecuación de los gases perfectos (PV = nRT). Podemos aplicarla a cualquiera de los gases, o al conjunto de ellos. Al total de gases: Teniendo en cuenta que, en el equilibrio, la presión total es de 1 atm, y que el número total de moles de gases 0,163: 1 ⋅ V = 0,163 ⋅ 0,082 ⋅ 663 de donde: V = 8,8 Litros no 0 moles en el eq. no – noα 2 noα concentrac. eq. n o (1 − α) V 2n o α V → ntotal = no(1+α) Como sabemos la presión total podemos aplicar la ecuación de los gases perfectos al total de moles que es: no(1+α) = 1,2no Pero también podíamos haberla aplicado a cualquiera de los gases, por ejemplo al cloro. En este caso tendremos en cuenta que la presión parcial que ejerce el cloro en el equilibrio es de 0,209 atm y que el número de moles que hay del mismo es 0,034 moles: 0,209 ⋅ V = 0,034 ⋅ 0,082 ⋅ 663 moles iniciales Ptot V = n tot RT → 1 ⋅ V = 1,2n o ⋅ 0,082 ⋅ 303 → V = 29,82n o con lo que podemos calcular lo que valen las concentraciones de cada especie en el equilibrio: n (1 − α) n o (1 − 0,2) [N 2O 4 ] = o = = 0,0268 moles / L V 29,82n o de donde: V = 8,8 Litros [ NO 2 ] = 2n o α 2n o ⋅ 0,2 = = 0,0134 moles / L V 29,82n o y la constante es: Kc = [ NO 2 ] 2 0,0134 2 = = 6,7 ⋅ 10 −3 [ N 2 O 4 ] 0,0268 y la Kp = Kc ⋅ ( RT) ∆n = 6,7 ⋅ 10 −3 ⋅ (0,082 ⋅ 303) 2−1 = 0,166 Vamos a resolver el mismo ejercicio de otra forma. Teniendo en cuenta que de la Ley de Dalton de sobre las presiones parciales se deduce que la presión parcial de un gas es igual a la presión total por su fracción molar: n pi = i P n como el número total de moles en el equilibrio es: ntot = no− noα + 2 noα = no(1+α) 159 160 EQUILIBRIOS HETEROGÉNEOS podemos poner que las presiones parciales de cada gas en equilibrio son: p N 2O4 = p NO 2 = n N2O4 n tot n NO 2 n tot P= P= Los equilibrios heterogéneos son aquellos en los que hay sólidos coexistiendo con gases o sustancias en disolución. (Hasta ahora en todos los equilibrios las sustancias que intervenían en la reacción estaban en fase gaseosa o en disolución) n o (1 − α) 1− α P= P n o (1 + α ) 1+ α 2n o α 2α P= P n o (1 + α) 1+ α La diferencia que existe viene a consecuencia de lo que se entiende por concentración. Puesto que la concentración de una sustancia es igual a su masa por unidad de volumen, resulta que en un sólido puro (o en un líquido puro) coincide con su densidad, que naturalmente es una constante y por lo tanto puede englobarse dentro de la constante de equilibrio. C(s) + CO2(g) ⇄ 2 CO(g) y la constante de equilibrio Kp es 2α P 4α2 4 ⋅0,2 2 1+ α = = P sustituyendo Kp = ⋅ 1 = 0,167 2 1− α 1− α 1 − 0,2 2 P 1+ α 2 2 Kp = p NO 2 p N 2O4 Para calcular la Kc tendremos en cuenta que ambas constantes Kp = Kc ⋅ ( RT ) y que para esta reacción ∆n = 2−1 =1, así que sustituyendo: La constante de equilibrio de la reacción sería: K= ∆n y como al estar el carbono en estado sólido, su concentración es constante, incluyéndola en la constante de equilibrio, nos quedaría que la constante para el equilibrio es: 0,167 = Kc .0,082.303 de donde Kc = 6,7.10−3 K´= b) Si disminuimos la presión total, el sistema de acuerdo con el principio de Le Chatelier, que veremos después, evolucionará hacia donde más moles de gases hay, es decir hacia la formación de NO2, por tanto el valor del grado de disociación que esperamos encontrar es mayor que el que tenía a 1atm. Kp = 4α P 1− α2 sustituyendo 0,167 = [CO ]2 [CO 2 ] Por tanto, “En los equilibrios heterogéneos, en las constantes de equilibrio no se incluyen los sólidos ni líquidos puros” Teniendo en cuenta que la variación de la presión o de las concentraciones, no afecta al valor de las constantes de equilibrio, siempre que no varíe la temperatura, como es el caso, podemos poner para esta reacción, como ya se dedujo, que: 2 [CO]2 = [CO]2 [C][CO 2 ] k ⋅[CO 2 ] 4α 0,1 1− α2 Según esto, en la evaporación de un líquido puro, como por ejemplo el agua: H2O(l) ⇄ H2O(g) 2 la constante de equilibrio sería: Kc = [H 2 O] de donde se deduce que α = 0,54 o lo que es lo mismo, el N2O4 estará disociado un 54% cuando la presión sea de 0,1atm y la temperatura se mantenga a 30ºC o bien Kp = p H 2O lo que quiere decir que, a una temperatura determinada, se llega a un equilibrio entre líquido−vapor una vez que la presión del gas alcanza un valor determinado, que se llama presión de vapor a esa temperatura. (La presión de vapor del agua a 25º es de 23,7 mmHg) 161 162 a) De la estequimetría de la reacción se deduce que reaccionan 4 moles de CuO y dan lugar 2 moles de Cu2O y 1 mol de O2. Suponiendo que reaccionan x moles hasta llegar al equilibrio: 4 CuO(s) ⇄ 2 Cu2O(s) + O2(g) Ejemplo E4A.S2009 Escriba la expresión de la constante Kc para cada uno de los siguientes equilibrios: a) 2 H2O(g) +2 SO2(g) ⇄ 2 H2S(g) + 3 O2(g) b) 2 HBr(g) ⇄ H2(g) + Br2(l) c) CaCO3(s) ⇄ CaO(s) +CO2(g) a) Kc = [H 2S]2 [O 2 ]3 [H 2 O]2 [SO 2 ]2 moles iniciales 2 0 0 moles en el eq. 2 – 4x 2x x concentrac. eq. 2 − 4x 2 2x 2 x 2 b) Como a la temperatura de la reacción el bromo se obtiene en estado líquido la constante de equilibrio es: [H 2 ] Kc = [HBr]2 La constante de equilibrio Kp de la reacción es: sin embargo, si esa misma reacción tuviese lugar otra temperatura mayor, donde la reacción fuese 2 HBr(g) ⇄ H2(g) + Br2(g) es este caso también deberíamos tener en cuenta la concentración del gas bromo formado y a constante de equilibrio sería: Puesto que el oxígeno es el único gas que interviene en la reacción, la presión parcial de oxígeno coincide con la presión total, que es P = 0,49 atm. Aplicando la ecuación de los gases podemos calcular el número de moles de oxígeno en el equilibrio: K´c = Kp = p O 2 = 0,49 [H 2 ][Br2 ] [HBr]2 p O2 V = n O 2 R T 0,49 ⋅ 2 = n O 2 0,082 ⋅ ( 273 + 1024) c) Como el carbonato de calcio y el óxido de calcio son sólidos, y por tanto su concentración es constante e igual a su densidad, no se tienen en cuenta al escribir la constante de equilibrio, que sería: de donde, nO2 = 0,0092 moles de O2 en el equilibrio, que es lo que inicialmente habíamos llamado x. Por tanto las concentraciones de cada especie en el equilibrio son: Kc = [CO 2 ] 2 - 4 ⋅ 0,0092 = 0,9816 mol/L 2 2 ⋅ 0,0092 [Cu2O] = = 0,0092 mol/L 2 0,0092 [O2] = = 0,0046 mol/L 2 [CuO] = lo que quiere decir que en la descomposición térmica del carbonato de calcio, si se hace en un recipiente cerrado, el equilibrio se alcanza una vez que se obtienen una determinada concentración de CO2 y daría igual la cantidad de sólidos que haya. Puesto que la Kp = p CO 2 podríamos decir, de manera análoga, que el equilibrio se alcanzaría cuando la presión del CO2 llegue a un determinado valor. Ejemplo E5A.S2009 Naturalmente, si solamente nos limitamos a calcular la concentración de O2 en el equilibrio, que es lo que nos preguntan, lo resolvemos más rápidamente teniendo en cuenta que: n 0,49 p O2 V = n O 2 R T → [O 2 ] = O 2 = P = = 0,0046 moles / L V R T 0,082 ⋅ ( 273 + 1024) b) El número de moles de CuO en el equilibrio es = 2−4x = 2−4.0,0092 = 1,9632 moles y por tanto, como su Pm=79,5g/mol , el número de gramos es: En un recipiente de 2L de capacidad, en el que previamente se ha hecho el vacío, se introducen 2 moles de CuO. Se cierra el recipiente, se calienta a 1024ºC y se establece el siguiente equilibrio: 4 CuO(s) ⇄ 2 Cu2O(s) + O2(g) Sabiendo que el valor de la constante Kp es 0,49 a esa temperatura, calcule: a) La concentración molar de oxígeno en el equilibrio. b) Los gramos de CuO que hay en el equilibrio. Datos: R = 0,082 atm.L.K−1.mol−1. Masas atómicas: Cu = 63,5; O = 16 grCuO = nºmolesCuO*PmCuO = 1,9632.79,5 = 78,037 grCuO 163 164 FACTURES QUE AFECTAN AL EQUILIBRIO. LEY de LE CHATELIER Sabemos que para una reacción las constantes de equilibrio Kc y Kp, obviamente son constantes a una temperatura dada, pero varían mucho con la temperatura, por lo que ésta es uno de los factores que afecta al equilibrio. Por otro lado, hemos visto que la constante de equilibrio depende de las concentraciones de las especies y de las presiones parciales (en el caso de gases), por lo que si una vez alcanzado el equilibrio modificásemos una de ellas deben variar todas hasta conseguir que la constante vuelva a tener su valor. Así pues, el equilibrio de una reacción química puede alterarse mediante tres factores: La temperatura, la concentración y la presión El principio de Le Chatelier dice que “si en un sistema en equilibrio se modifica uno de los factores que afectan al mismo (concentración, presión, volumen o temperatura), el sistema evoluciona de la forma que permita restablecer el equilibrio”. 1. Efecto de la temperatura: Supongamos la síntesis de amoníaco, según el proceso Haber: viendo la expresión de la constante, resulta evidente que si disminuimos la concentración de NH3, es decir si disminuimos el numerador, también debe disminuir el denominador para que el cociente siga siendo constante, o lo que es lo mismo debe disminuir la concentración de reactivos H2 y N2. 3. Efecto de la presión: La presión solo influye en las reacciones donde haya gases, ya que los líquidos y sólidos no se afectan apenas por los cambios de presión. (Lo mismo puede decirse del volumen, que como sabemos es inversamente proporcional a la presión de acuerdo con la ley de Boyle–Mariotte.) Naturalmente nos referimos a un cambio de la presión total, ya que alterar la presión n parcial de uno de los gases equivaldría a variar su concentración ( p i = i RT ) y V estaríamos en el caso anterior. De acuerdo con el principio de Le Chatelier, un aumento de presión hace que el equilibrio se desplace hacia donde menos moles de gases hay. Es fácil de justificar, por ejemplo, en la síntesis del NH3 la Kp a 500ºC es: 3 H2(s) + N2(g) ⇄ 2 NH3(g) + calor ∆H = – 92.4 KJ Como vemos, en la reacción de síntesis del NH3 se produce calor (es exotérmica), por lo tanto, si una vez alcanzado el equilibrio, disminuimos la temperatura, de acuerdo con el principio de Le Chatelier la reacción irá hacia la derecha con objeto de “reponer” el calor que hemos quitado, hasta alcanzar un nuevo equilibrio. (Al contrario ocurriría si aumentamos la temperatura, con lo que se favorecería la descomposición del amoníaco.) Quiere decir que una reacción exotérmica, como es el caso, se favorece disminuyendo la temperatura. A una presión de 30 atm, el porcentaje de NH3 en el equilibrio es de casi el 70% a 200ºC y solo del 6% a 450ºC. No obstante las cosas no son tan sencillas, ya que si la temperatura se hace muy baja, disminuye mucho la energía de las moléculas y por tanto la velocidad de la reacción, lo que no es aceptable en un proceso industrial. Por ese motivo, en el proceso Haber el amoníaco se sintetiza a una temperatura de 450−500ºC y el rendimiento se mejora variando los demás factores de los que depende el equilibrio. n NH 3 V 2 [ NH 3 ] Kc = = 3 3 [H 2 ] [N 2 ] n H 2 n N 2 V V 2 = n 2NH 3 n 3H 2 ⋅ n N 2 ⋅ V 2 = 0,058 De acuerdo con la ley de Boyle–Mariotte al aumentar la presión disminuye el volumen V, con lo que para que la constante siga manteniendo su valor es preciso que el factor n 2NH 3 / n H 2 ⋅ n 3N 2 aumente, y eso significa que debe aumentar el numerador y disminuir el denominador, o lo que es igual que la reacción se desplaza hacia la formación de NH3 hasta alcanzar un nuevo equilibrio Del razonamiento anterior se deduce que si hay el mismo número de moles de elementos gaseosos a uno y otro lado de la reacción, los cambios de presión no le afectan, ya que en tal caso Kc no depende del volumen. 2. Efecto de la concentración: De acuerdo con el principio de Le Chatelier, si en la reacción anterior retiramos el amoníaco formado la reacción evolucionará para reponerlo, con lo que se favorece la síntesis. Es fácil de justificar ya que la constante de equilibrio de la reacción a una temperatura dada es constante y no depende de la concentración de las especies, por ejemplo a 500ºC es: Kc = [NH 3 ]2 = 0,058 [H 2 ]3 [N 2 ] 165 166 ∆G = ∆H – T∆S Ejemplo E1A.S2009 Considere el siguiente sistema general en equilibrio: a A(g)+ b B(g) ⇄ c C(g) + d D(g) ∆H<0 a) Indique razonadamente en qué caso serán iguales los valores de Kc y Kp b) Justifique cómo afectará al sistema la continua eliminación del producto C formado. c) Razone cómo afectará al sistema una disminución de la temperatura manteniendo el volumen constante. Si igualamos las dos expresiones: ln Kp = Como tanto la entalpía, como la entropía varían muy poco con la temperatura, podemos considerarlas como si fuesen constantes, y por tanto tenemos que: a) Deducir la expresión Kp = Kc ⋅ ( RT) ∆n de la que se concluye que cuando ∆n=0, Kp y Kc son iguales, en este caso cuando: c+d = a+b − ∆H + cons tan te Kp = e RT Lo que quiere decir que (como habíamos razonado a partir de Le Chatelier): b) De acuerdo con el principio de Le Chatelier, al disminuir la concentración de C la reacción evolucionará en el sentido de reponer el producto C, es decir irá hacia la derecha hasta alcanzar un nuevo equilibrio. • Si ∆H es + (reacc. endotérmica) al aumentar T aumenta Kp, es decir la reacción se desplaza hacia la derecha, a la formación de productos. • Si ∆H es – (reacc. exotérmica) al aumentar T disminuye Kp, es decir la reacción se desplaza hacia la izquierda Por otro lado, de acuerdo con la expresión de la constante de equilibrio Kc = − ∆G − ∆H ∆S = + RT RT R [C]c [D]d [A ]a [B]b Ejemplo E2A.S2009 resulta evidente que al eliminar C, es decir disminuir el numerador, para que la constante mantenga su valor es necesario que disminuya el denominador (las concentraciones de los reactivos), es decir que la reacción irá hacia la derecha, tal como predecía el principio de Le Chatelier. c) Puesto que la variación de entalpía de la reacción es negativa, quiere decir que la energía de los productos es menor que la de los reactivos, y por tanto que se trata de una reacción exotérmica, es decir, que en ella se produce calor, como si fuese un producto más de la reacción. Si enfriamos, es decir, si retiramos el calor formado, de acuerdo con el principio de Le Chatelier la reacción irá hacia la derecha para reponer el calor quitado. Considere el siguiente sistema en equilibrio: I2(g) + 5CO2(g) ⇄ 5 CO(g) + I2O5(s) ∆H=+1175KJ Justifique el efecto que tendrá sobre los parámetros que indican el cambio que se propone: Cambio Efecto sobre a) Aumento de la temperatura Kc b) Adición de I2O5(s) Cantidad de I2 c) Aumento de la presión Cantidad de CO a) Una variación en la temperatura cambia el valor de la constante de equilibrio, ya que como hemos visto influye en las velocidades de la reacción directa e inversa y lo hace de manera distinta, con lo que cambian los valores de las concentraciones de las sustancias presentes en el equilibrio. VARIACIÓN DE LA CONSTANTE DE EQUILIBRIO CON LA TEMPERATURA. Mediante razonamientos termodinámicos puede demostrarse la relación que existe entre la energía libre de Gibbs normal de reacción: Como la variación de entalpía es positiva, la reacción es endotérmica, es decir que absorbe calor, y en consecuencia al aumentar la temperatura (sería como si aumentamos la concentración de uno de los reactivo) el equilibrio de la reacción se desplazará hacia la derecha. ∆G = – RT.lnKp Por otro lado, y tal como acabamos de ver, la relación entre la constante de equilibrio y la temperatura: esa relación es muy importante porque permite calcular las energías libre de formación estándar de las sustancias que intervienen en la reacción, ya que como sabemos: Kp = e ∆G°reacc = ∆G°f (productos) – ∆G°f (reactivos) Teniendo en cuenta, que por otro lado, ya hemos visto la relación entre la energía libre de Gibbs y con la entalpía y la entropía: 167 − ∆H + cons tan te RT si la variación de entalpía es positiva, el aumento de T hace que aumente exponencialmente la constante de equilibrio, y por tanto que éste de desplace hacia la derecha. b) Un aumento de la concentración de I2O5(s) no tendrá muchas consecuencias ya que 168 se trata de un sólido. CONCEPTO DE SOLUBILIDAD c) El aumento de la presión hará que la reacción se desplace hacia la derecha que es donde menos moles de gases hay, con lo que se favorecerá la formación de CO. Ya hemos visto que los compuestos iónicos forman cristales bastante estables y que para disolverlos es necesario vencer su energía reticular (Ur), que es proporcional a la carga de los iones e inversamente proporcional a la distancia que los separa, es decir al tamaño de los iones. 5 [CO] [I 2 ][CO 2 ]5 5 Kc = n CO V = n I 2 n CO 2 V V 5 = n 5CO ⋅V n I 2 ⋅ n 5CO 2 El agua es capaz de disolver a la mayoría de las sales, en primer lugar porque es polar y tiene un momento dipolar muy grande, pero además porque tiene una constante dieléctrica muy grande (80 veces mayor que para el vacío), lo que hace que la fuerza de Coulomb que mantiene unidos a los iones disminuya 80 veces respecto de la que tienen en el aire. De acuerdo con la ley de Boyle–Mariotte al aumentar la presión disminuye el volumen V, con lo que para que la constante siga manteniendo su valor es preciso que el factor n 5CO / n I 2 ⋅ n 5CO 2 aumente, y eso significa que debe aumentar el numerador, o lo que es igual, que la reacción se desplaza hacia la formación de CO hasta alcanzar un nuevo equilibrio. La reacción de solvatación (o hidratación cuando el disolvente es agua) es aquella en la que como resultado se obtienen los iones disueltos, y a la energía puesta en juego se le llama entalpía de solvatación. Se escribe como: NaCl(s) → Na+(aq) + Cl− (aq) ∆Hs La energía desprendida en la solvatación (∆Hs) es la que contribuye principalmente a vencer la energía de red (Ur) necesaria para romper el cristal. De todas formas para que la reacción tenga lugar es necesario, como siempre, que la variación de energía libre de Gibbs sea negativa, que como sabemos es ∆G = ∆H − T∆S. • Los razonamientos sobre la variación de entalpía de una reacción de hidratación son muy complicados, porque los mismos factores que hacen aumentar la energía de red (carga y tamaño de los iones) son los que afectan también a la entalpía de hidratación. • Por otro lado, sabemos que, un cristal es una estructura muy ordenada, mientras que al disolverse los iones pasan a tener un mayor desorden, por lo que siempre irá acompañado de un aumento de entropía. Por tanto, al ser ∆S positivo, eso explica que por lo general el aumento de temperatura haga que las sales sean más solubles puesto que hace que ∆G se haga más negativa. Los compuestos iónicos se pueden dividir en 2 grupos: electrolitos fuertes y electrolitos débiles. Los electrolitos fuertes son aquellos que son muy solubles y se ionizan casi al 100% NaCl(s) → Na +(aq) + Cl− (aq) Los electrolitos débiles, o sales poco solubles o insolubles, son aquellos que se disuelven menos del 5%. Estrictamente hablando no existen sales insolubles, porque aun en el peor de los casos siempre hay una cantidad, aunque sea ínfima, que se disuelve, lo que ocurre es que enseguida se saturan y se llega a un equilibrio en que los iones disueltos vuelven a unirse para formar la sal: AgCl(s) ⇄ Ag+(aq) + Cl− (aq) En la siguiente tabla se indica, de manera cualitativa, la solubilidad de las sales insolubles mas corrientes: 169 170 Aniones Cl−, Br−, I− hidróxidos, S2− sulfatos Carbonatos, PO43− Nitratos, Cloratos Cationes solubles todos menos → alcalinos, alcalinotérreos, NH4+ todos menos → alcalinos, NH4+ todos Cationes insolubles Ag+, Pb2+, Hg+, Cu+ el resto Sr2+, Ba2+, Pb2+ el resto Ejemplo: Sabiendo que el producto de solubilidad del PbI2 es 9,8.10−9, calcular: a) La solubilidad del PbI2 b) La concentración de los iones de una disolución saturada de PbI2 a) PRODUCTO DE SOLUBILIDAD moles iniciales moles equilibrio PbI2(s) no no – x Como ya hemos dicho, cuando una sal es insoluble o poco soluble lo que ocurre es que pronto se satura y se alcanza el equilibrio entre el sólido, o precipitado, y sus iones en disolución: AgCl(s) ⇄ Ag+(aq) + Cl− (aq) Concentrac. eq. sólido Se puede poner mejor: Como vemos, se trata de un equilibrio heterogéneo, para el que podemos escribir la constante de equilibrio: K = Ag + Cl − [ Concentrac. inic Concentrac. eq. ][ ] 0 s [ 0 2s ][ ] 2 sustituyendo: 9,8 ⋅10 −9 = s ⋅ (2s) 2 A la constante de equilibrio entre una sal y sus iones (que por otro lado no tiene nada más de especial) se le da el nombre Producto de solubilidad y se le designa con la letra Ks o bien Ps. Por tanto, en adelante escribiremos: ][ ] Ks = Ag + Cl − ][ ] 9,8 ⋅ 10 −9 = 1,35 ⋅ 10 −3 moles / L 4 s=3 b) La concentración de Pb2+ en el equilibrio, como se deduce de la reacción, coincide con la solubilidad y la de ioduro es el doble: [Pb ] = s = 1,35 ⋅10 moles / L [I ] = 2s = 2,70 ⋅10 moles / L 2+ • Quiere decir que una disolución que contenga iones Ag+ e iones Cl− empezará a precipitar cuando el producto de sus concentraciones sea igual a Ks • Evidentemente, cuando más insoluble sea una sal más desplazado estará el equilibrio hacia la izquierda y por tanto menor será su constante de equilibrio o Producto de solubilidad. • Por otro lado, también resulta claro que, si Ag + Cl − < Ks no se formará precipitado, porque aun no se ha llegado al equilibrio. En este concepto se basa precisamente el procedimiento para disolver una sal insoluble, en disminuir de alguna manera la concentración de, al menos, uno de los iones. • El Producto de solubilidad, como una constante de equilibrio que es, depende de la temperatura. Normalmente los valores que se suelen tabular para una temperatura de 25ºC • Se llama solubilidad (s) al número de moles/L de sal que se disuelven. (Es lo que en los ejercicios de equilibrios expresábamos con x, pero en moles/L, es decir, x/V) [ sólido sólido Ks = Pb 2 + I − donde hemos tenido en cuenta que al ser el AgCl un sólido (un precipitado), su concentración permanece constante (igual a su densidad) y en consecuencia se engloba dentro de la constante. [ ⇄ Pb2+ (ac) + 2 I−(ac) 0 0 x 2x x 2x =s = 2s V V −3 − −3 Ejemplo: Calcular el producto de solubilidad del bromuro de plata sabiendo que tiene una solubilidad de 1,36.10−4 gr/L. AgBr(s) ⇄ Ag+ (ac) + Br− (ac) Concentrac. inic Concentrac. eq. Sólido Sólido 0 s [ 0 s ][ ] K = Ag + Br − = s ⋅ s antes de sustituir debemos poner la solubilidad en moles/litro. Como PmAgBr es 186, y sabemos que M = g/L / Pm = 1,36.10−4 / 186 = 7,31.10−7 moles/L. Sustituyendo: [ ][ ] K = Ag + Br − = s ⋅ s = 7,31.10−7 . 7,31.10−7 = 5,34.10−13 171 172 el producto de las concentraciones de iones es muchísimo mayor que el valor de Ks, por tanto se obtendrá precipitado, porque las concentraciones de los iones en el equilibrio deben ser menores de las que hay inicialmente y eso solo se consigue formando precipitado. Ejemplo: Sabiendo que a 25ºC el producto de solubilidad del cloruro de plata es 1,77.10−10, si mezclamos 250 ml de CaCl2 0,01M con 250 ml de AgNO3 0,01M a) Razonar si se obtendría un precipitado de AgCl. b) Calcular la concentración de todos los iones después de la mezcla. b) La concentración de los iones Ca2+ y NO3− es 0,01M y 0,005M respectivamente. Las únicas concentraciones que varían son las de ion plata y de cloruro, ya que al mezclarse precipita parte de ellos: a) Tanto el CaCl2 como el AgNO3 son muy solubles, son de los llamados electrolitos fuertes, por lo que se supone que se disocian completamente, lo que quiere decir que cuando están en disolución lo que tenemos es: Ca+2 + 2 Cl− CaCl2 → Concentrac. inic Concentrac. eq. c 0 0 c AgNO3 → Ag+ Concentrac. inic Concentrac. eq. Ag+ + Cl− ⇄ AgCl c 0 Concentrac. inic Concentrac. eq. 0 2c = 0,02M 0 Sólido la constante de ese equilibrio, que como hemos visto puede escribirse como: [ ][ ] Ks = Ag + Cl − = (0,005 − c) ⋅ (0,01 − c) = 1,77 ⋅ 10 −10 + NO3− 0 c 0,005 0,01 0,005−c 0,01−c de donde c = 0,00499996 y las concentraciones de los iones serían: 0 c = 0,01M [Ag ]= 0,005 − 0,00499996 = 4 ⋅10 M [Cl ] = 0,01 − 0,00499996 = 5,00004 ⋅10 + −8 − quiere decir que lo que tenemos son 250 ml de una disolución que contiene iones cloruro en una concentración de 0,02M, y por otro lado otra 250 ml de otra disolución que contiene iones plata en una concentración de 0,01M. −3 M Ejemplo: Sabiendo que a 25ºC el producto de solubilidad del cromato de plata es 1,12.10−12, calcular la cantidad de ion plata que se puede agregar a una disolución 0,03 normal de K2CrO4 sin que se inicie la precipitación del mismo. Evidentemente al mezclar las dos disoluciones como el volumen se hace el doble, no es necesario ningún cálculo adicional para saber que las concentraciones de los iones se reducirán a la mitad, así que una vez mezclados tendremos que “inicialmente” la concentración de cloruro es 0,01M y la de iones plata 0,005M. . Teniendo en cuenta que N=M ν y que para una sal ν = nº átomos del metal por su valencia, que en este caso es 2, tenemos que: MK2CrO4 = N/ ν = 0,03/2 = 0,015 moles/L Ag+ (ac) + Cl− (ac) ⇄ AgCl(s) K= por tanto es igual ponerlo como: 1 1 [Ag ][Cl ] = Ks + [ K2CrO4 → 2 K+ + CrO42− − Concentrac. inic Concentrac. eq. ][ ] Ks = Ag + Cl − [Ag ][Cl ] = 0,005 ⋅ 0,01 = 5 ⋅10 − −5 c 0 0 2c 0 c = 0,015M Por otro lado, una vez que comencemos a añadir iones de plata, al principio, cuando haya pocos se mantendrán en disolución, pero en el momento en que el producto de sus concentraciones iguale o supere el producto de solubilidad empezará a precipitar. del producto de las concentraciones de iones que tenemos, resultaría: + El cromato potásico es una sal soluble (electrolito fuerte), por tanto podemos suponer que se encuentra disociada completamente. Pero antes debemos calcular la concentración en moles/L, ya que esta es la forma en que aparecen las concentraciones en la Ks. >> Ks 173 La cantidad mínima de Ag+ para que se produzca precipitado es aquella que satisface a 174 EFECTO DEL ION COMÚN la ecuación de su producto de solubilidad, teniendo en cuenta que la concentración de ion dicromato es 0,015M, por tanto: Cuando a una disolución saturada (está en equilibrio entre el sólido y los iones en disolución) le agregamos alguna sustancia que aporte un ión común, entonces rompemos el equilibrio y de acuerdo con el principio de Le Chatelier, la reacción evoluciona hacia la formación de más precipitado para restablecer el equilibrio. El resultado, por tanto, es que cuando aportamos un ion común disminuimos la solubilidad de la sal. Vamos a verlo con el cloruro de plata que tiene una Ks = 1,77.10−10. ⇄ 2 Ag+ + CrO42− Ag2CrO4 [ Ks = Ag + sustituyendo: ] [CrO ] 2− 2 4 [ ] 2 1,12 ⋅ 10 −12 = Ag + 0,015 [ 1. Si añadimos una cucharada de AgCl en un vaso de agua comenzará a disolverse y rápidamente se establecerá un equilibrio entre el sólido y los iones en disolución. ] de donde Ag + = 8,64 ⋅ 10 −6 moles / L ⇄ Ag+ + Cl− Concentrac. eq s s Ks = Ag + Cl − = s·s = 1,77.10−10 ⇒ s = 1,33·10−5 mol/L AgCl que si la multiplicamos por la masa atómica de la plata podremos expresarla en gramos por litro, así: Ag + = 8,64 ⋅ 10 −6 ⋅ 108 gr / L = 9,33⋅10 −4 gr / L = 0,933 mgr / L Así que hay que podemos agregar hasta una cantidad inferior a 0,933 miligramos por litro de plata. Al llegar a esa cantidad se iniciará la precipitación del cromato de plata. [ ] [ ][ ] Ejemplo EJA.S2010 Se dispone de una disolución acuosa saturada de Fe(OH)3, compuesto poco soluble. a) Escriba la expresión del producto de solubilidad para este compuesto. b) Deduzca la expresión que permite conocer la solubilidad del hidróxido a partir del producto de solubilidad . c) Razone cómo variará la solubilidad del hidróxido al aumentar el pH de la disolución. a) De la estequiometría de la reacción se deduce que por cada mol que se disuelve de hidróxido de hierro (III) se forman 1 mol de Fe3+ y 3 moles de OH−. (Algunos alumnos se preguntan si se disolverá más sal si ponemos más cantidad de agua. Efectivamente así es, tendríamos más sal disuelta en más volumen de disolución, pero la concentración de los iones en disolución seguiría siendo la misma, tal que Ks = Ag + Cl − ) Fe(OH)3 ⇄ Fe3+ + 3 OH− Concentrac. inic Concentrac. eq. Sólido Sólido 0 s [ ][ Ks = Fe 3+ OH − [ 0 3s 2. Ahora imaginemos que a esa disolución le agregamos NaCl, que es una sal muy soluble, y por tanto se disociará “completamente” y precisamente aporta un ion común, el Cl–. De acuerdo con el principio de Le Chatelier, al aumentar la concentración de cloruro la reacción se desplazará hacia la izquierda para restablecer el equilibrio, es decir, hacia la formación de precipitado. ] 3 b) Sustituyendo en la expresión del producto de solubilidad las concentraciones de iones en el equilibrio: Ks → s=4 Ks = s ⋅ (3s) 3 27 c) Como veremos más adelante, un aumento de pH se produce como consecuencia un aumento de la concentración de OH−, por tanto si aumentamos la OH − , de acuerdo con el principio de Le Chatelier, la reacción se desplazará hacia la izquierda, hacia la formación de precipitado, hasta alcanzar un nuevo equilibrio, y la consecuencia es que la sal se hará aun más insoluble. [ ][ ] ] 175 176 Supongamos que la cantidad de cloruro sódico agregada a la disolución es tal que tiene una concentración 0,1M. Como es muy soluble y se disocia totalmente NaCl → Na+ + Cl−, eso quiere decir que aportará a disolución una [Na+]=[Cl−]=0,1M Por tanto, en el vaso la [Cl−] será la debida a la que proviene de la disolución del AgCl más la que proviene del NaCl. Concentrac. eq AgCl ⇄ Ag+ + Cl− Sólido s s + 0,1 ≈ 0,1 a) Cuando el CaF2 se disuelve en agua pura, el único aporte de iones se debe a la disociación del mismo y alcanzará el equilibrio cuando: Aproximación: Puesto que la solubilidad es muy pequeña comparado con la concentración proveniente de NaCl podemos hacer la aproximación de que s+0,1=0,1, es decir, que prácticamente la concentración de cloruro es la que proviene de la sal soluble. De esta forma facilitamos los cálculos sin cometer error apreciable. [ ][ ] Ks = Ag + Cl − = s ⋅ (s + 0,1) ≈ s ⋅ 0,1 = 1,77 ⋅ 10 −10 ⇒ Ejemplo: Sabiendo que la Ks del CaF2 a 25 ºC es 3,45.10−11, calcular la concentración de calcio: a) Si se disuelve fluoruro cálcico en agua a esa temperatura. b) Si le añade fluoruro sódico hasta que la concentración sea 0,1M CaF2 ⇄ Ca2+ + 2 F− Sólido 0 0 Sólido s 2s Concentrac. inic Concentrac. eq. [ s = 1,77·10−9 mol/L (puede resolver la ecuación s ⋅ (s + 0,1) = 1,77 ⋅ 10 −10 y verás que el resultado es el mismo que el que se obtiene resolviendo la aproximacion s ⋅ 0,1 = 1,77 ⋅ 10 −10 ) s=3 [ −4 b) Cuando se añada el NaF, hasta que la concentración sea 0,1M, como esta sal es muy soluble se disociará completamente, y por tanto, la concentración final de iones Na+ y de iones F− será 0,1M, ya que: NaF → Na+ Conclusión: Añadiendo un reactivo con un ion común podemos llegar a precipitar casi completamente el ion no común. Ello resulta fácil de entender ya que al ser la Ks una constante y ser igual al producto de las concentraciones de los iones, si una aumenta la otra debe disminuir: [ ] 3,4 ⋅ 10 −11 = 2,05 ⋅ 10 − 4 moles / L 4 −4 − [Ag+] = s = 1,77·10−9 mol/L [Cl−] = s+0,1 = 0,1 mol/L [Na+] = 0,1 mol/L ][ ] = s ⋅ ( 2s) 2 = 3,45 ⋅ 10 −11 [Ca ] = s = 2,05 ⋅10 moles / L [F ] = 2s = 4,10 ⋅10 moles / L 2+ [ 2 La concentración de Ca2+ en el equilibrio, como se deduce de la reacción, coincide con la solubilidad y la de fluoruro es el doble: En la disolución, después de agregar el NaCl y una vez restablecido el equilibrio la concentración de iones que tenemos es: Ks = Ag + Cl − ][ ] Ks = Ca 2+ F − Concentrac. inic Concentrac. eq. ] Si Cl − ↑ entonces Ag + ↓ Este procedimiento se emplea en análisis para precipitar los iones y en la industria para la precipitación de los iones valiosos. c 0 0 c + F− 0 c = 0,1M por tanto, si despreciamos el aporte de iones F− que provienen del CaF2 porque son una cantidad despreciable, podemos suponer que todos los iones que hay son los que ha aportado el NaF al disociarse, y como la constante del producto de solubilidad del CaF2 debe permanecer constante, si no se varía la temperatura, es decir: CaF2 ⇄ Ca2+ + 2 F− Sólido 0 0,1 Sólido s 2s+0,1 ~ 0,1 Concentrac. inic Concentrac. eq. [ ][ ] = [Ca ]⋅(0,1) Ks = Ca 2+ F − [ 2 2+ 2 = 3,45 ⋅ 10 −11 ] de donde Ca 2+ = 3,45.10−9 moles/L 177 178 Ejemplo: Una disolución contiene iones Cl− y I− en una concentración 0,01M. Si comenzamos a añadir nitrato de plata: a) Cual de los iones precipita primero y cual será la concentración mínima de plata para que precipite. b) Cual es la máxima concentración de plata para que no llegue a precipitar el otro ión. Datos: KsAgCl = 1,77.10−10; KsAgI = 8,52.10−17 a) Esto es lo que se conoce como precipitación fraccionada, ya que tenemos dos iones que son susceptibles de precipitarse por el mismo ion, así que debemos cuidar su concentración si no queremos que nos precipiten los dos. a) El CaI2 es una sal muy soluble, por tanto los 2 g de CaI2 se disolverán completamente en los 500mL de agua. Su concentración, si no hay variación de volumen, será M=(mol)/L=(2/294)/0,5=0,0136M. Al disolverse completamente el CaI2 se encontrará disociado completamente (electrolito fuerte), por tanto: CaI2 → Ca2+ + 2 I− concentrac. inic 0,0136 − − concentrac. final − 0,0136 2*0,0136 ⇒ [I−]=0,0272M Obviamente, a la vista del valor de sus constantes del producto de solubilidad, el más insoluble es el ioduro de plata, que es el que tiene la constante más pequeña, por tanto será el primero que comience a precipitar inmediatamente que el producto de sus concentraciones sea igual a su Ks: [ ][ ] Ks AgI = Ag + I − . −17 8,52 10 [ [ = Ag b) El HgI2 es una sal muy poco soluble, por tanto da igual que echemos 2 gr o 4 gr en medio 500mL de agua como si los agregamos a 2 litros, porque no van a disolverse porque enseguida se llegará a un equilibrio entre la pequeña cantidad de iones disueltos y el sólido: HgI2 ⇄ Hg2+ + 2 I− concentrac. inic sólido − − concentrac. final sólido s 2s ] 0,01 + . ] de donde Ag + = 8,52.10−15 moles/L. Cuando la concentración de plata sea esa, se iniciará la precipitación del ioduro, pero aun nada del cloruro. b) La máxima concentración de plata que precipita ioduro y no precipita el cloruro, será la inferior a la mínima necesaria para que comience la precipitación del cloruro. Haciendo como antes, pero ahora para el cloruro: [ Ks = [Hg2+]·[I−]2 = s·(2s)2 = 2,9·10−29 [I−]=3,8·10−10M ][ ] Ks AgCl = Ag + Cl − [ ⇒ s = 1,9·10−10M ⇒ c) Cuando agreguemos los 2g de HgI2 a + los 2g de CaI2 estaremos aportando un ión común, de manera que si el HgI2 era poco soluble ahora lo será aún menos. La concentración de ioduro ahora será la que proviene de la sal soluble 0,0272M más la concentración despreciable que provenga del HgI2. Por tanto, sin error significativo, podemos decir que [I−] ≈ 0,0272M ] 1,77.10−10 = Ag + .0,01 [ Ejemplo: Calcule la concentración de ión yoduro en los siguientes casos: a) Cuando se agregan 2 gr de yoduro de calcio a 500 mL de agua. b) Cuando se agregan 2 gr de yoduro de mercurio (II) a 500 mL de agua. c) Cuando se agregan 2 gr de HgI2 y otros 2gr CaI2 a 500 mL de agua. Datos: supóngase que la adición del sólido no modifica el volumen final Producto de solubilidad del HgI2 = 2.9×10−29. Masas atómicas: Ca=40; Cl=35,5 ] de donde Ag + = 1,77.10−8 moles/L. Cuando la concentración de plata sea esa, se iniciará la precipitación del cloruro, así que como no queremos que precipite debemos procurar que la concentración de plata no alcance nunca ese valor. Otra cosa sería si nos preguntasen cual es, en este caso, la concentración de Hg2+, porque aunque debido al efecto del ión común sea mucho menor, algo se disolverá: Resumiendo: Para que se inicie la precipitación del ioduro es necesario una concentración de plata 8,52.10−15 moles/L y no debe superar la de 1,77.10−8 moles/L o entonces empezará también a precipitar el otro anión. concentrac. inic concentrac. final HgI2 ⇄ sólido sólido Hg2+ + 2 I− − 0,0272 s 2s+0,0272 ≈ 0,0272M Ks = [Hg2+]·[I−]2 = s·(0,0272)2 = 2,9·10−29 ⇒ s = 3,9·10−26M = [Hg2+] Fíjate que la concentración de yoduro que proviene exclusivamente de la escasa disolución de HgI2 sería [I−]=2·s=7,8·10−26M . Por tanto comprenderás lo acertada que ha sido la suposición de que prácticamente todo el yoduro se debe a la disociación de CaI2, sal muy soluble, ya que [I−]=7,8·10−26+0,0272 ≈ 0,0272M 179 180 PRODUCTO DE SOLUBILIDAD Aluminium hydroxide Aluminium phosphate Barium bromate Barium carbonate Barium chromate Barium fluoride Barium hydroxide octahydrate Barium iodate Barium iodate monohydrate Barium molybdate Barium nitrate Barium selenate Al(OH)3 3×10−34 Lead(II) iodate Pb(IO3)2 3.69×10−13 AlPO4 9.84×10−21 Lead(II) iodide PbI2 9.8×10−9 Ba(BrO3)2 BaCO3 BaCrO4 BaF2 2.43×10−4 2.58×10−9 1.17×10−10 1.84×10−7 Lead(II) oxalate Lead(II) selenate Lead(II) sulfate Lead(II) sulfide PbC2O4 PbSeO4 PbSO4 PbS 8.5×10−9 1.37×10−7 2.53×10−8 3×10−28 Ba(OH)2×8H2O 2.55×10−4 Lithium carbonate Li2CO3 8.15×10−4 Ba(IO3)2 4.01×10−9 Lithium fluoride LiF 1.84×10−3 Ba(IO3)2×H2O 1.67×10−9 Lithium phosphate Li3PO4 2.37×10−4 BaMoO4 3.54×10−8 Magnesium ammonium phosphate Magnesium carbonate Magnesium carbonate pentahydrate Magnesium fluoride Magnesium hydroxide Magnesium oxalate dihydrate Magnesium phosphate Manganese(II) carbonate Manganese(II) iodate Manganese(II) hydroxide Manganese(II) oxalate dihydrate MgNH4PO4 3×10−13 Ba(NO3)2 BaSeO4 4.64×10 −3 3.40×10 −8 −10 Barium sulfate Barium sulfite Beryllium hydroxide Bismuth arsenate BaSO4 BaSO3 1.08×10 5.0×10−10 Be(OH)2 6.92×10−22 BiAsO4 4.43×10−10 Bismuth iodide BiI 7.71×10−19 Cadmium arsenate Cadmium carbonate Cd3(AsO4)2 2.2×10−33 Cadmium fluoride Cadmium hydroxide Cadmium iodate Cadmium oxalate trihydrate Cadmium phosphate Cadmium sulfide Caesium perchlorate Caesium periodate Calcium carbonate Calcium fluoride Calcium hydroxide Calcium iodate Calcium iodate hexahydrate Calcium molybdate Calcium oxalate monohydrate Calcium phosphate Calcium sulfate Calcium sulfate dihydrate Calcium sulfate hemihydrate Cobalt(II) arsenate Cobalt(II) carbonate Cobalt(II) hydroxide CdCO3 1.0×10 −12 −3 MgCO3 MgCO3×5H2O −6 6.82×10 −6 3.79×10 −11 MgF2 Mg(OH)2 5.16×10 5.61×10−12 MgC2O4×2H2O 4.83×10−6 Mg3(PO4)2 1.04×10−24 MnCO3 2.24×10−11 Mn(IO3)2 4.37×10−7 Mn(OH)2 2×10−13 MnC2O4×2H2O 1.70×10−7 Iron(III) hydroxide CdF2 6.44×10 Cd(OH)2 7.2×10−15 Manganese(II) sulfide MnS 3×10−11 Cd(IO3)2 2.5×10−8 Mercury(I) bromide Hg2Br2 6.40×10−23 CdC2O4×3H2O 1.42×10−8 Mercury(I) carbonate Hg2CO3 3.6×10−17 Cd3(PO4)2 2.53×10−33 Mercury(I) chloride Hg2Cl2 1.43×10−18 −27 −6 CdS 1×10 Mercury(I) fluoride Hg2F2 3.10×10 CsClO4 3.95×10−3 Mercury(I) iodide Hg2I2 5.2×10−29 CsIO4 CaCO3 CaF2 Ca(OH)2 Ca(IO3)2 5.16×10−6 3.36×10−9 3.45×10−11 5.02×10−6 6.47×10−6 Mercury(I) oxalate Mercury(I) sulfate Mercury(I) thiocyanate Mercury(II) bromide Mercury(II) hydroxide Hg2C2O4 Hg2SO4 Hg2(SCN)2 HgBr2 HgO 1.75×10−13 6.5×10−7 3.2×10−20 6.2×10−20 3.6×10−26 Ca(IO3)2×6H2O 7.10×10−7 Mercury(II) iodide HgI2 2.9×10−29 1.46×10 −8 Mercury(II) sulfide HgS 2×10−54 2.32×10 −9 Neodymium carbonate Nd2(CO3)3 1.08×10−33 −33 CaMoO CaC2O4×H2O Cobalt(II) iodate dihydrate Cobalt(II) phosphate Cobalt(II) sulfidα Cobalt(II) sulfidβ Copper(I) bromide Copper(I) chloride Copper(I) cyanide Copper(I) hydroxide Copper(I) iodide Copper(I) thiocyanate Copper(II) arsenate Copper(II) hydroxide Copper(II) iodate monohydrate Copper(II) oxalate Copper(II) phosphate Copper(II) sulfide Gallium(III) hydroxide Iron(II) carbonate Iron(II) fluoride Iron(II) hydroxide Iron(II) sulfide Ca3(PO4)2 CaSO4 2.07×10 4.93×10−5 Nickel(II) carbonate Nickel(II) hydroxide NiCO3 Ni(OH)2 1.42×10−7 5.48×10−16 CaSO4×2H2O 3.14×10−5 Nickel(II) iodate Ni(IO3)2 4.71×10−5 CaSO4×0.5H2O 3.1×10−7 Nickel(II) phosphate Ni3(PO4)2 4.74×10−32 Co3(AsO4)2 6.80×10−29 NiS 4×10−20 CoCO3 1.0×10−10 Nickel(II) sulfide Palladium(II) thiocyanate Pd(SCN)2 4.39×10−23 Co(OH)2 5.92×10−15 Potassium perchlorate KClO4 1.05×10−2 181 Iron(III) phosphate dihydrate Lead(II) bromide Lead(II) carbonate Lead(II) chloride Lead(II) chromate Lead(II) fluoride Lead(II) hydroxide Co(IO3)2×2H2O 1.21×10−2 Potassium periodate KIO4 3.71×10−4 Pr(OH)3 3.39×10−24 AgCH3COO Ag3AsO4 AgBrO3 AgBr Ag2CO3 1.94×10−3 1.03×10−22 5.38×10−5 5.35×10−13 8.46×10−12 CoS CoS CuBr CuCl CuCN 5×10 3×10−26 6.27×10−9 1.72×10−7 3.47×10−20 Praseodymium hydroxide Silver(I) acetate Silver(I) arsenate Silver(I) bromate Silver(I) bromide Silver(I) carbonate Cu2O 2×10−15 Silver(I) chloride AgCl 1.77×10−10 Silver(I) chromate Ag2CrO4 1.12×10−12 Co3(PO4)2 2.05×10 −35 −22 −12 CuI 1.27×10 CuSCN 1.77×10−13 Silver(I) cyanide AgCN 5.97×10−17 Cu3(AsO4)2 7.95×10−36 Silver(I) iodate AgIO3 3.17×10−8 Cu(OH)2 4.8×10−20 Cu(IO3)2×H2O CuC2O4 Cu3(PO4)2 CuS Ga(OH)3 Silver(I) iodide AgI 8.52×10−17 6.94×10 −8 Silver(I) oxalate Ag2C2O4 5.40×10−12 4.43×10 −10 Silver(I) phosphate Ag3PO4 8.89×10−17 1.40×10 −37 Silver(I) sulfate Ag2SO4 1.20×10−5 −37 Silver(I) sulfite Ag2SO3 1.50×10−14 −36 Silver(I) sulfide Ag2S 8×10−51 −11 Silver(I) thiocyanate Tin(II) hydroxide Zinc arsenate Zinc carbonate Zinc carbonate monohydrate AgSCN Sn(OH)2 Zn3(AsO4)2 ZnCO3 1.03×10−12 5.45×10−27 2.8×10−28 1.46×10−10 ZnCO3×H2O 5.42×10−11 Zinc fluoride ZnF 3.04×10−2 Zinc hydroxide Zinc iodate dihydrate Zinc oxalate dihydrate Zinc selenide Zinc selenite monohydrate Zinc sulfide Zn(OH)2 Zn(IO3)2×2H2O ZnC2O4×2H2O ZnSe 3×10−17 4.1×10−6 1.38×10−9 3.6×10−26 ZnSe×H2O 1.59×10−7 ZnS 2×10−25 8×10 7.28×10 FeCO3 FeF2 Fe(OH)2 FeS 3.13×10 2.36×10−6 4.87×10−17 8×10−19 Fe(OH)3 2.79×10−39 FePO4×2H2O 9.91×10−16 −6 PbBr2 PbCO3 PbCl2 PbCrO4 6.60×10 7.40×10−14 1.70×10−5 3×10−13 PbF2 3.3×10−8 Pb(OH)2 1.43×10 −20 182 TEMA 6 ACIDOS Y BASES Boyle estableció una serie de propiedades cualitativas comunes a los ácidos: ÁCIDOS Y BASES • • • • • Teoría de Arrhenius Teoría de Brönsted y Lowry Fuerza de acidos y bases y constante de equilibrio Producto iónico del agua Concepto de pH y pOH Hidrólisis Disoluciones reguladoras, amortiguadoras o tampones Son sustancias de sabor agrio (sabor ácido) Cambian el color de algunas sustancias, como el tornasol que lo vuelven rojo Disuelven muchas sustancias Contienen hidrógeno y lo desprenden al reaccionar lo los metales activos Pierden sus propiedades al reaccionar con las bases De la misma manera a las bases se les atribuyen las propiedades: • • • • Indicadores Valoraciones ácido – base Son sustancias de sabor amargo y untuosas al tacto Cambian de color algunas sustancias como el tornasol que lo vuelven azul Precipitan muchas sustancias Pierden sus propiedades al reaccionar con los ácidos TEORIA DE ARRHENIUS Arrhenius estableció una relación entre las propiedades de los ácidos y bases en disolución acuosa con la aparición de H+ y de OH− respectivamente. Diciendo: Ácido es aquella sustancia que al ionizarse en agua libera protones. (Hay que decir que los protones o iones hidrógeno o hidronio, están rodeados de varias moléculas de agua, por ese motivo también se representan como H3O+.) HCl → H+ + Cl− H2SO4 → 2 H+ + SO42− CH3COOH → H+ + CH3COO− Base es aquella sustancia que al ionizarse en agua librea iones hidroxilo: NaOH → Na+ + OH− Ca(OH)2 → Ca+ + 2 OH− NH4OH → NH4+ + OH− De acuerdo con la teoría de Arrhenius, la neutralización entre un ácido y una base, se entiende simplemente como la reacción entre los iones H+ y OH− dando agua, de manera que los otros iones simplemente hacen de meros espectadores. ( Na+ + OH− ) + ( H+ + Cl− ) → Na+ + Cl− + H2O Esto explica que, por ejemplo, la entalpía de la reacción de neutralización del NaOH por HCl sea igual a la entalpía de la reacción del KOH por HNO3, ya que realmente el calor que se libera en la reacción se debe a reacción de los iones H+ y OH− para dar H2O. 183 184 El amoníaco o el ion carbonato, que no pueden considerase como bases según la teoría de Arrhenius, sí lo son según la teoría de Brønsted y Lowry: Los problemas de la teoría de Arrhenius son: • Solamente puede aplicarse a sustancias cuando el disolvente es agua y no es válida para otros disolventes. Por ejemplo, el HCl se disuelve en benceno y no libera protones, ni conduce la corriente, pero sigue siendo capaz de cambiar el color de los indicadores. • No puede explicar cómo sustancias como el NH3 o el Na2CO3 pueden actuar como bases sin que contengan el grupo OH. NH3 + H2O ⇄ NH4+ + OH− base1 En 1923, de forma independiente, Johannes Brönsted y Martin Lowry propusieron una ampliación a la teoría de Arrhenius para explicar el carácter ácido o base de una sustancia. Ambos lo que hicieron fue considerar que el disolvente participa directamente en la reacción de disociación y de esta forma llegaron a la conclusión de que siempre hay una transferencia de un protón del ácido a la base: base2 ácido2 ácido1 base2 Como ves el agua unas veces puede comportarse como ácido (cediendo protones) y otras veces como base (aceptando los protones), dependiendo de a quien se enfrente. A estas sustancias se las llama anfóteras, por ejemplo el ion bicarbonato, HCO3− también puede comportarse como ácido o base: su ácido conjugado sería H2CO3 y su base conjugada sería CO32−. De acuerdo con esta teoría la reacción de neutralización sería: H3O+ + OH− ⇄ H2O + H2O HCl + H2O → Cl− + H3O+ • ácido1 CO32− + H2O ⇄ HCO3− + OH− base1 TEORIA DE BRÖNSTED Y LOWRY ácido2 ácido1 base2 base1 ácido2 Según la teoría de Brønsted y Lowry un ácido es toda especie (molécula o ión) capaz de ceder un protón y una base es toda especie capaz de aceptar un protón. • Cuando un ácido cede un protón se convierte en una base (su base conjugada) y de igual forma, la especie que acepta el protón se convierte en un ácido (su ácido conjugado) y podrían reaccionar entre sí para volver a dar las especies iniciales, así tenemos que: HCl + H2O ⇄ Cl− + H3O+ ácido1 base2 base1 ácido2 Ejemplo E5A.S2009 Complete los siguientes equilibrios ácido−base e identifique los pares conjugados, según la teoría de Brönsted−Lowry: a) ____ + H2O ⇄ HPO42− + H3O+ b) HCN + OH− ⇄ H2O + ____ c) ____ + H2O ⇄ HSO4− + H3O+ Como hemos visto, de acuerdo con la teoría de Brönsted−Lowry siempre: • En una reacción existen dos pares ácido – base conjugados, que en nuestro ejemplo son el ácido HCl y su base conjugada Cl− y por otro lado la base H2O y su ácido conjugado H3O+. Para distinguir el ácido de su base conjugada o viceversa, fíjate que lógicamente, el ácido siempre tiene un protón más. • Otra cuestión que puede servir como comprobante es que, como siempre, la carga debe conservarse, es decir que la carga de los reactivos debe ser igual a la de los productos. De acuerdo con la teoría de Brønsted y Lowry, los considerados ácidos no cambian con respecto a la teoría de Arrhenius, porque para ceder un protón es necesario que la sustancia posea por lo menos un átomo de hidrógeno. Pero en el caso de las bases; ahora no solamente serán los hidróxidos, porque para aceptar un protón no es necesario que la sustancia tenga iones hidróxido. 185 • A cada lado de la reacción debe haber una sustancia que cede los protones (ácido) y otra que los acepta (base). Eso es lo primero que debemos identificar • Una vez que sabemos el comportamiento ácido o base de la especie podremos deducir cual es su ácido o base conjugada, ya que el ácido siempre tendrá un hidrógeno más que su base conjugada a) ____ + H2O ⇄ HPO42− + H3O+ ácido1 base2 base1 ácido2 De acuerdo con los criterios anteriores, podemos ver en los productos que el ácido, naturalmente, es H3O+ así que por tanto la base debe ser HPO42− . Como consecuencia la especie que nos falta debe ser su ácido conjugado, por tanto le añadimos un hidrógeno y resultaría ser H2PO4− . 186 FUERZA DE ACIDOS Y BASES Y CONSTANTE DE EQUILIBRIO Fíjate que el procedimiento para deducir la especie que falta es sencillo y nos lleva de manera inequívoca a la especie que falta. Sin embargo si nos fijamos exclusivamente en la especie que falta y en la que se transforma, no siempre llegaremos a la solución. En este caso, sin ir más lejos, al ser anfótero el HPO42− actúa como base, pero si en lugar de enfrentarse al protón lo hiciera frente al OH− o al NH3 actuaría como ácido, y en tal caso su base conjugada sería PO43− Obviamente, de acuerdo con la teoría de Arrhenius, un ácido o una base son tanto más fuertes cuanto más protones o iones hidroxilo liberen al disociarse en agua, es decir cuanto más disociados estén. De la misma forma, de acuerdo con la teoría de Brönsted−Lowry, un ácido será tanto más fuerte cuanto mayor sea su tendencia a ceder protones y una base cuanto mayor sea su tendencia a aceptarlos. De esto se deduce que: b) HCN + OH− ⇄ H2O + ____ ácido1 base2 ácido2 base1 • La fuerza de un ácido o base dependerá de la naturaleza del disolvente en la medida de que éste tenga más o menos tendencia a aceptar o a ceder el protón. Para el estudio comparativo el disolvente será el agua. Siguiendo el mismo criterio, vemos ahora que el OH− es la base, así que el HCN debe ser el ácido. Como consecuencia lo que nos falta es su base conjugada que será igual con un hidrógeno menos, así que CN− • Un ácido fuerte tiene gran tendencia a ceder protones, desplazando mucho la reacción en ese sentido, y por tanto su base conjugada tendrá poca tendencia a aceptarlos, así que será débil. Y al contrario, una base fuerte tendrá un ácido conjugado débil. c) ____ + H2O ⇄ HSO4− + H3O+ ácido1 base2 base1 ácido2 Ahora vemos que el agua es la base porque acepta un protón y se transforma en H3O+, así que la especie que nos falta debe ser el ácido y tener un hidrógeno más que su base conjugada HSO4−, así que por tanto será H2SO4 fácil difícil HCl + H2O → ácido1 base2 Cl− + H3O+ base1 ácido2 Lo anterior podemos cuantificarlo si aplicamos la LAM al equilibrio de la reacción entre un ácido una base: Ejemplo E2A.S2008 HA + H2O Complete los siguientes equilibrios e identifique los pares ácido−base conjugados: a) _____ + H2O ⇄ CO32− + H3O+ b) NH4+ + OH− ⇄ H2O + _____ c) F− + H2O ⇄ OH− + _____ ácido1 ⇄ A− + H3O+ base2 base1 K= a) HCO3− + H2O ⇄ CO32− + H3O+ ácido1 base2 base1 ácido2 base2 ácido2 base1 c) F− + H2O ⇄ OH− + HF base2 ácido1 base1 [A ][H O ] − + 3 [HA ][H 2 O] (donde hemos considerado que al ser una reacción que tiene lugar en medio acuoso la variación de la concentración de agua es despreciable y puede considerarse constante (1000/18/1L=55,55M) e incluirse dentro de la constante, obteniéndose así lo que llamamos constante de acidez o constante de disociación del ácido, por compatibilizar con la teoría de Arrhenius, donde tendríamos simplemente que HA ⇄ A− + H+ b) NH4+ + OH− ⇄ H2O + NH3 ácido1 ácido2 Ka = K [H 2 O] = ácido2 [A ][H O ] − + 3 [HA] Como es de suponer, cuanto más desplazado esté el equilibrio hacia la derecha, (hacia la formación de protones), mayor será la fuerza del ácido, o lo que es igual: La constante de disociación nos da una medida de la fuerza del ácido, que es tanto mayor cuanto mayor sea su Ka. 187 188 Así que, un ácido fuerte es aquel que está disociado prácticamente en su totalidad, de manera que 1 mol de ácido HA daría lugar a 1 mol de H3O+ y a 1 mol de su base conjugada A− . Por el contrario un ácido débil es aquel que está muy poco disociado y que por tanto su Ka es muy pequeña. • El ácido más fuerte que puede existir en disolución acuosa es el H3O+ y cualquiera que esté por encima estará completamente disociado (su Ka es prácticamente infinito) De manera análoga puede definirse la Kb para la disociación de una base: B + H2O base2 ⇄ BH+ + HO− ácido1 ácido2 Dicho de otra forma, un ácido fuerte reacciona con la sal de otro ácido más débil dando lugar a la sal del fuerte y liberando el ácido débil, o bien que, la reacción estará desplazada hacia donde se forme el ácido más débil base1 HCl + H2O → K= [BH ][OH ] + − • La base mas fuerte que puede existir en agua es el OH−, y cualquiera que esté por debajo tendrá una base conjugada muy fuerte: [B][H 2 O] Kb = K [H 2 O] = Cl− + H3O+ ácido fuerte [BH ][OH ] + − [B] NH3 + HO− ← NH2− + H2O base fuerte La siguiente tabla representa la fuerza de los ácidos y de sus bases conjugadas HO− + HO− ← O2− + H2O base fuerte • No confundas la fuerza de un ácido, es decir su tendencia a dar protones, que viene cuantificado por su Ka, con el número de hidrógenos que tiene y que potencialmente puede ceder. Por ejemplo el HCl tiene un solo protón y es un ácido muy fuerte, mientras que el H2S tiene dos y es un ácido débil. Por otro lado, los ácidos polipróticos, no tienen la misma facilidad para ceder el primer protón que el segundo o el tercero si existe. Obviamente la tendencia a ceder protones irá disminuyendo y como consecuencia para cada ionizacion tendrá su propia constante. Por ejemplo en la tabla anterior puede verse como el ácido sulfúrico cede completamente el primer protón, pero el segundo ya le cuesta un poco, siendo la Ka = 1,3.10−2. Otro ejemplo lo tenemos en el H2CO3, o en el H3PO4, para el que pueden definirse tres constantes para las sucesivas pérdidas de protones: De la tabla se puede predecirse el sentido de una reacción ácido − base. • Puesto que un ácido fuerte tiene mayor tendencia tienen a ceder protones que uno débil, los ácidos que están más arriba reaccionarán con las bases conjugadas que están por debajo de él dando lugar al ácido débil y a la base conjugada del fuerte. Por ejemplo: El HCl puede reaccionar con el HCO3− y dará lugar a Cl− y H2CO3. H3PO4 + H2O ⇄ H2PO4− + H3O+ Ka1 = 7,5.10−3 H2PO4− + H2O ⇄ H2PO42− + H3O+ Ka 2= 6,2.10−8 HPO42− + H2O ⇄ PO43− Ka3 = 2,2.10−13 + H3O+ HCl + HCO3− → Cl− + H2CO3 189 190 El concepto de grado de disociación (α), ya definido para cualquier equilibrio en general, recuerda que se define como la fracción de 1 mol en que se disocia un compuesto. (también se entiende el grado de disociación como el tanto por uno que se disocia, de manera que si por ejemplo un ácido o base se disocia el 60%, entonces α=0,6) Simplemente a la hora de tratar el equilibrio se ignora el agua, ya que, al ser reacciones en medio acuoso, los cambios de concentración de agua debido a la reacción no afectan prácticamente a la concentración total de agua. HA + H2O ⇄ Concentrac. inic Concentrac. eq. co co – coα A− + H3O+ coα K= [CH COO ][NH ] = Ka + − 3 4 [CH 3 COOH][NH 3 ] ( CH 3COOH ) Ka ( NH + ) 4 = 1,8 ⋅ 10 −5 = 3,2 ⋅ 10 4 5,6 ⋅ 10 −10 el valor grande de la constante de equilibrio prueba que el equilibrio esté muy desplazado hacia la derecha, tal como ya habíamos razonado. b) En este caso, el NaOH, como es una base fuerte estará totalmente disociada y el ion sodio es un simple espectador. Por lo demás el razonamiento es el mismo que antes, y el equilibrio estará también desplazado hacia la derecha. CH3COOH(aq) + Na+(ac) + OH−(ac) ⇄ CH3COO− + Na+ + H2O c oα ácido1 Ka = [A ][H O ] = − + 3 [HA] ácido2 (c o α ) 2 c o (1 − α) Ejemplo E3A.S2008 Ejemplo Se preparan 10 L de disolución de un ácido monoprótico HA, de masa molar 74, disolviendo en agua 37 g de éste. La concentración de H3O+ es 0’01 M. Calcule: a) El grado de disociación del ácido en disolución. b) El valor de la constante Ka. Razonar hacia donde estarán desplazados lo siguientes equilibrios: a) CH3COOH(ac) + NH3(ac) ⇄ CH3COO−(ac) + NH4+(ac) b) CH3COOH(ac) + NaOH(ac) ⇄ CH3COO−(ac) + Na+(ac) + H2O DATOS: Ka(CH3COOH) = 1,8.10−5; Ka(NH4+) = 5,6.10−10 HA + H2O ⇄ Concentrac. inic Concentrac. eq. a) El equilibrio estará desplazado hacia donde se forme el ácido más débil. CH3COOH(ac) + NH3(ac) De la estequimetría de la reacción se deduce que la concentración de protones en el equilibrio es coα y como nos dicen que es 0,01M, podemos deducir muy fácilmente el valor del grado de disociación porque conocemos la concentración inicial: Por otro lado, conociendo las Ka de los dos ácidos es fácil calcular la constante de equilibrio de esa reacción, ya que si te das cuenta las constantes hacen referencia a las ecuaciones siguientes (suprimiremos el H2O por comodidad, así que escribiremos las ecuaciones tal como lo haría Arrhenius): 0,05.α = 0,01 b) [CH COO ][H ] Ka = − NH4+ ⇄ NH3 + H+ coα = 0,01M a) Concentración inicial de ácido: si se han disuelto 37 gr de HA hasta tener un volumen de 10 L de disolución, está será de 3,7 g/L y como su masa molecular es 74 g/mol, tenemos que la concentración Molar inicial de ácido es co = 3,7/74 = 0,05M ácido2 Como la Ka del ácido acético es mucho mayor que la del NH4+, significa que es más ácido, es decir que el CH3COOH tiene mayor tendencia a ceder protones que el NH4+, por tanto el equilibrio estará desplazado hacia la derecha. ⇄ CH3COO− + H+ coα ⇄ CH3COO−(ac) + NH4+(ac) ácido1 CH3COOH co = 0,05M co – coα A− + H3O+ + Ka = 3 [CH 3 COOH ] K´a = → [A ][H O ] = − + 3 [HA] α = 0,2 es decir 20% disociado (c o α ) 2 0,05 ⋅ 0,2 2 = = 2,5 ⋅ 10 −3 c o (1 − α ) 1 − 0,2 [NH 3 ][H + ] [NH ] + 4 La constante de equilibrio de la reacción en cuestión es 191 192 PRODUCTO IÓNICO DEL AGUA Relación entre Ka y Kb de su base conjugada El agua pura prácticamente no conduce la corriente (tiene una conductividad muy pequeña) lo que indica que está muy poco disociada. La reacción llamada de autonionización (Arrhenius) o autoprotólissis (Brönsted−Lowry) del agua es: Las reacciones de ionización del ácido y de su base conjugada son: H2O + H2O ⇄ − + HO + H3O ácido1 base1 ácido2 base2 HA + H2O ⇄ A− + H2O [H 2 O]2 Teniendo en cuenta que la concentración de agua (1000/18/1L=55,55M) prácticamente no varía y por tanto puede incluirse en la constante de equilibrio, tenemos que la constante, llamada producto iónico del agua es: [ ][ ] Kw = K [H 2 O] = H 3 O + OH − = 10 −14 ⇄ HA + OH− [A ] − ][ ] que como Ka ⋅ Kb = Kw CONCEPTO DE pH y pOH [ ] También hemos visto que si la concentración de protones es mayor de 10−7 las disoluciones son ácidas y si son mas pequeñas las disoluciones son básicas. • Si el agua es pura (como al disociarse por cada protón se forma un ion hidroxilo), resulta que la concentración de ambos iones será la misma y por tanto el agua pura es neutra. [H O ] = [OH ] = 10 + − −7 + Si disolvemos un ácido, al liberar protones, la concentración de H3O aumentará y necesariamente la de HO− debe disminuir para que se mantenga constante Kw H 3 O + OH − = 10 −14 . Quiere decir que las concentraciones de H3O+ mayores de 10−7 corresponden a disoluciones ácidas. ] [H O ] > 10 + −7 3 Como toda esa gama de valores con exponentes negativos (salvo para disoluciones muy concentradas de ácidos fuertes) es complicada de manejar, a Sörensen se le ocurrió expresar la concentración de protones como su logaritmo cambiado de signo y le llamó pH. De esta forma las concentraciones se convierten en números sencillos y fáciles de manejar y de comparar. pH = − log H 3 O + [ Neutra 3 ][ [HA] HA][OH − ] [ Kb = concentración de protones e iones hidroxilo, tendrá una H 3 O + = 10 −14 = 10 −7 M • Como Kw tiene un valor muy pequeño, indica que el agua pura está muy poco disociada [ + 3 Como el producto iónico del agua es 10−14, una disolución neutra, es decir que tenga la misma Se deduce lo siguiente: • − [ − 3 2 [A ][H O ] Como ves, si multiplicamos las dos constantes el resultado es H 3 O + OH − sabes es igual al producto iónico del agua, así que: [H O ][OH ] K= + Ka = A− + H3O+ De igual forma se define el pOH como el logaritmo cambiado de signo de la concentración de iones hidroxilo: pOH = − log OH − [ + 3 −7 ] Si tenemos en cuenta el producto iónico del agua y le tomamos logaritmos veremos que para cualquier disolución se cumple que el pH + el pOH es igual a 14 Ácida [H O ][OH ] = 10 + • Al contrario, si aumenta la concentración de HO− debe disminuir la concentración de protones haciéndose menor de 10−7 y la disolución será básica. [H O ] < 10 ] − −14 3 → [ ] [ ] log H 3 O + + log OH − = −14 pH + pOH = 14 Básica [H3O+] pH [OH−] pOH 193 10 −1 10−15 15 1 0 10−14 14 10−1 1 10−15 13 10−2 2 10−12 12 10−3 3 10−11 11 10−4 4 10−10 10 10−5 5 10−9 9 10−6 6 10−8 8 10−7 7 10−7 7 10−8 8 10−6 6 10−9 9 10−5 5 10−10 10 10−4 4 10−11 11 10−3 3 10−12 12 10−2 2 10−13 13 10−1 1 10−14 14 1 0 194 10−15 15 10 −1 El mismo criterio también se aplica a las constantes de ácido o bases muy débiles, así se definen las pKa y pKb como: pKa=−logKa pKb=−logKb [ Calcule el pH de 50 mL de: a) Una disolución acuosa 0’1 M de cloruro de hidrógeno. b) Una disolución acuosa 0’1 M de hidróxido de potasio. c) Una disolución formada por la mezcla de volúmenes iguales de las dos disoluciones anteriores Se trata de un ácido y de una base fuertes, por lo que, en agua, se encuentran totalmente disociados. Por otro lado, como conocemos la concentración tanto del ácido y de la base, el volumen que disponemos de los mismos es un dato innecesario. co = 0,1M 0 Cl− + H3O+ co [ c) Cuando reaccionan el mismo volumen de un ácido fuerte monoprótico con una base monohidróxido que tienen la misma concentración, obviamente se neutralizan completamente y el resultado es agua y los iones espectadores (porque en este caso la concentración molar y normal coinciden), así que el pH será el del agua pura, que [ ] Moles. inic Moles final a =0,1V a−x Concentrac. final 0,1V - 0,05V 2V 0,025 co = 0,1M 0 [ x 2x 0 0,05V 2V 2 ⋅ 0,05V 2V 0 0,025 0,05 2co = 0,2M co Ahora el ácido en exceso se disocia ] pH = − log H 3 O + = − log 0,2 = 0,7 H2SO4 + H2O → Concentrac. inic Concentrac. final b) El hidróxido de potasio, al ser una base fuerte se disocia completamente: KOH + H2O → K+ + OH− Concentrac. inic Concentrac. final b =0,1V b−2x Hasta que se gaste uno de los dos Se gastará antes KOH, así que: 0,1V – 2x = 0 → x = 0,05V H2SO4 + H2O → SO4−2 + 2 H3O+ por tanto: + 2 KOH → SO4−2 + 2 K+ + 2 H2O H2SO4 Se haberse tratado de un ácido, también fuerte, con dos protones como por ejemplo el H2SO4, el procedimiento sería el mismo, solo que en este caso, al disociarse también completamente la concentración de protones sería doble que la del ácido: Concentrac. inic Concentrac. final ] como hemos visto anteriormente tiene H 3 O + = 10 −14 = 10 −7 M y por tanto su pH=7. co = 0,1M pH = − log H 3 O + = − log 0,1 = 1 por tanto: ] Pero supongamos que el ácido fuese H2SO4 que es fuerte y diprótico: nºmoles en un volumen V (en litros) de ácido = M.V = 0,1V moles en V litros nºmoles en un volumen V (en litros) de base = M.V = 0,1V moles en V litros a) Concentrac. inic Concentrac. fina ] * O bien calculamos el pOH y a partir del mismo el pH teniendo en cuenta que la suma de ambos es 14, lo que realmente viene a ser lo mismo puesto que esto último se deduce de lo anterior. pOH = − log OH − = − log 0,1 = 1 pH = 14 − pOH = 14 − 1 = 13 Ejemplo E5B.S2008 HCl + H2O → [ pH = − log H 3 O + = − log10 −13 = 13 por tanto: co = 0,1M 0 co co = 0,025M 0 SO4−2 + 2 H3O+ co 2co = 0,05M (A lo mismo podríamos haber llegado de cabeza: si la concentración de H2SO4 y de KOH es la misma, e igual al 0,1M, como de potasa se gasta el doble, de ácido quedará en exceso la mitad: 0,05M y como al juntarse los volúmenes iguales ahora el volumen total es doble, la concentración de H2SO4 será la mitad, igual a 0,025M y la de H3O+ doble) co = 0,1M Para calcular el pH de la base podemos hacer dos cosas: por tanto: [ ] pH = − log H 3 O + = − log 0,05 = 1,3 + * Una vez conocida [OH −] calcular la [H3O ] teniendo en cuenta el valor del producto iónico del agua: [H O ][OH ] = 10 + 3 − −14 → [H O ]0,1 = 10 + 3 −14 → [H O ] = 10 + Ejemplo: E4A.S2009 −13 3 195 196 b) Como sabemos que el grado de disociación es lo que se disocia 1 mol de ácido (lo mismo sería teniendo en cuenta que x=coα) En 500 mL de agua se disuelven 3 g de CH3COOH. Calcule: a) El pH de la disolución b) El tanto por ciento de ácido ionizado. datos: Ka(CH3COOH) = 1,8.10−5. Masas atómicas: C=12; H=1; O=16 0,1moles CH 3 COOH se han disociado1,33 ⋅ 10 −3 moles = 1mol CH 3 COOH α a) En este caso se trata de un ácido débil, por tanto (y lo mismo que ocurriría si fuese una base débil) no se disocia en su totalidad, por lo que no basta con saber su concentración inicial (co), además debemos conocer la constante de disociación (Ka) o bien el grado de disociación (α). de donde α = 1,33.10−2 y multiplicando por 100 tendremos 1,33% disociado La concentración molar inicial del ácido es fácil de calcular, ya que como se han disuelto 3g en 500 mL, su concentración es de 6 g/L y la molaridad sería: Ejemplo E1A.S2007 M= A 25 ºC, una disolución de amoniaco contiene 0’17 g de este compuesto por litro y está ionizado en un 4’24 %. Calcule: a) La constante de ionización del amoniaco a la temperatura mencionada. b) El pH de la disolución. Masas atómicas: N = 14; H = 1. g/L 6 = = 0,1M Pm 60 CH3COOH + H2O ⇄ CH3COO− + H3O+ Concentrac. inic Concentrac. eq. co = 0,1M co – x x x coα coα a) Este ejercicio es parecido al anterior. La diferencia es que se trata de una base débil en lugar de un ácido y que además de conocer su concentración inicial (co), nos dan el grado de disociación (α) en lugar de la constante de disociación (Kb) También podíamos poner que: co – coα Concentrac. eq. Ka = [CH COO ][H ] = − 3 + [CH 3 COOH] La concentración molar inicial de la base es fácil de calcular, ya que como se han disuelto 0,17 g/L y la molaridad sería: 2 x co − x 1,8 ⋅ 10 −5 = y x2 0,1 − x [ x = 1,33.10−3 = [H3O+] → NH3 + H2O ⇄ ] Concentrac. inic Concentrac. eq. pH = − log H 3 O + = − log 1,33 ⋅ 10 −3 = 2,88 • • En estos casos, como hemos hecho, se hace la aproximación de suponer que toda la concentración de protones proviene de la disociación del ácido y, por tanto, hemos despreciado la debida a la disociación del agua. A menudo, cuando la Ka o Kb son del orden de 10−5 o menores, con objeto de simplificar los cálculos, también suele hacerse la aproximación de suponer que: co − x ≈ co que es como suponer que el ácido prácticamente mantiene su concentración constante. Si hubiésemos hecho esta aproximación tendríamos que: 1,8 ⋅ 10 −5 Kb = co = 0,01M co – coα [NH ][OH ] = + 4 [NH 3 ] − NH4+ + OH− coα c oα (c o α ) 2 (0,01 ⋅ 0,0424) 2 = = 1,88 ⋅ 10 −5 c o (1 − α) 0,01(1 − 0,0424) b) De la ecuación se deduce que la concentración de iones hidroxilo es coα, así que: [OH−] = coα = 0,01.0,0424 = 4,24.10−4 moles/L y [ ] pOH = − log OH − = − log 4,24 ⋅ 10 −4 = 3,37 x2 x2 = ≈ 0,1 − x 0,1 [ g / L 0,17 = = 0,01M Pm 17 M= de donde: → . −3 + x = 1,34 10 = [H3O ] y el pH es pH = 14 – pOH = 10,63 ] pH = − log H 3 O + = − log 1,33 ⋅ 10 −3 = 2,87 que como ves es prácticamente el mismo resultado. Naturalmente la aproximación es tanto más buena cuanto menor sea la constante de equilibrio. 197 198 Ejemplo E6A.S2008 Ejemplo E1A.S2009 Se disuelven 0’17 g de amoniaco en agua, obteniéndose 100 mL de disolución de pH = 11’12. Calcule: a) El grado de disociación del amoniaco. b) El valor de la constante Kb de esta sustancia. Masas atómicas: N = 14; H = 1. El pH de 1L de disolución acuosa de hidróxido de litio es 13. Calcule: a) Los gramos de hidróxido que se han utilizado para prepararla. b) El volumen de agua que hay que añadir a 1L de la disolución anterior para que su pH sea 12. Suponga que los volúmenes son aditivos. Masas atómicas: O=16; H=1; Li=7 a) Esta es la tercera posibilidad. Que nos den la concentración inicial del ácido o base y su pH, y a partir de ahí calculemos la Kb y el grado de disociación. a) Al tratarse de una base fuerte, asumiremos que en agua se disocia completamente La concentración en gr/L inicial de la base es 1,7 g/L y dividiendo por su Pm tentremos la concentración molar que es 1,7/17 = 0,1M Del pH podemos deducir la concentración de protones y de ella (teniendo en cuenta el producto iónico del agua) la de iones OH−, que es lo que nos interesa. O bien, que es lo que vamos a hacer, calculamos el pOH y de él obtenemos directamente la concentración de iones hidroxilo: [ pOH = − log OH ] [OH ] = 10 − → NH3 + H2O ⇄ Concentrac. inic Concentrac. eq. co = 0,1M co – coα −2 ,88 co 0 [ pOH = − log OH − co co ] [OH ] = 10 − → −1 = 0,1moles / L −3 = 1,32 ⋅ 10 moles / L Bueno, ahora lo que nos preguntan es tan simple como ¿Cuántos gramos de LiOH hemos de disolver en agua hasta tener 1L de disolución de una concentración 0,1M? NH4+ + OH− coα Concentrac. inic Concentrac. final Si el pH=13 quiere decir que su pOH = 14−13 = 1, y por tanto que la concentración de iones hidroxilo, que como podemos ver, al tratarse de una base fuerte coincide con la concentración inicial de la base, es: pOH = 14 – pH = 14 – 11,12 = 2,88 − LiOH + H2O → Li+ + OH− M= c oα g/L Pm → 0,1 = g/L 24 → g/L = 2,4 gLiOH/Ldisoluc [ ] b) Si queremos que el pH sea 12, la concentración de OH − = 10 −2 = 0 ,01 moles / L , por tanto el ejercicio sería ¿Qué volumen de agua hay que añadir a 1L de disolución 0,1M de LiOH para que su concentración sea 0,01M? De la ecuación se deduce que la concentración de iones hidroxilo es coα, así que: [OH−] = coα El razonamiento es que como el agua no tiene LiOH, el número de moles en la disolución inicial y en la diluida debe ser el mismo, así que: 1,32 ⋅ 10 −3 = 0,1 ⋅ α M ⋅ V = M´⋅V´ sustituyendo: de donde α = 0,0132 o bien que la base esta disociada un 1,32 % 0,1.1 = 0,01.V´ → V´= 10 L de agua b) La constante de equilibrio: Kb = [NH ][OH ] = + 4 [NH 3 ] − (c o α ) 2 (0,1 ⋅ 0,0132) 2 = = 1,77 ⋅ 10 −5 c o (1 − α) 0,1(1 − 0,0132) 199 200 HIDRÓLISIS Ejemplo E6A.S2009 Cuando se disuelve en agua una sal de ácido débil y base fuerte, como por ejemplo carbonato sódico, presenta pH básico. Por el contrario cuando se disuelve una sal de ácido fuerte y base débil, como el cloruro amónico, presenta pH ácido y solo las bases de ácido fuerte y base fuerte presentan pH neutro. En una disolución acuosa 0,03M de amoníaco, éste se encuentra disociado en un 2,4%. Calcule: a) El valor de la constante de disociación de la base. b) ¿Qué cantidad de agua habrá que añadir a 100 mL de dicha disolución para que el pH de la disolución resultante sea 10,5?. Suponga que los volúmenes son aditivos. Si miras la tabla donde se representa la fuerza de los ácidos y de sus bases conjugadas, verás que: a) El ejercicio es parecido al anterior, pero ahora con una base débil. NH3 + H2O ⇄ co = 0,03M co – coα Concentrac. inic Concentrac. eq. Kb = [NH ][OH ] = + − 4 [NH 3 ] NH4+ + OH− • coα • c oα • (c o α) 2 (0,03 ⋅ 0,024) 2 = = 1,77 ⋅ 10 −5 c o (1 − α) 0,03(1 − 0,024) Todos los ácidos que están por encima del agua son mas fuertes que ella y por tanto pueden ceder un protón al agua que frente a ellos actúa como base. Todos los aniones que están por debajo del agua son bases más fuertes que ella, así que el agua se comporta como ácido frente a ellos y puede cederles un protón. Recuerda también que un ácido fuerte tiene una base conjugada débil y viceversa. Así, por ejemplo, el Cl– es una base débil porque proviene del HCl, o también que el NH4+ es un ácido fuerte porque proviene del NH3. b) Lo primero tenemos que calcular la concentración que debe tener la base para que el pH se el que queremos, 10,5 y por tanto que su pOH = 14 – 10,5 = 3,5 [ pOH = − log OH − ] [OH ] = 10 − → −3, 5 = 3,16 ⋅ 10 −4 moles / L pero como la base no es fuerte la concentración de OH− no coincide con la de la base, tal como puede verse en la reacción NH3 + H2O co co – x Concentrac. inic Concentrac. eq. Kb = [NH ][OH ] = + − 4 [NH 3 ] ⇄ NH4+ + OH− x x = 3,16.10–4M x2 (3,16 ⋅ 10 −4 ) 2 = = 1,77 ⋅ 10 −5 c o − x c 0 − 3,16 ⋅ 10 − 4 de donde co = 0,006 M Ahora el ejercicio sería ¿Qué volumen de agua hay que añadir a 100 mL de disolución 0,03M de NH3 para que su concentración sea 0,006M? El razonamiento es que como el agua no tiene NH3 el número de moles en la disolución inicial y en la diluida debe ser el mismo, así que: M ⋅ V = M´⋅V´ . . 0,03 0,1 = 0,006 V´ → a) Sal de ácido fuerte y base fuerte: Cuando la sal se disuelve el resultado primero son sus iones: NaCl → Na+ + Cl− El Na+ no reacciona con el agua porque es muy estable y un ácido mucho más débil que el agua. Tampoco reacciona el Cl− porque es una base más débil que el agua, por tanto el resultado es simplemente eso, los iones Na+ y Cl− y la disolución es neutra y no hay hidrólisis. V´= 0,5 L = 500 mL de agua Así que hay que añadir 400 mL de agua. 201 202 b) Sal de ácido débil y base fuerte: Cuando la sal se disuelve el resultado primero son sus iones: Na2CO3 → 2 Na+ + CO32− c) Sal de ácido fuerte y base débil: Cuando la sal se disuelve el resultado primero son sus iones: NH4Cl → NH4+ + Cl− pero ahora, como el carbonato es una base más fuerte que el agua (porque proviene del H2CO3 o HCO3– que son ácidos débiles), el agua se comporta como un ácido cediéndole un protón y teniendo lugar una reacción ácido−base de Brönsted−Lowry, que se llama de hidrólisis: pero ahora, como el ion amonio es un ácido más fuerte que el agua (porque proviene de NH3 que es base débil) le cede un protón al agua, que se comporta como base, teniendo lugar una reacción ácido−base de Brönsted−Lowry, que se llama de hidrólisis: (base fuerte) CO32− (base fuerte) (ácido fuerte) + H2O ⇄ HCO3− + OH− NH4+ + (ácido fuerte) el resultado final es que aumenta la concentración de OH– y por eso la disolución es básica, ya que el Na+ con el agua no reacciona. el resultado final es que aumenta la concentración de protones y por eso la disolución es ácida, ya que el Cl− con el agua no reacciona. Aplicando la LAM a la reacción de hidrólisis tendremos lo que se conoce como constante de hidrólisis: − HCO 3 OH − Kh = = Kb CO − 2 −2 3 CO 3 [ ][ [ ] H2O ⇄ NH3 + H3O+ ] Igual que antes, si aplicamos la LAM a reacción de hidrólisis, veremos que es igual a la constante del ácido Kh = [NH 3 ][H 3 O + ] = Ka [NH ] + Podemos escribirla de forma general para la reacción: y como antes: [NH ][OH ] ⋅ [NH ][H O ] = Kw [NH ] [NH ] + Kb ⋅ Kh = A− + H2O ⇄ HA + OH− Kh = [HA ][OH − [A ] − ] = Kb A− [A ][H O ] ⋅ [HA][OH ] = Kw [HA] [A ] − + − 3 4 3 + 3 Fíjate que la constante de hidrólisis es igual a la constante de la base conjugada. Por eso no se tabulan porque pueden obtenerse a partir de las constantes del ácido y de la Kw del agua, ya que si te das cuenta, al multiplicar la Kh por Ka se obtiene la Kw Ka ⋅ Kh = NH 4 + 4 + 4 d) Sal de ácido débil y base débil: Cuando la sal se disuelve el resultado primero son sus iones: CH3COONH4 → NH4+ + CH3COO− En este caso se hidrolizará tanto el catión como el anión y la disolución será ácida o básica dependiendo del valor de las Kh de cada uno. − 3 − NH4+ + H2O ⇄ NH3 + H3O+ Si te das cuenta, como Kw=Ka*Kh al ser el valor de Kw muy pequeño (10−14) las constantes de hidrólisis son también muy pequeñas, a menos claro que se trate de ácidos muy débiles, que lógicamente tienen Ka muy pequeñas. Así que cuanto más débil sea el ácido más se hidroliza. Lo mismo ocurriría cuando se disuelve en agua acetato sódico o cianuro sódico, para los que las reaccionas de hidrólisis de los aniones serían: Kh = [NH ] + = 5,6 ⋅ 10 −10 CH3COO− + H2O ⇄ CH3COOH + OH− [CH 3 COOH][OH − ] = Kb [CH COO ] − 3 CN− + H2O ⇄ HCN + OH− NH 4 + 4 Kh = CH3COO− + H2O ⇄ CH3COOH + OH− [NH 3 ][H 3 O + ] = Ka A− = Kw 10 −14 = = 5,6 ⋅ 10 −10 Ka 1,8 ⋅ 10 −5 En este caso, al ser igual las dos constantes de hidrólisis la disolución del acetato amónico tendrá pH neutro. 203 204 Como ya hemos dicho, la sal se disuelve completamente, quiere decir que la concentración inicial de iones será igual a la inicial de sal. Ejemplo E2B.S2009 En medio acuoso, según la teoría de Brönsted−Lowry: a) Justifique el carácter básico del amoníaco b) Explique si el CH3COONa genera pH básico. c) Razone si la especie HNO2 puede dar lugar a una disolución de pH>7 CH3COONa → CH3COO − + Na+ co = 0,1M 0 0 0 co co inicial al disolverse ahora se hidroliza el ion acetato, que inicialmente estaba en una concentración co a) Según la teoría de Brønsted y Lowryel NH3 es una base porque puede aceptar un protón del agua dando lugar a ion amonio y un ion hidroxilo: NH3 + H2O ⇄ NH4+ + OH− base1 ácido2 ácido1 CH3COO− + H2O ⇄ CH3COOH + OH− co = 0,1M co – x x x Concentrac. inic Concentrac. eq. base2 la constante de equilibrio de la reacción, es decir la constante de hidrólisis es: b) El acetato sódico efectivamente al disolverse e hidrolizarse en agua da lugar a un pH básico por tratarse de una sal de ácido débil y base fuerte: Kh = [CH 3 COOH ][OH − ] = [CH COO ] − 3 En una primera fase se solvatan los iones, puesto que se trata de una sal soluble: CH3COONa → CH3COO − El valor de la Kh se calcula recordando que Ka.Kh = Kw. Así que sustituyendo: + + Na Kh = En una segunda fase el ion acetato se hidroliza, es decir, reacciona con el agua comportándose como una base, dando lugar a su ácido conjugado y a los iones OH− responsables del pH básico: Kw 10 −14 = = 5,56 ⋅ 10 −10 Ka 1,8 ⋅ 10 −5 y ahora sustituyendo: Kh = CH3COO− + H2O ⇄ CH3COOH + OH− base1 ácido2 x2 co − x ácido1 [ x2 = 5,56 ⋅ 10 −10 0,1 − x ] de donde x = OH − = 7,45 ⋅ 10 −6 moles / L base2 [ c) El ácido nitroso, siempre dará lugar a un pH ácido, por tanto menor que 7, ya que con el agua reacciona comportándose como ácido y cediendo un protón: ] pOH = − log OH − = 5,13 → pH = 14 – pOH = 8,87 que como podemos ver corresponde a un pH básico. HNO2 + H2O ⇄ NO2− + H3O+ ácido1 base2 base 1 ácido2 Al aumentar la concentración de protones dará lugar a pH ácido DISOLUCIONES REGULADORAS, AMORTIGUADORAS O TAMPONES Son disoluciones que tienen la propiedad de mantener el pH casi constante aunque se le añadan pequeñas cantidades de ácidos o bases. Están formadas por una concentración alta de: Ejemplo ampliación: • Un ácido débil y su base conjugada que se aporta por una sal, por ejemplo una mezcla de ácido acético y acetato sódico • Una base débil y su ácido conjugado que se aporta por una sal, por ejemplo una mezcla de amoníaco y cloruro amónico. Calcular el pH de una disolución 0,1M de CH3COONa sabiendo que la constante de disociación del ácido acético es 1,8.10−5. Con este ejemplo vamos a ver como efectivamente da sal da lugar a un pH básico y vamos a calcular su valor. Realmente el ejercicio es prácticamente como que ya hemos resuelto de ácido – base débiles. 205 206 Este tipo de disoluciones juegan un papel muy importante en los seres vivos, ya que ayudan a mantener el pH constante. Por ejemplo del pH de la sangre es 7,4 y una variación de 0,6 podría matarnos. conc. final 0 el resultado de sumar las dos reacciones que se han explicado por separado sería (omitiendo el sodio porque no tienen ningún efecto) que: Como el acetato se disocia completamente y “aporta un ión común” hará que el equilibrio de disociación del ácido esté muy desplazado hacia la izquierda (de acuerdo con el principio de Le Chatelier). (Dicho de otra forma, un electrolito débil (ác.acético) se disocia menos si está en presencia de un electrolito fuerte (acetato sódico) que aporte un ion común.) La situación es que: Prácticamente la concentración de CH3COO − es la que tenía la sal de acetato sódico porque se ha disociado completamente, mientras que la concentración de CH3COOH es prácticamente la que tenía el ácido, ya que al estar el equilibrio muy desplazado hacia la izquierda casi no está disociado. Si aplicamos la LAM a la mezcla reguladora, tendremos que aproximadamente podemos escribirla como: [CH COO ][H O ] ≈ [SalInicial][H O ] = Ka − 3 + 3 [CH 3 COOH] + 3 [AcidoInicial] Como las concentraciones de sal inicial y de ácido inicial son prácticamente constantes la H 3 O + debe mantenerse prácticamente constante. [ CH3COOH + H2O ← CH3COO − + H3O+ ≈ cácido muyPequeña muyPequeña conc. final CH3COOH + H2O ⇄ CH3COO − + H3O+ Ka = csal por su parte el ácido, “al encontrarse” ya con una concentración tan grande de iones acetato se disociará muy poco, de manera que casi mantendrá su concentración inicial. El funcionamiento de una disolución reguladora es fácil de entender. Si escribimos la reacción de disociación del acetato sódico y del ácido acético: CH3COONa → CH3COO − + Na+ csal=0,1M ] CH3COOH + H2O ⇄ CH3COO − + H3O+ ≈ cácido=0,1M csal=0,1M muyPequeña conc. final Ka = de donde: [CH COO ][H O ] ≈ [SalInicial][H O ] = 0,1 ⋅[H O ] = 1,8 ⋅10 − 3 + + 3 [CH 3 COOH] + 3 [AcidoInicial] [H O ] = 1,8 ⋅10 3 + 3 −5 → moles / L −5 0,1 pH = 4,74 Fíjate como el pH de 4,74 es bastante menos ácido que 2,87 que es lo que obtendría si solo se tratara de ácido acético (puedes calcular como ejercicio el pH que tendría la disolución si solamente se tratada de ácido acético 0,1M) siendo esta variación debida al efecto del ión común como ya hemos explicado. b) Ahora vamos a agregarle 1 ml de HCl 0,1M. Naturalmente al tratarse de un ácido fuerte se disociará completamente, de manera que la concentración de protones “en ese mL” será también 0,1M, pero al añadirlos a 100 mL de la disolución tampón la nueva concentración será [H3O+]=9,9.10−4 moles/L ( recuerda: MV = M´V´) Si ahora agregamos una pequeña cantidad de un ácido cualquiera, obviamente liberará protones y de acuerdo con el principio de Le Chatelier nuestro equilibrio se desplazará hacia la izquierda disminuyendo con ello la [H3O+] y en consecuencia haciendo que el pH no varíe significativamente. Dicho de otra forma, los protones que aporta el ácido los amortigua el equilibrio de la reacción. Al añadir el ácido el equilibrio se ha desplazado hacia la izquierda. La aproximación que haremos es considerar que inicialmente todos los protones de la mezcla son los que ha proporcionado el clorhídrico, que como ácido fuerte se ha disociado completamente, así que de acuerdo con esta suposición: Si por el contrario añadimos una base cualquiera, obviamente liberará iones hidroxilo que reaccionarán con los H3O+ desplazando el equilibrio hacia la derecha, con el mismo resultado que antes, es decir que los OH− que aporta la base los amortigua el equilibrio de la reacción. conc. eq. inicial le agregamos el HCL conc.Nuevo eq (final) Ejemplo ampliación: CH3COOH + H2O ⇄ CH3COO − + H3O+ csal=0,1M muyPequeña ≈ cácido=0,1M 0,1+ x Ka = a) Calcula el pH de una disolución de 100 mL que es 0,1M en ácido acético y 0,1M en acetato sódico. b) Calcula el pH si a esa disolución se le agrega 1 mL de HCl 0,1M x = 9,7.10−4 → 0,1− x [H3O+]=9,9.10−4 moles/L 9,9.10−4 − x ( 0,1 − x ) ⋅ (9,9 ⋅ 10 −4 − x ) = 1,8 ⋅ 10 −5 0,1 + x [H O ] = 2 ⋅10 + 3 −5 moles / L → pH = 4,70 Como ves da lugar a una variación de solo unas centésimas en el valor del pH. a) Como el acetato se disocia completamente: CH3COONa → CH3COO − + Na+ Para que tengas un punto de comparación, fíjate que si a 100 mL de una disolución de 207 208 INDICADORES HCl que tuviera un pH de 4,74 (como tenía nuestra tampón) le agregásemos 1 mL de NaOH 0,1M (que s lo equivalente a lo que hemos hecho) daría lugar a un nuevo pH de 11, es decir lo alteraría en mucho más de 6 puntos. Veamos como es: [H O ] = 10 + → pH = 4,74 −4 , 74 3 Los indicadores son ácidos o bases débiles que tienen la propiedad de tener un color para su forma ácida distinto del que tienen para su base conjugada. Por ejemplo el tornasol que representaremos, de forma genérica, como HIn es de color rojo, mientras que su base conjugada In− es azul. En disolución acuosa se establecerá un equilibrio: = 1,8 ⋅ 10 −5 moles / L como todos esos protones lo aporta el HCl, será también la concentración inicial del ácido. Ahora le agregamos 1 mL de NaOH y naturalmente se producirá una reacción hasta gastar uno de los dos reactivos. HIn + H2O ⇄ In− + H3O+ Rojo Azul Medio ácido Medio básico Pero antes veamos el número de moles de HCl y de NaOH que inicialmente hay antes de la mezcla: 100 nº moles HCL = 1,8 ⋅ 10 -5 = 1,8 ⋅ 10 −6 moles HCl 1000 nº moles NaOH = 0,1 Cuando se añade un ácido, al liberar protones el equilibrio se desplaza hacia la izquierda mostrando su color rojo de la especie HIn, mientras que si se agrega una base, ésta consume propones y el equilibrio se desplaza hacia la derecha mostrando entones el color azul de la especie In−. 1 = 10 − 4 moles NaOH 1000 Los indicadores, por lo tanto, nos permiten conocer los cambios de pH, aunque con las siguientes limitaciones: • Solo de forma aproximada, ya que el viraje exige unas determinadas concentraciones de ácido o base para que se pueda detectar el cambio de color, por eso el margen de error es de unos 2 puntos. • Cada indicador vira a un pH diferente que depende de su estructura. la reacción entre el clorhídrico y la sosa será: NaOH + HCl → Na+ + Cl− + H2O 10−4 Moles. inic 1,8.10−6 Hasta que se gaste uno de los dos Se gastará antes el HCl, que hay menos Moles final 10−4−1,8.10−6 Concentrac. final 9,82 ⋅ 10 -5 = 9,72 ⋅ 10 − 4 moles / L 0,101 0 En la siguiente tabla se muestran los márgenes de viraje de los indicadores que hay en el laboratorio: 1,8.10−6 1,8.10−6 (Ten en cuenta que V=100+1 cm3) Azul de Timol Azul de bromofenol Naranja de metilo Rojo de metilo Azol de bromotimol Tornasol Fenoftaleína Azul de Timol (2ª etapa) Ahora el NaOH en exceso se disocia Concentrac. inic Concentrac. final por tanto: → Na+ + OH− NaOH co = 9,72 ⋅ 10 −4 M 0 co [ ] co = 9,72 ⋅ 10 −4 M pOH = − log OH − = − log 9,72 ⋅ 10 −4 = 3 Color ácido rojo amarillo rojo rojo amarillo rojo incoloro amarillo Color básico amarillo azul amarillo amarillo azul azul rojo púrpura pH 1’2 − 2’8 3’0 − 4’6 3’1 − 4’4 4’2 − 6’3 6’0 − 7’6 6’1 − 7’2 8’0 – 9’5 8’0 − 9’6 y pH = 14−3 = 11 209 210 VALORACIONES ACIDO – BASE Cuando un ácido fuerte se neutraliza con una base fuerte, el pH experimenta una brusca variación justamente en el punto de equivalencia, que en este caso sería el de pH=7. Supongamos que vamos a valorar una disolución 0,1M de HCl y para ello utilizamos una disolución de NaOH 0,1M • • • • • En el punto de equivalencia de la neutralización del HCl por el NaOH debe cumplirse que el número de moles de ácido sea igual al número de moles de base. En general mejor describir el punto de equivalencia igualando el número de equivalentes de ambas especies y de esa forma podemos desentendernos del número de hidrógenos del ácido o de OH que tiene la base: nºeqácido = nºeqbase Nácido.Vácido = Nbase.Vbase + Al principio en el erlenmeyer tenemos una [H3O ] 0,1 M, y el pH=1. Si se añade NaOH, los OH− consumen los H3O+ para formar agua. Cuando se han neutralizado 9/10 partes del ácido, [H+]=0,01 M y pH=2. Si se han neutralizado 999/1000 partes del ácido, [H+]=10−4 M y el pH=4. Basta entonces añadir 2/1000 partes de NaOH para neutralizar todo el ácido y originar un exceso de un 1/1000 de iones OH−, que estarán a una concentración 10−4 M, y un pH=10 moles de NaOH moles de HCl añadidos desde la bureta restantes moles de NaOH presentes pH 0 0,1 0 1 0,09 0,01 0 2 0,0999 0,0001 0 4 0,1000 0 0 7 0,1001 0 0,0001 10 Los ácidos polipróticos presentan tantos puntos de equivalencia como protones capaces de disociarse. Naturalmente, la valoración completa necesitará que por cada mol de ácido se añadan tantos moles de OH− como protones haya que neutralizar. Por ejemplo, en el caso del ácido fosfórico, que es triprótico, la valoración precisa de la adición de 3 moles de OH− por cada mol de ácido y tendrá tres equilibrios de disociación, cada uno con su pKa característico. Cuando un ácido fuerte como el HCl se neutraliza con una base débil (NH3), el pH se mantiene muy bajo mientras aún exista ácido libre y después de alcanzar la neutralidad, el ligero exceso de NH3 eleva paulatinamente el pH, sin provocar cambios bruscos hasta llegar al punto de equivalencia, que se alcanza a un pH ácido <7. Si tenemos un ácido débil, por ejemplo ácido acético, al añadir una base fuerte (NaOH) el pH se va aproximando a la neutralidad sin cambios bruscos, pero una vez neutralizado el ácido basta añadir unas gotas de sosa en exceso para obtener un incremento brusco en el pH como si sólo hubiera base libre. En este caso, en el punto de equivalencia se alcanza a un pH básico. Esto quiere decir que las 2/1000 partes de la base que han sido añadidas en las dos últimas adiciones han provocado un brusco cambio en el pH de 6 unidades, mientras que anteriormente la neutralización del 99% de los moles del ácido había hecho variar muy poco el pH. Ejemplo E4B.S2009 Se dispone de un recipiente que contiene una disolución acuosa de HCl 0,1M: a) Cual es el volumen de esa disolución necesario para neutralizar 20 mL de una disolución 0,02M de hidróxido de potasio? b) Describa el procedimiento e indique el material necesario para llevar a cabo la valoración anterior. a) Al tratarse de una neutralización entre un ácido y base fuertes, el punto de equivalencia se obtiene para pH=7 cuando el numero de equivalentes de ácido HCl agregado sea igual al número de equivalentes de KOH. (En este caso al tratarse de ácido monoprótico y base monohidróxido daría igual tratarlo como moles, ya que la molaridad y la normalidad coinciden) nºeqácido = nºeqbase Nácido.Vácido = Nbase.Vbase Se llama punto de equivalencia o punto de neutralización al momento en que el número de equivalentes de base añadidos iguala al número de equivalentes de ácido. En este momento el pH=7. (Se llama punto final al momento en que vira el indicador y damos por finalizada la valoración. Debemos procurar que sea lo más parecido al punto de equivalencia.) 0,1 . Vácido =0,02 . 20 de donde Vácido = 4 mL de HCl b) Material necesario 211 212 • Bureta de 25 ml • Ahora solo queda ir dejando gotear lentamente el ácido y agitar a la vez hasta que el indicador vire al color transparente, en cuyo caso en la bureta hacemos la lectura del ácido gastado para la neutralización: en este caso deben ser 4 mL. • Si se quiere un procedimiento más exacto puede repetirse el proceso y luego hacerlo utilizando otros indicadores como el tornasol y tomar la media de los volúmenes de HCl medidos. • Soporte de barra con pinzas de bureta y nuez • Pipeta • Erlenmeyer de 250 cc • Papel de filtro. • Disolución de HCl de concentración 0,1M • 20 mL de disolución de KOH de concentración 0,02M • Disolución de fenolftaleína u otro indicador. Procedimiento: • Con la ayuda de la pipeta tomamos 20 mL de KOH 0,02M y los ponemos en un erlenmeyer. • Le añadimos unas gotas de fenolftaleína, que hará de indicador, poniéndose de color rosa al contacto con la KOH. • Al tratarse de una neutralización entre ácido fuerte y base fuerte, el punto de equivalencia será a pH 7, y aunque la fenolftaleína vira a pH entre 8 y 9, el error que cometemos no es muy significativo, porque, como puedes ver en la gráfica, en el punto de equivalencia se produce un salto muy grande de pH para un exceso insignificante de ácido. A cambio la fenolftaleína vira del rosa (en medio básico) a incolora (en medio ácido), lo que supone un cambio de color muy fácil de detectar. • Para ver mejor el cambio de color que se produce en el punto de equivalencia colocaremos el erlenmeyer sobre el fondo blanco del papel de filtro. • En la bureta se coloca el ácido clorhídrico 0,1M y se enrasa a cero. Una vez enrasada se monta sobre el soporte, atornillándola mediante la pinza. 213 214 TEMA 7: INTRODUCCIÓN A LA ELECTROQUÍMICA REACCIONES DE OXIDACIÓN − REDUCCIÓN Inicialmente se llamaban reacciones de oxidación a aquellas en las que una sustancia se combinaba con oxígeno, por ejemplo: REACCIONES DE OXIDACIÓN - REDUCCIÓN Ca + ½ O2 → CaO No obstante hay reacciones similares, que por semejanza también podemos considerar de oxidación, como por ejemplo: Reacciones de oxidación – reducción Número de oxidación Ajuste de reacciones redox Ca + Cl2 → CaCl2 Lo que tienen en común es que en ambas reacciones el calcio cede electrones al oxígeno y al cloro. Al que pierde electrones se le llama reductor y al que los acepta se le llama oxidante, y por tanto forman un par conjugado redox similar al ácido–base: método del número de oxidación método del ion-electrón 2e− Ca + ½ O2 → Ca2+ + O2− Concepto de equivalente de un oxidante o un reductor reductor1 oxidante2 oxidante1 reductor2 ELECTROQUÍMICA 2e− Ca + Cl2 → Ca2+ + 2 Cl− reductor1 oxidante2 oxidante1 reductor2 Pilas galvánicas Potenciales normales de reducción Conclusiones que derivan de la tabla de potenciales normales de reducción: El calcio, que es el reductor, pierde electrones y se oxida Ca2+ (oxidante). Es decir, el reductor es quien se oxida y a la semireacción que tiene lugar se le llama reacción de oxidación. Ca − 2e− → Ca2+ Oxidación Pérdida de e− 1. Ordenan las semireacciones de más reductor a menos. 2. Permiten conocer el potencial de una pila 3. Predecir la espontaneidad de una reacción Por el contrario, el oxidante( O2 o Cl2) es el que se reduce (O2− o Cl−), y la semireacción de reducción es: Reducción Cl2 + 2e− → 2 Cl− 4. Alteración de los estados de valencia Es evidente que no puede existir un proceso de oxidación o de reducción aislados, ya que siempre el reductor cede electrones al oxidante, oxidándose el primero y reduciendo al segundo. Electrolisis Leyes de Faraday Lo mismo que pasaba con los pares conjugados ácido−base ocurre con los pares conjugados oxidante−reductor, así, si un reductor es fuerte porque tiene mucha tendencia a perder electrones (como ocurre a los metales alcalinos), su oxidante conjugado será un oxidante débil. Y análogamente, los halógenos que tienen poca tendencia a ceder electrones son reductores muy débiles o lo que es igual son oxidantes muy fuertes y sus iones lo contrario. En las reacciones de ácido con un metal, el metal se comporta como reductor cediendo electrones al protón que actúa de oxidante, así: 2e− Ca + 2 H+ → Ca2+ + H2 reductor1 oxidante2 oxidante1 reductor2 215 216 cero, mientras que el azufre ha pasado de +6 a +4: Podemos escribir las ecuaciones por separado como: NÚMERO DE OXIDACIÓN Algunas veces es complicado darse cuenta de la transferencia de electrones, sobre todo cuando se forman compuestos covalentes, por ejemplo en la reacción: C + 2 Cl2 → CCl4 Como sabemos, el tetracloruro de carbono tiene una estructura tetraédrica, en la que el carbono forma 4 enlaces covalentes con los 4 cloros. Sin embargo, como el cloro es más electronegativo que el carbono, el par de electrones del enlace estará más desplazado hacia el cloro, por tanto podemos suponer que es el cloro el que, en buena parte, ha aceptado los electrones, o dicho de otra forma ha actuado de oxidante. Para facilitar estos y otros casos se introdujo el concepto de número de oxidación de un elemento en un compuesto como la carga que tendría el elemento si compuesto del que forma parte estuviese formado por iones. Para asignarlo se siguen unas reglas: 1. El número de oxidación de cualquier elemento en estado natural (atómico o molecular) es cero. 2. El número de oxidación del oxígeno es siempre −2, excepto en los peróxidos que es −1 y cuando se combina con flúor que es +2 (porque el flúor siempre es −1). 3. El número de oxidación del hidrógeno es siempre +1, excepto cuando se combina con los metales más electropositivos (alcalinos y alcalinotérreos) que es −1 4. Los metales alcalinos siempre tienen +1, el de los metales alcalinotérreos siempre tienen +2 y en los iones formados por un solo átomo coincide con su carga. 5. La suma de todos los números de oxidación de un compuesto es cero (o igual a la carga del ion si se tratase de un ion) El número de oxidación de un elemento es un artificio teórico que no tiene nada que ver con el concepto de valencia, que como sabes es el número de enlaces que forma el elemento, aunque en muchísimos casos coincidan. Además, en algunos casos el número de oxidación puede ser fraccionario, por ejemplo en la glicerina o propanotriol, que tiene fórmula empírica C3H8O3 el número de oxidación del carbono sería −2/3. 0 +4 −2*2 S+6 + 2e− → S+4 Reacción de reducción El bromuro ha actuado de reductor que se ha oxidado a bromo elemental. El azufre del ác. sulfúrico ha actuado de oxidante y se ha reducido a SO2 Ejemplo E5B.S2010 a) Justifique si los siguientes procesos son redox: HCO3− + H+ → CO2 + H2O I2 + HNO3 → HIO3 + NO + H2O b) Escriba las semiecuaciones de oxidación y de reducción en el que corresponda. a) Para que una ecuación sea redox es necesario que en ella haya, al menos, un elemento que pierda electrones (reductor) y otro que los gane (oxidante), por tanto no hay más que calcular el número de oxidación de cada uno de los elementos que intervienen en cada reacción. Los números de oxidación son: +1 +4 −2 +1 +4−2 +1 −2 H C O3− + H+ → CO2 + H2O 0 +1+5 −2 +1+5−2 +2−2 +1 −2 I2 + HNO3 → HIO3 + NO + H2O Como vemos, la primera reacción no es redox porque todos los elementos conservan su número de oxidación. La segunda sí que es redox b) El yodo pasa de 0 a +5 y el nitrógeno pasa de +5 a +2, las semireacciones son: +5 N a) Teniendo en cuenta las reglas anteriores los números de oxidación serían bastante evidente. Quizá necesite algo de atención el azufre. Si tienes en cuenta que hay 2 hidrógenos a +1 y 4 oxígenos a −2, eso da −6 y como la molécula de ácido sulfúrico debe sumar cero, el azufre debe ser +6. En el dióxido de azufre es más sencillo, porque como hay 2 oxígenos a −2, eso hace −4 y para que la molécula sume cero, al azufre debe ser +4. +1*2 +6 −2*4 Reacción de oxidación ½ I2 − 5e− → I+5 Ejemplo: a) Dada la reacción 2 HBr + H2SO4 → Br2 + SO2 + 2 H2O obtener el número de oxidación de cada uno de los elementos que aparecen. b) Qué elemento se oxida y cual se reduce. +1 −1 2 Br− − 2e− → Br2 − +2 + 3e → N Reacción de oxidación Reacción de reducción El yodo ha actuado de reductor que se ha oxidado a I+5 El nitrógeno del ác. nítrico ha actuado de oxidante y se ha reducido a óxido nítrico. +1*2 −2 2 H Br + H2 S O4 → Br2 + S O2 + 2 H2 O b) Como puedes ver, el bromo en el bromuro de hidrógeno tienen n.o. −1 y ha pasado a 217 218 AJUSTE DE REACCIONES REDOX En toda reacción química se cumple la ley de conservación de la masa de Lavoisier, pero además en una reacción rédox debe cumplirse el principio de conservación de la carga y que el número de electrones que cede el reductor debe ser igual al que acepta el oxidante. ya sabemos los coeficientes de esas especies, pero ahora nos falta obtener el resto de los coeficientes de las especies que intervienen y tenemos de obtenerlos por tanteo. (como hay 10+2 potasios deben obtenerse 6 moléculas de K2SO4 Si se obtienen 2 sulfato de manganeso + 6 sulfatos de potasio deben provenir de 8 de sulfúrico. Por último las 8 moléculas de sulfúrico darán lugar a 8 H2O) 10 KCl + 2 KMnO4 + 8 H2SO4 → 2 MnSO4 + 6 K2SO4 + 5 Cl2 + 8 H2O Existen dos métodos para ajustar las reacciones redox: Método del número de oxidación: Es el más simple y se basa exclusivamente en que el número de electrones que cede el reductor debe ser igual al que acepta el oxidante. Método del ion−electrón: Es más racional y el más indicado, especialmente cuando las reacciones tienen lugar en medio acuoso, como ocurren casi siempre. • Se escriben las semiecuaciones de oxidación y de reducción • Se multiplican por el número necesario para igualar los electrones perdidos y ganados, y se suman, obteniéndose los coeficientes de esas especies. • El resto de coeficientes se ajustan por tanteo El problema que tiene este método es que solamente ajusta las sustancias que contienen a los elementos que se oxidan y se reducen, mientras que las restantes tendríamos que ajustarlas por tanteo. Ejemplo Ajustar la reacción Fe2O3 + C → Fe + CO2 En seguida te das cuenta de que los elementos para los que cambia el número de oxidación son el hierro y el carbono, así que, escribimos las semiecuaciones: 2*( 2 Fe+3 + 6 e− → 2 Fe0 ) 3*( C0 − 4 e− → C+4 ) −−−−−−−−−−−−−−−−−−−−−−−−− 4 Fe3+ + 3 C → 4 Fe + 3 C+4 Ejemplo: Ajustar la reacción KCl + KMnO4 + H2SO4 → MnSO4 + K2SO4 + Cl2 + H2O por tanto la reacción sería: 2 Fe2O3 + 3 C → 4 Fe + 3 CO2 Las semiecuaciones en este caso no se limitan al elemento que cambia de número de oxidación, sino que hay que escribirlas para el ion completo del que forma parte el elemento que cambia de número de oxidación, en este caso serían el Cl− y MnO4−: Ejemplo: Ajustar la reacción KCl + KMnO4 + H2SO4 → MnSO4 + K2SO4 + Cl2 + H2O Nos damos cuenta que los elementos que cambian de número de oxidación son el cloro, que pasa de −1 a 0 y el manganeso, que pasa de +7 a +2. Las semiecuaciones son: 2 Cl− − 2 e− → Cl20 +7 MnO4− + 5 e− → Mn+2 5*( 2 Cl− − 2 e− → Cl20 ) +7 • Se escriben las semiecuaciones iónicas de oxidación y de reducción del ion donde está el elemento que cambia de número de oxidación. Por ejemplo: Como el MnSO4 se ioniza en Mn2+ y SO42–, si el que cambia de número de oxidación fuera el manganeso la semireacción sería: Mn2+ …. Pero si el que cambiara de número de oxidación fuese el azufre tendríamos que tomar el ión completo, así que sería: SO42– …. En el caso de moléculas covalentes poco polarizadas se escribe la molécula completa en lugar del ión que no tendría sentido. Por ejemplo el Cl2, NO2, CO2, etc • Se anota el número de electrones ganados o perdidos en función de la variación del número de oxidación del elemento que se oxida o se reduce • Si el medio es ácido, se añaden en uno de los miembros tantos H+ como hagan falta y en el otro agua. Si el medio es básico igual, pero añadiendo OH−. • Se multiplican por el número necesario para igualar los electrones perdidos y ganados, y se suman, obteniéndose los coeficientes de esas especies. Ahora añadimos los H+ necesarios para formar agua con todos los oxígenos que hay, obviamente, como hay 4 oxígenos, pues agregaremos 8H+ y se formarán 4 H2O: +2 2*( Mn + 5 e− → Mn ) −−−−−−−−−−−−−−−−−−−−−−−−−−− 10 Cl− + 2 Mn+7 → 5 Cl2 + 2 Mn+2 2 Cl− − 2 e− → Cl2 +7 MnO4− + 5 e− + 8 H+ → Mn+2 + 4 H2O por tanto la reacción sería: 10 KCl + 2 KMnO4 + H2SO4 → 2 MnSO4 + K2SO4 + 5 Cl2 + H2O y ahora por último multiplicamos cada ecuación por el número necesario para igualar 219 220 los electrones perdidos y ganados, así que: Ejemplo E3B.S2008 Dada la reacción: 5*( 2 Cl− − 2 e− → Cl2 ) K2Cr2O7(ac) + Na2SO3(ac) + H2SO4 → Cr2(SO4)3(ac) + K2SO4(ac) + Na2SO4(ac) + H2O +7 2*( MnO4− + 5 e− + 8 H+ → Mn+2 + 4 H2O ) −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 10 Cl− + 2MnO4− + 16 H+ → 2 Mn+2 + 5 Cl2 + 8 H2O a) Ajuste por el método del ion−electrón esta reacción en sus formas iónica y molecular. b) Calcule la molaridad de una disolución de sulfito de sodio, si 15 mL de ésta reaccionan totalmente, en medio ácido, con 25’3 mL de disolución de dicromato de potasio 0’06 M. esa es la ecuación iónica ajustada. La ecuación molecular se obtiene muy fácilmente, sin tener que hacer tanteo: a) Los elementos que cambian de número de oxidación son el cromo, que pasa de tener +6 en el dicromato a +3 y el azufre que pasa de +4 en el sulfito a +6 en el sulfato: 10 KCl + 2 KMnO4 + 8 H2SO4 → 2 MnSO4 + 6 K2SO4 + 5 Cl2 + 8 H2O +6 Cr2O72− + 6 e− → 2 Cr+3 Ejemplo E3A.S2010 a) Ajuste por el método del ion−electrón la siguiente reacción: KClO3 + KI + H2O → KCl + I2 + KOH b) Calcule la masa de clorato de potasio que se necesitará para obtener 1 gramo de yodo. Masas atómicas: Cl = 35’5; K = 39; O = 16; I = 127. a) Nos damos cuenta de que los elementos que cambian de número de oxidación son el cloro y el yodo, así que escribimos las dos semiecuaciones: +4 +6 SO32− − 2 e− → SO42− ahora añadimos protones y agua donde convenga para ajustar los oxígenos: +6 Cr2O72− + 6 e− + 14 H+ → 2 Cr+3 + 7 H2O +4 +6 3*( SO32− − 2 e− + H2O → SO42− + 2 H+ ) −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− Cr2O72− + 3 SO32− + 8 H+ → 2 Cr+3 + 3 SO42− + 4 H2O 2 I− − 2 e− → I20 o bien: K2Cr2O7 + 3 Na2SO3 + 4 H2SO4 → Cr2(SO4)3 + K2SO4 + 3 Na2SO4 + 4 H2O +5 ClO3− + 6 e− → Cl− b) Una vez que conocemos la reacción ajustada, podemos decir que 1 mol de dicromato reacciona con 3 moles de sulfito, así que: en este caso, a diferencia del anterior donde añadimos H+ para formar agua, lo que debemos es añadir agua y formar OH−, así que como el clorato tiene 3 oxígenos debemos añadir 3 moléculas de H2O y obtendremos 6 OH−: K2Cr2O7 + 3 Na2SO3 + 4 H2SO4 → Cr2(SO4)3 + K2SO4 + 3 Na2SO4 + 4 H2O 1mol K2Cr2O7 −− 3moles Na2SO3 0,06 * 0,0253 moles − M´*0,015 moles 3*( 2 I− − 2 e− → I2 ) +5 ClO3− + 6 e− + 3 H2O → Cl− + 6 OH− −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− ClO3− + 6 I− + 3 H2O → Cl− + 3 I2 + 6 OH− de donde M´ = 0,3036 moles Na2SO3/L También podíamos haber respondido a esta cuestión sin necesidad de ajustar la reacción, teniendo en cuenta que las reacciones tienen lugar equivalente a equivalente, así que : N K2Cr2O7 V K2Cr2O7 = N Na2SO3 V Na2SO3 y la ecuación molecular es: KClO3 + 6 KI + 3 H2O → KCl + 3 I2 + 6 KOH la normalidad de la disolución de dicromato es N=M.ν donde en este caso ν es el número de electrones que pone en juego, que como hemos visto son 6, así que: b) Una vez ajustada la reacción, establecemos una simple estequiometría: KClO3 + 6 KI + 3 H2O → KCl + 3 I2 + 6 KOH 122,5 g KClO3 −−−−−−−−−−−−− 3.254 g I2 x g KClO3 −−−−−−−−−− 1 g I2 0,06.6 . 25,3 = N Na2SO3.15 de donde N Na2SO3=0,6072 eq/L, y como N=M.ν y para el sulfito ν es igual a 2 porque son los electrones que pone en juego, resulta que M = 0,3036 moles/L de donde x = 0,16 g KClO3 221 222 Ejemplo E5A.S2008 Dada la reacción: KMnO4 + Na2C2O4 + H2SO4 → K2SO4 + MnSO4 + Na2SO4 + H2O + CO2 a) Ajuste por el método del ion−electrón esta reacción en sus formas iónica y molecular. b) Calcule la molaridad de una disolución de KMnO4, sabiendo que 20 mL de la misma reaccionan por completo con 0’268 g de Na2C2O4 Masas atómicas: Na = 23; O = 16; C = 12. Ejemplo E6A.S2010 El gas cloro se puede obtener por reacción de ácido clorhídrico con ácido nítrico, produciéndose simultáneamente dióxido de nitrógeno y agua. a) Ajuste la ecuación iónica y molecular por el método del ion−electrón. b) Calcule el volumen de cloro obtenido, a 17 ºC y 720 mm de mercurio, cuando reaccionan 100 mL de una disolución de ácido clorhídrico 0’5 M con ácido nítrico en exceso. Dato: R = 0’082 atm·L·K−1mol−1. a) Los elementos que cambian de número de oxidación son el manganeso, que pasa de tener +7 en el permanganato a +2 y el carbono que pasa de +3 en el oxalato a +4 en el CO2 (fíjate lo que ya advertimos: que no siempre el nº de oxidación coincide con el la valencia. En el oxalato el carbono tiene +3 que no es ninguna de sus posibles valencias) a) La reacción sería: HCl + HNO3 → Cl2 + NO2 + H2O y como vemos los elementos que cambian de número de oxidación son el cloro y el nitrógeno. Las semiecuaciones son: +3 C2O42− 2 Cl− − 2 e− → Cl2 +4 − 2 e− → 2 CO2 +5 +4 NO3− + 1 e− → NO2 +7 MnO4− + 5 e− → Mn+2 ahora añadimos protones y agua donde convenga para ajustar los oxígenos: ahora añadimos protones y agua donde convenga para ajustar los oxígenos: +3 2 Cl− − 2 e− → Cl2 +4 5*( C2O42− − 2 e− → 2 CO2 ) +7 − + +5 +4 2*( NO3− + 1 e− + 2 H+ → NO2 + H2O ) −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 2 NO3− + 2 Cl− + 4 H+ → Cl2 + 2 NO2 + 2 H2O +2 2*( MnO4 + 5 e− + 8 H → Mn + 4 H2O ) −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 5 C2O42− + 2 MnO4− + 16 H+ → 2 Mn+2 + 10 CO2 + 8 H2O o bien: en este caso los protones los aportan los propios ácidos que reaccionan, que como vemos 2 el nítrico y 2 el clorhídrico, así que la ecuación molecular sería: 5 Na2C2O4 + 2 KMnO4 + 8 H2SO4 → 5 Na2SO4 + K2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O 2 HNO3 + 2 HCl → Cl2 + 2 NO2 + 2 H2O b) Una vez que conocemos la reacción ajustada, podemos decir que: a) Una vez ajustada la reacción, podemos poner, por ejemplo que: 5 Na2C2O4 + 2 KMnO4 + 8 H2SO4 → 5 Na2SO4 + K2SO4 + 2 MnSO4 + 10 CO2 + 8 H2O 2 HNO3 + 2 HCl → Cl2 + 2 NO2 + 2 H2O 2 moles HCl −−−− 1 mol Cl2 0,5 * 0,100 moles −−−− x moles Cl2 5.134 g Na2C2O4 – 2 moles KMnO4 0,268 g Na2C2O4 – M*0,020 moles KMnO4 de donde M=0,04moles/L de donde x = 0,025 moles Cl2. Y aplicando la ecuación general de los gases perfectos: PV = nRT → 720 ⋅ V = 0,025 ⋅ 0,082 ⋅ (273 + 17) 760 de donde V = 0,628 L de Cl2 medidos a 720 mmHg y 17ºC. También, de la estequiometría de la reacción, podíamos haber calculado el volumen obtenido de cloro en C.N. y después averiguar el volumen que ocuparía en las condiciones del problema. 223 224 CONCEPTO DE EQUIVALENTE DE UN OXIDANTE O UN REDUCTOR Ya definimos el PesoEquivalente−gramo es la cantidad de una sustancia que se combina o que tiene el mismo poder de combinación que 1 gr de hidrógeno. Se obtiene dividiendo la masa atómica o molecular entre la valencia (ν), entendiéndose por tal en el caso de una sustancia que se oxida o se reduce el número de electrones que gana o pierde, es decir “el número de moles de electrones que pone en juego 1 mol de sustancia”. Eso quiere decir que, a diferencia del peso equivalente de un ácido o de una base o sal, en este caso no basta con conocer la sustancia, debemos además saber cómo reacciona y en qué se transforma para de ahí poder deducir los electrones que pone en juego. Por ejemplo: Ejemplo E4B.S2010 El permanganato de potasio oxida al sulfato de hierro (II) en medio ácido sulfúrico, para dar sulfato de manganeso (II), sulfato de hierro (III), sulfato de potasio y agua. a) Ajuste la ecuación iónica y la molecular del proceso por el método del ion−electrón. b) Calcule el volumen de una disolución de permanganato de potasio 0’02 M que se requiere para oxidar 40 mL de disolución de sulfato de hierro (II) 0’1 M. a) La reacción sería: KMnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4+ H2O Como vemos los elementos que cambian de número de oxidación son el manganeso y el hierro. Las semiecuaciones son: 2 Fe2+ − 2 e− → 2 Fe3+ Sustancia FeSO4 KMnO4 HNO3 HNO3 K2Cr2O7 HCl Reaccción de 1 mol de sustancia Fe2+ − 1 e− → Fe3+ MnO4− + 5 e− → Mn+2 NO3− + 1 e− → NO2 NO3− + 3 e− → NO Cr2O72− + 6 e− → 2 Cr+3 Cl− − 1 e− → 1/2 Cl2 Peso Equivalente Peq=Pm/1 Peq=Pm/5 Peq=Pm/1 Peq=Pm/3 Peq=Pm/6 Peq=Pm/1 +7 MnO4− + 5 e− → Mn+2 ahora añadimos protones y agua donde convenga para ajustar los oxígenos: 5*( 2 Fe2+ − 2 e− → 2 Fe3+ ) +7 2*( MnO4− + 5 e− + 8 H+ → Mn+2 + 4 H2O ) −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 2MnO4− + 10 Fe2+ + 16 H+ → 2 Mn+2 + 10 Fe3+ + 8 H2O La normalidad de la disolución, que como sabemos, se define como el número de equivalentes de soluto que hay en 1 L de disolución, se obtiene: ν n º eq Peq = = Pm / ν = Pm = M⋅ν Litro Litro Litro Litro n º gramos N= o bien: n º gramos 2 KMnO4 + 10 FeSO4 + 8 H2SO4 → 2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + 8 H2O n º gramos b) Una vez que conocemos la reacción ajustada, podemos decir que 2 moles de permanganato reaccionan con 10 moles de sulfato de hierro II, así que: El concepto de equivalente es especialmente útil, porque tal como se deduce de la definición de equivalente gramo, todas las sustancias reaccionan equivalente a equivalente y por tanto nos permite estableces relaciones sin necesidad de escribir las reacciones ni ajustarlas, cosa que no puede hacerse si se trata con moles. En una valoración ácido−base o de oxidación−reducción, por ejemplo, podemos poner (como en cualquier otra reacción) que el nºeq de oxidante es igual al nº eq de reductor, o lo que es igual, que: Noxidante.Voxidante = Nreductor.Vreductor El material y el procedimiento de una volumetría redox es exactamente el mismo que en el caso de una volumetría ácido−base, con la única diferencia de que en estos casos en lugar de indicador, es el color del propio oxidante o el del reductor el que hace de indicador. Por ejemplo el permanganato potásico, que es uno de lo más utilizados hasta el punto de llamarse permanganometría al proceso, es de un color violeta intenso y se decolora al reducirse a Mn2+. El dicromato potásico que es otro oxidante que se emplea bastante es naranja y vira a verde cuando se reduce a Cr3+. 2 KMnO4 + 10 FeSO4 + 8 H2SO4 → 2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + 8 H2O 2 mol KMnO4 −−−10 moles FeSO4 0,02 * VL moles −−−− 0,1 * 0,040 moles de donde V = 40 mL de KMnO4 0,02M Como hemos dicho más arriba, este apartado también podemos responderlo sin necesidad de escribir la reacción ni de ajustarla, aplicando del concepto de peso equivalente, ya que: N KMnO4 V KMnO4 = N FeSO4 V FeSO4 la normalidad de la disolución de KMnO4 es N=M.ν=M.5 ya que el número de electrones que pone en juego, que como hemos visto son 5e−. Y para el caso del FeSO4 tenemos que N=M.1, ya que el hierro pone en juego 1e−, así que: 0,02.5*VL = 0,1.1*0,040 de donde V = 40 mL de KMnO4 0,02M 225 226 Cu, que es el polo positivo, y a medida que pasa el tiempo el electrodo de Zn se va disolviendo, mientras que el de cobre se hace mayor. PILAS GALVÁNICAS Si en una disolución de sulfato de cobre se introduce una lámina de cinc podremos ver al cabo de un rato que el azul de la disolución de sulfato de cobre se decolora y que el cinc se recubre de cobre. Lo que ha ocurrido es que: El circuito, como hemos dicho se cierra gracias al puente salino, por el que en lugar de electrones circulan iones: • los iones de Cl− (y algunos de SO42− ) van hacia el electrodo de Zn, así cuando aparece el ion Zn2+ se rodea de 2Cl− y de esa forma la disolución mantiene la carga a cero. • los iones de K+ (y algunos Zn2+) van hacia el electrodo de cobre, así cuando desaparece el Cu2+ se sustituye por 2K+ y de esta manera cierran el circuito y mantienen la neutralidad en la carga. Zn + CuSO4 → ZnSO4 + Cu o que 2e− Zn + Cu2+ → Zn2+ + Cu Hay que tener presente que, a diferencia de lo que ocurre en la electrolisis donde los iones van siempre hacia el electrodo de signo contrario, aquí ocurre justo el proceso inverso y por eso se produce la corriente en lugar de gastarse. Al chocar un ion de cobre con la lámina de cinc toma 2 electrones del cinc que pasa a la disolución como Zn2+ y se deposita el cobre metálico. En este caso los 2 electrones pasan directamente del cinc al ion de cobre sin llegar a abandonar la lámina de cinc, siendo las dos semireacciones: Zn − 2e− → Zn2+ Cu2+ + 2e− → Cu Sin embargo, podemos obligar a que los electrones pasen del cinc a los iones de cobre a través de un circuito externo si separamos las dos semireacciones en compartimentos distintos, con lo que habremos construido una pila y conseguido que la energía de la reacción en lugar de transformarse en calor se transforme en energía eléctrica. Una pila Daniell, en honor de su descubridor, está formada por un recipiente que contiene una lámina de cinc en una disolución de sulfato de cinc y otro recipiente que contiene una lámina de cobre en una disolución de sulfato de cobre unidos mediante un tabique poroso o un puente salino inerte a la reacción redox, por ejemplo de cloruro potásico: Los conceptos de ánodo y cátodo, introducidos por Faraday, no se refieren a la polaridad concreta de un electrodo, sino al proceso que en él tiene lugar, así: • Ánodo es el electrodo donde tiene lugar la oxidación, es decir, la pérdida de electrones, que en el caso de una pila es el polo negativo. • Cátodo es el electrodo opuesto, es decir, donde tiene lugar la reducción o ganancia de electrones, que en el caso de una pila es el polo positivo. La notación de una pila se hace empezando por la semipila que hace de polo negativo o ánodo, de la siguiente forma: (además se suele especificar la concentración de los iones, por ejemplo si fuese 1M sería). − ánodo Zn │ Zn2+ (1M) ││ Cu2+ (1M)│ Cu cátodo + oxidación reducción ánodo oxidación cátodo reducción Cuando se une el electrodo de Zn con el de Cu aparece una corriente de electrones, que se puede observar con una amperímetro, y van desde el Zn, que es el polo negativo, hasta el 227 228 POTENCIALES NORMALES DE REDUCCIÓN Como hemos visto, la pila Daniell está formada por una semipila de Zn y otra de Cu, pero podríamos mantener la semipila de Zn y combinarla con otras semipilas, como una de Ag en iones Ag+, etc, siendo distinta, en cada caso, la diferencia de potencial entre los electrodos. Puesto que las posibilidades de combinación son muchísimas lo que haremos es tomar siempre un mismo electrodo de referencia. Así podremos construir una tabla (con los voltajes referidos a ese electrodo de referencia) que nos permita predecir la ddp de cada pila. Sin embargo habrá casos donde el voltímetro marque alrevés y eso indicaría que en el electrodo a medir no ocurre una reducción, sino alrevés una oxidación, y por eso se tabularía la diferencia de potencial con signo negativo. Por supuesto en este caso los polos habría que cambiarlos ya que ahora si en el electrodo a medir se produce una oxidación es porque realmente es el polo negativo y en el electrodo de hidrógeno tendrá lugar una reducción siendo el polo positivo. Este es el caso cuando se combina el Zn con el electrodo de hidrógeno. Un voltímetro mide siempre diferencia de potencial entre dos puntos, así que no es posible hablar del potencial absoluto de una semipila, a menos que lo refiramos a uno que por acuerdo le asignemos cero de forma arbitraria. Por acuerdo, el electrodo de referencia será el electrodo de hidrógeno al que se asigna arbitrariamente potencial cero y en el que la reacción parcial es: 2 H+ + 2e− ⇄ H2 Eº = 0 voltios El electrodo de hidrógeno es un electrodo de gases y está formado por un tubo de vidrio que tiene un electrodo inerte de platino y por el que se inyecta el gas a la presión de 1 atm. • Para empezar, como la diferencia de potencial entre los electrodos de una pila depende de las concentraciones de los iones y de la temperatura, los potenciales normales se tabulan para concentraciones 1M y a la temperatura de 25ºC • Los potenciales se tabulan siempre para la reacción de reducción, por eso se llaman potenciales normales de reducción. Si la reacción fuese la contraria (la de oxidación) el valor del potencial sería el mismo cambiado de signo. − ánodo Zn │ Zn2+ (1M) ││ H+ (1M)│ H2 (1atm) (Pt) cátodo + • Para medir los potenciales de reducción conectaremos el polo negativo del voltímetro al electrodo de hidrógeno y el positivo al electrodo a medir (donde debería ocurrir la reducción). Si el voltímetro marca correctamente quiere decir que hemos acertado y en el electrodo ocurre una reducción y lo que marque sería el valor que se tabula. Es lo que ocurre cuando el electrodo de hidrógeno se combina con uno de cobre: el hidrógeno hace de polo negativo (oxidación), y el cobre de positivo (reducción). El voltímetro marca +0,34V y es el valor que se tabula para la reducción del Cu2+ +2e− → Cu. Con este criterio se pueden medir los potenciales de cualquier semipila, siempre referidos al electrodo de hidrógeno, y se tabulan, como hemos dicho, para la reacción de reducción, obteniéndose la tabla siguiente: − ánodo (Pt), H2 (1atm) │ H+ (1M) ││ Cu2+ (1M)│ Cu cátodo + 229 230 Conclusiones que derivan de la tabla de potenciales normales de reducción: POTENCIALES NORMALES DE REDUCCIÓN Electrodo Proceso catódico de reducción Li+ | Li Li+ + e− = Li K+ | K K+ + e− = K 2+ Ca | Ca Ca2+ + 2e− = Ca + Na | Na Na+ + e− = Na Mg2+ | Mg Mg2+ + 2e− = Mg Al3+ | Al Al3+ + 3e− = Al 2+ Mn | Mn Mn2+ + 2e− = Mn 2+ Zn | Zn Zn2+ + 2e− = Zn 2− S | S (Pt) S + 2e− = S2− 2+ Fe | Fe Fe2+ + 2e− = Fe Cr3+ | Cr2+ (Pt) Cr3+ + e− = Cr2+ 2+ Cd | Cd Cd2+ + 2e− = Cd + Tl | Tl Tl+ + e− = Tl 2+ Co | Co Co2+ + 2e− = Co 2+ Ni | Ni Ni2+ + 2e− = Ni 2+ Sn | Sn Sn2+ + 2e− = Sn Pb2+ | Pb Pb2+ + 2e− = Pb Fe3+ | Fe Fe3+ + 3e− = Fe + H | H2 (Pt) 2H+ + 2e− = H2 2+ + Cu | Cu (Pt) Cu2+ + e− = Cu+ 2+ Cu | Cu Cu2+ + 2e− = Cu − O2 | OH (Pt) O2 + 2H2O + 4e− = 4OH− + Cu | Cu Cu+ + e− = Cu I2 | I− (Pt) I2 + 2e− = 2I− Fe3+ | Fe2+ (Pt) Fe3+ + e− = Fe2+ 2+ Hg2 | Hg Hg22+ + 2e− = 2Hg + Ag | Ag Ag+ + e− = Ag 2+ Hg | Hg Hg2+ + 2e− = Hg − Br2 | Br (Pt) Br2 + 2e− = 2Br− O2 | H+ (Pt) O2 + 4H+ + 4e− = 2H2O Tl3+ | Tl+ (Pt) Tl3+ + 2e− = Tl+ 2− + 3+ Cr2O7 , H | Cr ( Pt) Cr2O72− + 14 H+ + 6e− = 2Cr3+ + 7H2O Cl2 | Cl− (Pt) Cl2 + 2e− = 2Cl− 3+ Au | Au Au3+ + 3e− = Au − + 2+ MnO4 ,H | Mn (Pt) MnO4− +8H+ + 5e− = Mn2+ + 4H2O Au+ | Au Au+ + e− = Au H2O2,H+ | H2O (Pt) H2O2 + 2H+ + 2e− = 2H2O 3+ 2+ Co | Co (Pt) Co3+ + e− = Co2+ − F2 | F (Pt) F2 + 2e− = 2F− Eo(volt) −3,045 −2,925 −2,866 −2,714 −2,363 −1,662 −1,179 −0,763 −0,479 −0,440 −0,408 −0,403 −0,336 −0,277 −0,250 −0,136 −0,126 −0,037 0,000 +0,153 +0,336 +0,401 +0,520 +0,535 +0,770 +0,788 +0,799 +0,854 +1,066 +1,229 +1,252 +1,333 +1,359 +1,497 +1,507 +1,691 +1,770 +1,808 +2,865 1. Ordenan las semireacciones de más reductor a menos. Quiere decir que arriba están los reductores más enérgicos y por tanto los que tienen mucha tendencia a ceder electrones y dar precisamente la reacción contraria. Por ese motivo los metales alcalinos son muy activos y pasan fácilmente a su forma iónica y son atacados fácilmente por los ácidos. Por contrario, abajo están los muy poco reductores, o lo que es igual, los que son muy oxidantes y tienden a tomar electrones, dando la reacción de reducción tal como se escribe en la tabla. Eso explica que el oro, platino y los llamados metales nobles sean metales muy estables. 2. Permiten conocer el potencial de una pila: El ánodo, donde tiene lugar la reacción oxidación (polo negativo), siempre es el que esté más arriba en la tabla, ya que cuanto más arriba esté menos tendencia tiene a dar la reacción de reducción, que es la que se tabula, y más tendencia tiene a dar la contraria: la de oxidación. Por eso habrá que escribirla al revés de cómo está en la tabla y cambiarle el signo al potencial. El cátodo, donde tiene lugar la reducción (polo positivo), siempre es el que esté más abajo en la tabla, es decir el que realmente tiende a dar la reacción tabulada: la de reducción. Así pues, no hay más que escribir las dos semireacciones (teniendo en cuenta, como hemos razonado, que siempre marca el sentido de la reacción aquel que tiene mayor potencial de reducción porque será el que dé la reacción de reducción tal como está escrita en la tabla, mientras que el otro dará la reacción contraria, la de oxidación). Luego se suman (y si lo hicimos bien el potencial de la reacción total siempre debe ser positivo). Resumiendo: De dos semireacciones de reducción siempre se da la de mayor potencial de reducción, y de dos semireacciones de oxidación siempre ocurre la de mayor potencial de oxidación Zn − 2e− → Zn2+ Eº = + 0,763 V (escrita al revés) Cu2+ + 2e− → Cu Eº = + 0,336 V −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− Zn + Cu2+ → Zn2+ + Cu Eº = + 1,099 V 2*( Li − 1e− → Li+ ) Eº = + 3,045 V Eº = + 0,336 V Cu2+ + 2e− → Cu −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 2Li + Cu2+ → 2Li+ + Cu Eº = + 3,381 V *2 Si una semireacción hay que multiplicarla por un coeficiente para igualar los electrones ganados y perdidos, “el potencial de la semireacción no se multiplica” por ese coeficiente, ya que la ddp es independiente del número de electrones que se transfieran de un polo a otro, aunque la intensidad sí que sería mayor. 3. Predecir la espontaneidad de una reacción: Como el potencial normal de reducción es una medida de la tendencia a tomar electrones, es decir a que ocurra la reacción: Mz+ + z e− → M Eº es razonable pensar que Eº esté relacionado con la energía libre de Gibbs (como la energía eléctrica es igual a la carga por el potencial) resulta que: ∆G o = − z F E o 231 232 Cu + HCl → no reacciona donde z = nº electrones puestos en juego en la reacción, F es la carga de 1 mol de electrones, que se conoce con el nombre de faraday F = 6,023.1023 . 1,6.10−19 ≈ 96500 Coulombios/mol Como sabemos, las reacciones espontáneas son todas aquellas para las que la variación de energía libre de Gibbs es negativa, y como ∆Gº = − z F.Eº, quiere decir que las reacciones espontáneas son todas aquellas que tienen un potencial positivo. 4. Alteración de los estados de valencia: Muchos elementos presentan varios estados de valencia y la tabla de potenciales normales nos permite predecir sobre su estabilidad, tal como hemos visto en el apartado anterior. Por ejemplo, vamos a ver la posibilidad de que ocurra la reacción: 3 Fe2+ → 2 Fe3+ + Fe Eº = − 1,210 V En primer lugar viene a demostrarnos, lo que ya habíamos razonado en el punto 1, y es que los elementos de arriba de la tabla son muy reductores y tienen a la reacción contraria a la de la tabla, mientras que los de abajo son muy oxidantes y sí tienen a reaccionar tal como está escrito. Como puedes comprobar, al ser los potenciales Eº(Fe2+/Fe) = − 0,440 V y Eº(Fe3+/Fe2+) = + 0,770 V, a la reacción anterior le corresponde un potencial de Eº = − 1,210 V, que al ser negativo significa que el ∆Gº de la reacción es positivo y por tanto que no ocurrirá de forma espontánea. Por otro lado, para saber si una reacción redox cualquiera es posible no tenemos más que descomponerla en sus semireacciones, escribir el potencial de cada una, y sumar. Si el resultado es un potencial positivo la reacción será espontánea y en caso contrario no. De acuerdo con ello, un metal desplaza de sus combinaciones a los que están por debajo en la tabla. Por eso el Zn desplaza espontáneamente al Cu2+. Algunos ejemplos significativos: Sin embargo a la reacción 2 Cu+ → Cu2+ + Cu le corresponde un potencial Eº = +0,520 −0,153 = +0,367 V, por lo que tendrá ∆Gº negativo y será espontánea. a) Reacción del Zn con H+: Lo primero que hay que hacer es mirar el potencial de reducción de cada uno en la tabla: Zn2+ + 2e− = Zn 2 H+ + 2e− = H2 Eº = − 0,763 V Eº = 0,000 V Ejemplo E2A.S2010 Teniendo en cuenta los potenciales de reducción estándar de los pares Eº(Cl2 /Cl−) = 1’36 V y Eº(Cu2+/Cu) = 0’34 V: a) Escriba la reacción global de la pila que se podría construir. b) Indique cuál es el cátodo y cuál el ánodo. c) ¿Cuál es la fuerza electromotriz de la pila, en condiciones estándar? a) Lo primero que hay que hacer es escribir la ecuación de reducción de los dos pares: siempre marca el sentido de la reacción aquel que tiene mayor potencial, que como vemos es el H+, por tanto la reacción ocurrirá en la forma: Cl2 + 2e− = 2 Cl− Cu2+ + 2e− = Cu Eº = + 1,36 V Eº = + 0,34 V como siempre marca el sentido de la reacción aquel que tiene mayor potencial, la reacción ocurrirá en la forma que indica el cloro que se reduce, mientras que el cobre se oxidará, así que : Eº = + 1,36 V Cl2 + 2e− → 2 Cl− Cu − 2e− → Cu2+ Eº = − 0,34 V −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− − 2+ Eº = + 1,02 V Cl2 + Cu → 2 Cl + Cu Zn − 2e− → Zn2+ Eº = + 0,763 V 2 H+ + 2e− → H2 Eº = 0,000 V −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− Zn + 2H+ → Zn2+ + H2 Eº = + 0,763 V La consecuencia, que ya sabemos, es que el Zn, como todos los metales que están por encima del hidrógeno, reaccionan con los ácidos dando la sal del ácido y el metal y desprendiendo hidrógeno (Zn+2HCl→ZnCl2+H2), mientras que eso no ocurre con los metales que están por debajo como el cobre. b) Reacción del Cobre con H+: igual que antes miramos los potenciales de reducción de cada uno y vemos que el del cobre es mayor, por tanto será el que decide el sentido de la reacción, así que : Cu2+ + 2e− → Cu Eº = + 0,336 V Eº = 0,000 V H2 − 2e− → 2 H+ −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− Cu2+ + H2 → Cu + 2H+ Eº = + 0,336 V b) El electrodo negativo será el cobre, porque es el que tiene menor potencial y donde se produce la oxidación y por tanto el ánodo, mientras que el polo positivo será el cloro, donde tiene lugar la reducción y por tanto el cátodo. El símbolo de la pila será: − ánodo Cu │ Cu2+ (1M) ││ Cl2 (1atm)│ Cl− (Pt) cátodo + donde hemos supuesto que el cloro, al se un electrodo de gases se hace burbujear sobre un electrodo inerte, por ejemplo de platino. c) El potencial de la pila, como hemos razonado, es 1,02 voltios Como hemos dicho antes el cobre no puede ser desplazado por el hidrógeno de los ácidos, sino todo lo contrario, son los iones de cobre quienes desplazan al hidrógeno molecular, así por ejemplo: 233 234 Ejemplo E4A.S2010 Ejemplo E1B.S2009 Se dispone de una disolución acuosa de AgNO3 1 M. a) Si se sumerge un alambre de cobre, ¿se oxidara? Justifique la respuesta. b) Si el alambre fuese de oro, ¿se oxidaría? Justifique la respuesta. c) Si se produce reacción, escriba y ajuste la ecuación correspondiente. Datos: Eº(Ag+/Ag) = 0’80 V ; Eº(Cu2+/Cu) = 0’34 V; Eº(Au3+/Au) = 1’50 V Sea una pila constituida, en condiciones estándar, por un electrodo de plata sumergido en una disolución de nitrato de plata y un electrodo de cadmio sumergido en una disolución de nitrato de cadmio. a) Escriba la reacción química que se produce en esta pila. b) Escriba la notación de la pila formada. c) Calcula la fuerza electromotriz de la pila. Datos: Eo(Ag+/Ag) = 0,80 V y Eo(Cd2+/Cd) = −0,40 V a) Lo primero que hay que hacer es escribir la ecuación de reducción de los dos pares: Ag+ + 1e− = Ag Cu2+ + 2e− = Cu Eº = + 0,80 V Eº = + 0,34 V a,c) Lo primero que hay que hacer es escribir la ecuación de reducción de los dos pares: Ag+ + 1e− = Ag Eº = + 0,80 V Cd2+ + 2e− = Cd Eº = − 0,40 V como vemos el mayor potencial corresponde a la plata, que será pues la reacción que ocurrirá en la forma que se indica, por tanto el cobre dará la contraria, es decir la de oxidación, así que : 2*( Ag+ + 1e− → Ag ) tonir002Eº = + 0,80 V Cu − 2e− → Cu2+ Eº = − 0,34 V −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 2Ag+ + Cu → 2Ag + Cu2+ Eº = + 0,46 V Efectivamente el cobre se oxidará y el alambre de cobre pasará a la disolución mientras que la plata irá precipitando. La disolución irá pasando del incoloro del nitrato de plata al color azulado del nitrato de cobre. b) Ahora procedemos de la misma forma y tendremos que la reacción que tendría lugar es justo la contraria. La oxidación del oro, que sería aquella en la que pierde electrones: Au − 3e− → Au3+, por tanto la reacción global debería ser: − ánodo Cd │ Cd2+ (1M) ││ Ag+ (1M)│ Ag cátodo + Ejemplo E6A.S2009 Razone si se produce alguna reacción, en condiciones estándar, al añadir: a) Cinc metálico a una disolución acuosa de iones Pb2+ b) Plata metálica a una disolución acuosa de iones Pb2+ Datos: Eº(Ag+/Ag) = 0,80V; Eº(Zn2+/Zn) = −0,76V; Eº(Pb2+/Pb) = −0,13V 3Ag+ + Au → 3Ag + Au3+ Si ahora escribimos las semireacciones de reducción correspondientes a los datos: Ag+ + 1e− = Ag Au3+ + 3e− = Au como el sentido de la reacción es el que tiene mayor potencial, la reacción ocurrirá en la forma que está escrita para la plata que se reduce, mientras que el cadmio se oxidará, así que : 2*(Ag+ + 1e− = Ag) Eº = + 0,80 V Cd − 2e− → Cd2+ Eº = + 0,40 V −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 2Ag+ + Cd → 2Ag + Cd2+ Eº = + 1,20 V b) La notación: Eº = + 0,80 V Eº = + 1,50 V a) Los potenciales Zn2+ + 2e− = Zn Pb2+ + 2e− = Pb Vemos que para que tenga lugar la reacción global anterior debemos a la primera semireacción restarle la segunda y obtendríamos para la reacción global Eº = − 0,70V, lo que quiere decir que ∆Gº es positivo y reacción o ocurrirá espontáneamente, así que al introducir el alambre de oro metálico en la disolución de plata no ocurrirá nada. Eº = − 076 V Eº = − 0,13 V La ecuación que tendría lugar al introducir el cinc metálico en la disolución de Pb2+ Zn + Pb2+ = Zn2+ + Pb c) El ajuste de la reacción en forma iónica ya se hizo más arriba. La reacción molecular sería: 2 AgNO3 + Cu → 2 Ag + Cu(NO3)2 Eº = +0,76 –0,13 = +0,63 al ser positivo el potencial redox de la reacción quiere decir que su variación de energía libre de Gibbs es negativa y que la reacción ocurrirá espontáneamente. b) Procediendo igual, llegarás a la conclusión de que para 2Ag + Pb2+ = 2Ag+ + Pb el potencial es Eº = −0,93V, por tanto ∆Gº de la reacción es positivo y la reacción no se produce. ELECTROLISIS 235 236 • Cada ión es atraído hacia el polo de la fuente de signo contrario, donde se descarga. La electrolisis es el proceso contrario al que tiene lugar en una pila galvánica. En la electrolisis se fuerza a que se descarguen los iones haciendo pasar una corriente eléctrica a través de un electrolito, que puede ser una sal disuelta o fundida. En una pila la reacción tiene lugar de forma espontánea y la energía de la reacción se convierte en energía eléctrica. • El anión cloruro es atraído hacia el polo positivo, donde cede su electrón y se descarga, sufriendo por tanto un proceso de oxidación. Así que ahora el polo donde se produce la oxidación, o ánodo, es ahora el polo positivo. Lo contrario le ocurre al sodio. • Para que la reacción electrolítica ocurra se necesita que la fuente externa aporte un potencial ligeramente superior al que se obtendría si se produjera la reacción inversa, que es la espontánea. En este caso la fuente debe suministrar un potencial superior a 4,073 Voltios. En la electrolisis de una sal fundida, como el NaCl, ocurre el proceso descrito anteriormente: en el polo positivo se forma cloro, que puede verse como burbujea, y mientras que en el polo negativo se forma sodio metálico. 2Na − 2e− → 2Na+ Eº = + 2,714 V En la electrolisis del agua, los iones OH− van al polo positivo, donde pierden sus electrones dando oxígeno, siendo por tanto el ánodo porque es donde tiene lugar la oxidacion. Los H+ van al polo negativo, donde toman los electrones dando hidrógeno molecular: Oxidación pila Cl2 + 2e− → 2 Cl− Eº = + 1,359 V Reducción −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− Cl2 + 2Na → 2 Cl− + 2Na+ Eº = + 4,073 V R.espontánea 4 OH− − 4e− → O2 + 2 H2O + oxidación / ánodo 2*( 2 H+ + 2e− → H2 ) − cátodo −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 4 H+ + 4OH− → 2H2 + O2 + 2H2O En el proceso electrolítico se fuerza a que ocurra la reacción contraria mediante el consumo de energía eléctrica aportado por una fuente externa a una disolución electrolítica. o bien, si tenemos en cuenta que el H+ y OH− provienen de la disociación de una molécula de agua, podemos poner que la reacción global es: 2 H2O → 2 H2 + O2 (A veces la reducción del protón también se escribe 2H2O + 2e− → H2 + 2OH− que realmente corresponde a la misma reacción que escribimos más arriba como puedes comprender sin más que recordar que H2O = H+OH− ) 2Na+ + 2e− → 2Na Eº = − 2,714 V Como el agua está poco disociada y por tanto no conduce muy bien la corriente, el proceso se puede mejorar añadiendo unas gotas de ácido sulfúrico. El sulfúrico al ser un ácido muy fuerte se disocia dando SO42− y H+. Pero los iones sulfato no intervienen en la reacción porque el azufre ya tiene la máxima valencia posible y por tanto ya no se puede oxidar más (igual ocurriría si, por ejemplo, añadiésemos NO3− o ClO4−) Reducción electrolisis 2Cl− − 2e− → Cl2 Eº = − 1,359 V Oxidación −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− − + R.forzada 2 Cl + 2Na → Cl2 + 2Na Eº = − 4,073 V En el proceso de electrolisis: 237 238 Faraday enunció dos leyes para la electrolisis: Cuando la electrolisis se hace a una disolución acuosa el proceso es más complejo porque también intervienen los iones del agua H+ y OH− procedentes de la disociación del agua y pueden descargarse en los respectivos electrodos en lugar de los propios iones de la sal. 1. La masa de sustancia depositada en la electrolisis es proporcional a carga eléctrica, es decir, es proporcional a la intensidad de la corriente y al tiempo que está circulando (q = I.t). En el cátodo, la reacción de reducción puede ocurrir para el catión o para el H+. Como ahora la reacción es forzada, la reacción de reducción la da el que tenga menor potencial de reducción (el más arriba). Así por ejemplo, si se electroliza una sal disuelta en agua de Cu2+ se depositará cobre metálico, pero si se trata de una sal de sodio no se formará sodio sino H2. m ~ q = I.t Esta ley es fácil de comprender si tenemos en cuenta que la masa de sustancia es proporcional al número de átomos, y que para que cada átomo se deposite debe tomar o perder un determinado número de electrones, así que cuanto mayor sea la intensidad y el tiempo más átomos se depositarán. En el ánodo, la reacción de oxidación puede ocurrir para el anión de la sal o bien para el OH− . Como ahora la reacción es forzada, la reacción de oxidación la dará quién tenga menor potencial de oxidación, o lo que es igual, el que tenga mayor potencial de reducción que es lo que se tabula (el más abajo). Así por ejemplo el Cl− se oxidaría dando Cl2, pero el S2− no daría azufre sino que se descargaría el OH− produciendo oxígeno. 2. Una carga de 96.500 C (llamada Faraday) deposita una masa igual a un equivalente gramo de cualquier sustancia. De todas formas es más complejo de lo que parece a simple vista porque los valores de los potenciales de reducción se tabulan para una temperatura de 25ºC y concentración 1M, pero el potencial depende de la concentración, tal como viene dado por la ecuación de Nernst, de manera que según que el medio sea ácido, básico o neutro al variar la concentración de protones y de iones OH−, varían sus potenciales de reducción. Esta ley también es fácil de comprender, aunque no en el tiempo de Faraday cuando aun no se conocía la naturaleza eléctrica de la materia. Si por ejemplo pensamos en la reacción que tiene lugar en la descarga del catión del sodio: Na+ + 1e− → Na En concreto, el potencial de referencia del electrodo de hidrógeno 2H + 2e− → H2 es de 0V cuando la concentración de protones es 1M, es decir para pH=1, pero en una disolución neutra, donde el pH=7 y la concentración de H+=10−7M resulta de la aplicación de la ecuación de Nernst que su potencial de reducción no es cero, sino −0,41V. Eso quiere decir que en la electrolisis de una disolución de pH=1 se depositarán todos los metales por debajo del hidrógeno, como cobre, plata, oro, sin embargo no se depositarían plomo, estaño o níquel y en su lugar se desprendería hidrógeno. No obstante si el pH es neutro sí se depositarían en forma metálica los iones de plomo, estaño o níquel. + como por cada electrón se obtiene un átomo de sodio, es evidente que para obtener 1 mol de sodio son necesarios 1 mol de electrones, por tanto, 1 F es la carga de 1 mol de electrones y será igual al número de Avogadro por la carga de 1 electrón: F = 6,023.1023 La electrolisis es un proceso muy importante en la industria. Se utiliza para bañar objetos metálicos dándoles una capa de metal. Se colocan como cátodo y sobre ellos se van descargando los iones metálicos con los que se desea recubrir. Así se consigue el niquelado y cromado, baños de plata y de oro, etc. En estos casos, y puesto que conforme pasa el tiempo la disolución se va diluyendo cada vez más en iones metálicos porque se van depositando, se suele emplear como ánodo un ánodo del mismo metal del que se quiere recubrir el cátodo. De esta forma la reacción en el ánodo es que se oxida y va disolviéndose, mientras que en el cátodo se reduce y se va depositando, y así la concentración de la disolución no disminuye. eletrones . . −19 Coulombios 1,6 10 ≈ 96500 C/mol mol electrón está claro que si en lugar de depositar sodio, depositásemos Cu2+, como requiere dos electrones por cada átomo necesitaríamos 2F para depositar 1 mol de cobre, así que con 1F podremos depositar 1 eq = 1mol/2, que es lo que dice la segunda ley. Gráficamente podemos entenderlo mejor, ya que si unimos varias cubas electrolíticas en serie, para que por todas ellas circule la misma intensidad: Otra aplicación muy importante de la electrolisis es para separar metales de sus sales y también como método para purificar metales. LEYES DE FARADAY 239 240 En todos los electrodos se depositará el mismo número de equivalentes. Es decir, para una corriente I durante un tiempo t, tendremos los mismos equivalentes de oxígeno que de cobre, que de cloro, que de sodio y que de hidrógeno. Si dejamos el tiempo necesario (*) para que por las cubas circule una carga de 1F = 96500 C, entonces en todos los electrodos se depositaría exactamente un equivalente de cada sustancia, es decir que tendríamos: 2O2− − 4e− → O2 O2− − 2e− → ½O2 1 eqO2 = 32/4 = 8 gr O2 1 eqO2 = 16/2 = 8 gr O2 Cu2+ + 2e− → Cu 1eqCu = 63,5/2 = 31,75 gr Cu − 2Cl − 2e− → Cl2 1 eqCl2 = 71/2 = 35,5 gr Cl2 Na+ + 1e− → Na 1eqNa = 23/1 = 23 gr Na 2H+ + 2e− → H2 1 eqH2 = 2/2 = 1 gr H2 Ejemplo E1B.S2010 Se realiza la electrodeposición completa de la plata que hay en 2 L de una disolución de AgNO3. Si fue necesaria una corriente de 1’86 A. durante 12 minutos, calcule: a) La molaridad de la disolución de AgNO3 b) Los gramos de plata depositados en el cátodo. Datos: F = 96500 C. Masa atómica: Ag = 108. a) Como 1F deposita 1Peq de cualquier sustancia, y teniendo en cuenta que 1PeqAgNO3 = PmAgNO3 / 1 = 170 g AgNO3 96500 Peq = I⋅t m M AgNO3 = 1 F = 96500 C deposita 1 Eq, es decir −− 8 g O2 −−− 31,75 g Cu −− 35,5 g Cl2 I.t C deposita −−−−−−−−−−−− x g O2 −−− y g Cu −− z g Cl2 (*) el tiempo necesario para que por las cubas circule la carga de un culombio es muy sencillo de calcular, sin más que tener en cuenta (q=I.t), así que si, por ejemplo, la fuente externa suministra una corriente de 5 amperios, el tiempo necesario sería: 96500 = 5.t, de donde t = 19300 seg = 5,36 horas. A partir de la segunda ley de Faraday puede calcularse fácilmente la masa de sustancia que se depositará para una carga q, o lo que es igual, para una intensidad y tiempo concreto, sin más que establecer una simple proporción, ya que sabemos que: Si una carga de 1Faraday= 96500 coulombios deposita un equivalente entonces una carga q=I.t depositará una masa m, así que: 96500 Peq = I⋅t m b) Como sabemos la intensidad de la corriente y el tiempo que ha estado circulando podemos calcular la cantidad de plata depositada sin más que aplicar la segunda ley de Faraday: Tendremos en cuenta que: • el PeqAg = 108/1 = 108 g/eq ya que la reacción que tiene lugar en el cátodo es Ag+ + 1e− → Ag y la plata pone en juego 1 solo e−. • y que el tiempo debemos ponerlo en segundos. así que es 12.60 seg 96500 Peq = I⋅t m m= Peq ⋅ I ⋅ t 108 ⋅ 1,86 ⋅ 12 ⋅ 60 = = 1,5g Ag 96500 96500 a) Ahora sabemos que había 1,5 g de Ag+ disueltos en los 2L, o lo que es igual, que la concentración en gr/L es la mitad: 0,75 gr de Ag+/L. (Podríamos establecer una proporción entre la cantidad plata y la que hay en el AgNO3 y así obtener la cantidad de AgNO3 que había en la disolución, pero eso no es necesario, ya que la concentración de AgNO3 es la misma que la de Ag+ y la misma que la de NO3−.) g / L 0,75 = = 6,94 ⋅ 10 −3 moles Ag + / L Pat 108 Aunque como hemos dicho no es necesario, vamos a proceder de la otra forma: Como el Pm del AgNO3 es 170 g/mol, y de ellos 108 g son plata, si hemos obtenido 1,5 g de plata quiere decir que de AgNO3 habría: en 1 mol de AgNO3 −−− 170g AgNO3 hay 108 de Ag x g AgNO3 hay 1,5 de Ag de donde x = 2,36 gr g AgNO3 disueltos en los 2L, así que la concentración en g/L de AgNO3 será la mitad: 1,18 g/L. Y la moralidad: M AgNO3 = 241 Peq ⋅ I ⋅ t 170 ⋅ 1,86 ⋅ 12 ⋅ 60 = = 2,36g AgNO 3 96500 96500 g / L 2,36 / 2 = = 6,94 ⋅ 10 −3 moles AgNO 3 / L Pat 170 M Ag + = Mediante esta expresión no solo podemos calcular la masa que una corriente I deposita en un tiempo t, sino que conocidas estas variables, podemos calcular el peso equivalente y de él, el número de electrones que se ponen en juego, o bien si tenemos en cuenta la definición de lo que es un faraday ( F = 96500 = Nav.e− ) también se puede deducir de aquí el valor del número de Avogadro, conocida la carga del electrón. m= g / L 1,18 = = 6,94 ⋅ 10 −3 moles AgNO 3 / L Pm 170 242 Ejemplo E5B.S2009 Se electroliza una disolución acuosa de ácido sulfúrico y se desprende hidrógeno y oxígeno. a) ¿Qué cantidad de carga eléctrica se ha de utilizar para obtener 1L de oxígeno medido en condiciones normales? b) ¿Cuántos moles de hidrógeno se obtienen en esas condiciones? Datos: F = 96500 C. Ejemplo E2B.S2010 Por dos cubas electrolíticas que contienen disoluciones de nitrato de plata y sulfato de cobre (II), respectivamente, pasa la misma cantidad de corriente. Calcule: a) Los gramos de cobre depositados en la segunda cuba, si en la primera se han depositado 10 g de plata. b) El tiempo que dura el proceso si la corriente que circula es de 5 amperios. Datos: F = 96500 C. Masas atómicas: Cu = 63’5; Ag = 108. a) Sabemos que en CN un mol de cualquier gas ocupa 22,4 L, y tienen una masa igual a su masa molecular, que para el oxígeno es 32 g, así que si se ha obtenido un 1 L de O2. [De no darse el volumen en CN deberíamos calcularlo mediante la ecuación general de los gases PV = (m/Pm)RT ] 1 mol O2 −−−− 32 g O2 −−−− 22,4 L C.N. x g O2 −−−− 1 L C.N. a) De acuerdo con la segunda ley de Faraday que 1 mol de electrones, 96500C, deposita un equivalente de cualquier sustancia, y como por las dos cubas está circulando la misma corriente y el mismo tiempo, podemos poner que: 96500 Peq Ag Peq Cu = = I⋅t m Ag m Cu de donde x = 1,43 g O2, y como el oxígeno pone en juego 4e−, su Peq = Pm/4 = 8 g/eq teniendo en cuenta que la plata pone en juego 1 e− y el cobre 2 e−, podemos poner que: Pat Ag / 1 m Ag Pat Cu / 2 = → m Cu 108 / 1 63,5 / 2 = 10 m Cu 96500 Peq O 2 Peq H 2 = = q mO2 m H2 b) A partir de cualquiera de las masas depositadas, por ejemplo de la de plata que es el dato del problema: 96500 Peq Ag 96500 108 = → = I⋅t m Ag 5⋅ t 10 y como moles H 2 = Ejemplo E2B.S2009 Para platear un objeto se ha estimado que es necesario depositar 40 g de plata. a) Si se realiza la electrolisis de una disolución acuosa de sal de plata con una corriente de 2 amperios. ¿Cuánto tiempo se tardará en realizar el plateado? b) Cuantos moles de electrones han sido necesarios para ello?. Datos: F = 96500 C. Masa atómica: Ag = 108 → 96500 108 = 2⋅t 40 → → q = 17249 C → 32 / 4 2 / 2 = 1,43 m H 2 → mH2 = 0,18 g H2 m 0,18 = = 0,09 moles de hidrógeno Pm 2 Podíamos hacer otro razonamiento mucho mas simple: Como en la descomposición del agua se obtiene el doble de volumen de hidrógeno que de oxígeno, y si son las mismas condiciones, podemos poner que : de donde se deduce que el tiempo que ha estado circulando la corriente es t = 1787 seg que es prácticamente media hora. 96500 Peq = I⋅t m 96500 32 / 4 = q 1,43 → b) Sabemos, de acuerdo con la segunda ley de Faraday que 1 mol de electrones, 96500 C, deposita un equivalente de cualquier sustancia, tanto si es H2 como si es O2, podemos poner que: de donde se deduce que la masa de Cu depositada en el cátodo de la segunda cuba ha sido m Cu = 2,94 g Cu a) 96500 Peq = I⋅t m 1 mol H2 −−−− 2 g H2 −−−− 22,4 L C.N. x moles H2 −−−−−−−−−−−− 2 L C.N. de donde x = 0,09 moles H2 t = 17870 s = 4,96 h b) De acuerdo con la segunda ley de Faraday que 1 mol de electrones, 96500 C, deposita un equivalente de cualquier sustancia, en este caso 108 g de Ag, así que para depositar 40 g: 1mol e − Peq = x m → 1mol e − 108 = x 40 → x = 0,37 moles de e− 243 244 TEMA 8. ESTUDIO DE ALGUNAS FUNCIONES ORGÁNICAS Ejemplo E5B.S2007 La fórmula de un cloruro metálico es MCl4. Se realiza la electrolisis a una disolución de dicho cloruro haciendo pasar una corriente eléctrica de 1’81 amperios durante 25’6 minutos, obteniéndose 0’53 g del metal. Calcule: a) La masa atómica del metal. b) El volumen de Cl2 que se obtendrá en el ánodo, medido en condiciones normales. Dato: F = 96500 C. Los compuestos orgánicos • Fórmula empírica • Fórmula molecular • Fórmulas estructurales Clasificación de los compuestos orgánicos a) De la fórmula del cloruro se deduce que el metal se descargará en el cátodo de acuerdo con la siguiente reacción M4+ + 4e− → M lo que quiere decir que su Peq = Pat/4, por tanto, y teniendo cuidado de poner el tiempo en segundos: 96500 Peq = I⋅t m → 96500 Pat / 4 = 1,81 ⋅ 25,6 ⋅ 60 0,53 → Isomería Pat = 73,6 g/mol • Plana: I. de cadenas o de ciclos I. de posición I. de función • Del espacio: I. geométrica o cis−trans I. óptica b) El cloro se descarga en el ánodo según 2Cl− − 2e− → Cl2 así que su Peq = Pm/2 96500 Peq = I⋅t m → 96500 71 / 2 = 1,81 ⋅ 25,6 ⋅ 60 m • Grupo Funcional. • Serie homóloga → m =1 g Cl2 Reacciones de sustitución alifática y aromática. Reacciones de adición de hidrógeno, halógenos, haluros de hidrógeno y agua al doble y triple enlace carbono-carbono. Reacciones de eliminación de agua y de haluros de hidrógeno. Reacciones de esterificación. No se exigirá el conocimiento de los mecanismos de las reacciones anteriores. . 1 mol Cl2 −−−− 2 35,5 g Cl2 −−− 22,4 L C.N. 1 g Cl2 −−−− x L C.N. de donde x = 0,32 L Cl2 medidos en CN Puede hacerse otro razonamiento, que quizá es el que se espera, ya que no dan como dato la masa atómica del cloro. Sería teniendo en cuenta que el número de equivalentes que se depositan es el mismo sea la sustancia que sea, por tanto, como el número de equivalentes depositados de metal debe ser igual al nº de equivalentes de cloro: mM 0,53 = = 0,029 = eq Cl 2 Peq M 73,6 4 teniendo en cuenta ahora que eq = moles . ν tenemos que el número de moles Cl2 que se han obtenido es: eq Cl 2 0,029 moles Cl 2 = = = 0,0145 moles ν 2 y ahora como 1 mol Cl2 −−−− 2.35,5 g Cl2 −−−− 22,4 L C.N. 0,0145 moles Cl2 −−−−−−−−−−−−−−−− x L C.N. eq M = de donde x = 0,32 L Cl2 medidos en CN 245 246 LOS COMPUESTOS ORGÁNICOS CLASIFICACIÓN DE LOS COMPUESTOS ORGÁNICOS La química orgánica estudia los compuestos del carbono, aunque algunas combinaciones sencillas, como sus óxidos, carburos y carbonatos se estudian dentro de los compuestos inorgánicos. Los compuestos orgánicos se clasifican de acuerdo a determinadas agrupaciones de átomos que por sus características le confieren al resto de la cadena unas propiedades químicas especiales. A ese grupo de átomos se le llama Grupo Funcional. La inmensa cantidad de compuestos orgánicos, la mayoría de ellos formados solo por la unión a hidrógeno y oxígeno, se debe a: • La capacidad que tiene el carbono de unirse a sí mismo y formar cadenas, ya que las energías de enlace C−C es muy grande y comparable a la que tiene lugar en la unión con el hidrógeno o con el oxígeno. Eso no le ocurre al silicio, porque la unión Si−Si tiene una energía de enlace muy pequeña que no compite con las uniones más estables que forma con los otros elementos. • Además el carbono tiene la capacidad de formar consigo mismo dobles y triples enlaces cuando presenta, respectivamente, las hibridaciones sp2 (trigonal plana) y sp (lineal), como ya vimos. Serie homóloga: Se llama así al grupo de compuestos que tienen el mismo grupo funcional (por tanto pertenecen a la misma clase), pero difieren en la longitud de la cadena, es decir tienen un –CH2− más o menos. Los principales grupos funcionales son los siguientes: Clase Grupo funcional alcanos ninguno alquenos 1. Fórmula empírica, expresa solamente la proporción en que se encuentran los átomos, por ejemplo (C2H4)n 2. Fórmula molecular, indica el total de átomos que forman en la molécula: C4H8 Hidrocarburos Las fórmulas de los compuestos orgánicos pueden representarse con varios niveles de concreción y así tenemos: alquinos R−C≡C−R cíclicos terminación radical Ejemplo CH3−CH3 etano ano il/ilo eno enil/enilo CH3−CH=CH2 propeno ino inil/inilo CH3−C≡C−CH3 2−Butino ciclo− ciclohexano 3. Fórmulas estructurales: Indican los enlacen que unen los átomos entre sí. Pueden ser: • Lineal o Condensada: CH2=CH−CH2−CH3 • Plana o Expandida: representan en un plano todos los enlaces H H \ | | C=C−C−C−H / | | | H H H H fenil metilbenceno / fenilmetano (tolueno) derivados del benceno H \ C=CH−CH2−CH3 / haluros de alquilo R−X cloruro cloro CH3−CH2−Br bromuro de etilo alcoholes R−OH ol hidroxi CH3−CH2−OH etanol fenoles Ar−OH ol hidroxi H En la mayoría de los casos lo que se suele utilizar una mezcla en la que se combina la forma condensada y expandida, como se escribe a la derecha. • Tridimensional, en las que se representan los enlaces según las direcciones en el espacio. El criterio para dibujar los enlaces es con un trazo normal cuando el enlace está en el plano del papel, en forma de cuña cuando apunta hacia delante del papel y por un trazo discontinuo cuando el enlace apunta hacia detrás. Funciones oxigenadas H eno aromáticos fenol éteres aldehídos R−O−R´ éter oxi al formil CH3−CH2−O−CH2−CH3 etoxietano / dietiléter etanal cetonas ona oxo propanona 247 248 ISOMERÍA ácidos carboxílicos ác. −oico carboxi ácido etanoico (ác. acético) ésteres y sales −ato de −ilo Funciones nitrogenads etanoato de metilo aminas primarias R−NH2 amina amino CH3−NH2 metilamina aminas secundarias R−NH−R´ amina amino (CH3)2NH dimetilamina aminas terciarias amina amino (CH3)3N trimetilamina amidas amida Se dice que dos compuestos son isómeros cuando tienen la misma fórmula molecular pero distinta fórmula desarrollada. Por tanto, los isómeros son sustancias que tienen el mismo número y tipo de átomos, aunque éstos están unidos de forma diferente y consecuentemente presentan distintas propiedades. Los tipos de isomería se clasifican en dos grandes grupos: Isomería plana o simple, que es la que puede explicarse con fórmulas planas y la Isomería del espacio o estéreo−isomería que para explicarla se necesita recurrir a la forma tridimensional de las moléculas. de cadenas o de ciclos plana o simple de posición de función Isomerías −C≡N nitrilo nitroderivados −NO2 nitro ciano CH3CN etanonitrilo CH3NO2 nitrometano CH3–O– CH3 geométrica o cis−trans etanamida nitrilos CH3–CH2OH del espacio o estéreo−isomería óptica Esqueletos carbonados: cadenas principales n Nombre (−ano) Fórmula (CnH2n+2) n Nombre (−ano) Fórmula (CnH2n+2) 1 metano CH4 8 octano CH3(CH2)6CH3 2 etano CH3CH3 9 nonano CH3(CH2)7CH3 3 propano CH3CH2CH3 10 decano CH3(CH2)8CH3 4 butano CH3(CH2)2CH3 11 undecano CH3(CH2)9CH3 5 pentano CH3(CH2)3CH3 12 dodecano CH3(CH2)10CH3 6 hexano CH3(CH2)4CH3 13 tridecano CH3(CH2)11CH3 7 heptano CH3(CH2)5CH3 14 tetradecano CH3(CH2)12CH3 1.1 La isomería de cadenas o de ciclos se presenta en hidrocarburos que teniendo el mismo número de carbonos presentan distinto esqueleto. Por ejemplo el butano y el metil−propano formulados anteriormente o el ciclohexano y el metil−ciclopentano o el etil−ciclobutano presentarían isomería de ciclos: 1.2 La isomería de posición se presenta cuando en el esqueleto hidrocarbonado se introduce otra función o átomo distinto del hidrógeno. Dependiendo del lugar que ocupe, tenemos por ejemplo el 1−cloro−butano o el 2−cloro−butano formulados anteriormente. Otro ejemplo es que se tiene para el orto, meta y para−diclorobenceno 249 250 1.3 La isomería de función tiene lugar cuando la diferente ordenación de los átomos da lugar a distintos grupos funcionales, por ejemplo como ocurre entre alcoholes y éteres, caso del etanol y el dimetiléter formulados anteriormente o entre aldehídos y cetonas como por ejemplo entre el propanal y la propanona: E1B.S2010 Para el compuesto CH3CH2CH=CHCOOH (ácido pent−2−enoico), escriba: a) La fórmula de un isómero que contenga la función cetona. b) La pareja de moléculas de este ácido que son isómeros cis−trans. c) La fórmula de un isómero de cadena de este ácido. 2.1 La isomería geométrica o cis−trans es consecuencia del impedimento de giro del doble enlace. El 1,2−dicloroetano formulado anteriormente presenta un isómero cis cuando los dos cloros están enfrentados y otro trans cuando están en las posiciones opuestas. Otro ejemplo lo tendríamos el but−2−eno: 2.2 La isomería óptica la presentan todas aquellas sustancias que tienen un carbono asimétrico, es decir un carbono con sus cuatro sustituyentes diferentes. Estos isómeros con como imágenes especulares y tienen las mismas propiedades a diferencia de que uno hace girar el plano de la luz polarizada hacia la izquierda y el otro hacia la derecha, por eso a los isómeros se les llama, respectivamente, isómero levo o (–) y al otro isómero dextro o (+) El ácido láctico formulado anteriormente es un ejemplo. Como vemos presenta un carbono asimétrico (suele marcarse con un asterisco) que es el responsable de la isomería óptica. a) se trata de obtener un isómero de función, ya que en el primer caso es un ácido y en el segundo una cetona (y en el isómero propuesto además es alcohol) b) La isomería cis−trans es debida al impedimento de giro por un doble enlace. El isómero cis es aquel que enfrenta a los grupos diferentes al hidrógeno, que no es preciso que sean iguales, como así ocurre en este caso, ya que los grupos son un radical etilo y el grupo carboxilo: c) Un isómero de cadena debe mantener los mismos grupos funcionales y variar exclusivamente en la forma del esqueleto, así que sería: (CH3)2C=CHCOOH Los carbohidratos (llamados también glúcidos o azúcares) presentan isomería óptica, desde el más sencillo que es el gliceraldehído: 251 252 sustituyentes estén en carbonos contiguos, alternos u opuestos respectivamente. E1B.S2008 Dados los compuestos: (CH3)2CHCOOCH3 ; CH3OCH3 ; CH2=CHCHO a) Identifique y nombre la función que presenta cada uno. b) Razone si presentan isomería cis−trans. c) Justifique si presentan isomería óptica. E6A.S2007 Para los compuestos benceno (C6H6) y acetileno (C2H2), justifique la veracidad o falsedad de las siguientes afirmaciones: a) Ambos tienen la misma fórmula empírica. b) Poseen la misma fórmula molecular. c) La composición centesimal de los dos compuestos es la misma. a) Escribiremos mejor las fórmulas en su forma plana para ver mejor los grupos funcionales: a) Verdad: La fórmula empírica de una sustancia solamente indica la proporción en la que se encuentran sus átomos, que en el caso del benceno y del acetileno es la misma: 1 átomo de carbono por cada 1 átomo de hidrogeno, lo que se suele expresar como (CH)n, por tanto para calcular el valor de n y escribir sus fórmulas moleculares es necesario conocer el peso molecular. El primero es un éster formado por la esterificación del ácido 2−metilpropanoico (llamado también ácido isobutírico) y del metanol, así que su nombre es el 2−metilpropanoato de metilo. b)Falso, ya que la fórmula molecular nos indica el total de átomos en la molécula y por tanto nos permite diferenciar la molécula de benceno de la de aceliteno. Lo que nos permitiría es diferenciar entre los posibles isómeros en el caso de haberlos. El segundo es un éter: el éter dimetílico o metoximetano El tercero es un aldehído, que además tiene un doble enlace y por tanto es también un alqueno. Su nombre propenal. c) Verdad, ya que la composición centesimal lo que nos indica es la cantidad de cada elemento que hay en 100 g de compuesto y al estar los átomos en la misma proporción en ambas moléculas la cantidad es la misma. b) El único que podría presentar isomería cis−trans es el que posee doble enlace, pero no la tiene en este caso porque los dos sustituyentes de uno de los carbonos son hidrógenos E4A.S2006 Escriba: a) Dos hidrocarburos saturados que sean isómeros de cadena entre sí. b) Dos alcoholes que sean entre sí isómeros de posición. c) Un aldehído que muestre isomería óptica. c) Ninguno de ellos presenta isomería óptica porque ninguno de sus carbonos es asimétrico, es decir, no hay ningún carbono con los cuatro sustituyentes distintos. a) Por ejemplo el butano y el metilpropano (isobutano) E6A.S2008 Para cada compuesto, formule: a) Los isómeros cis−trans de CH3CH2CH=CHCH3 b) Un isómero de función de CH3OCH2CH3 c) Un isómero de posición del derivado bencénico C6H4Cl2 b) Por ejemplo el propan−1−ol y el propan−2−ol a) Se trata del pent−2−eno que al tener un doble enlace y por tanto impedimeto de giro y ser los sustituyentes distintos al hidrógeno presenta isomería geométrica o cis−trans. El isómero cis cuando los dos grupos están enfrentados y el trans cuando están en las posición opuesta: c) Cualquier aldosa (monosacárido con la función aldehído). El más sencillo que es el gliceraldehído tiene un carbono asimétrico y es el responsable de su isomería óptica: b) Los éteres presentan isomería de función con los alcoholes. Así el metoxietano es isómero del propan−1−ol y del propan−2−ol, que a su vez son isómeros de posición. c) El diclorobenceno tiene 3 isómeros de posición: orto, meta y para según que los 253 254 MECANISMOS DE LAS REACCIONES ORGÁNICAS El ataque al núcleo bencénico es lento porque en ese paso se pierde la aromaticidad aunque luego se vuelve a recuperar. De todas formas el complejo aromático que se forma tiene una cierta estabilidad debido a la deslocalización de la carga positiva, ya que se forman 3 estructuras resonantes: La mayoría de las reacciones orgánicas pueden clasificarse en: 1. 2. 3. 4. Sustitución: Electrófila y Nucleófila Adición Eliminación Transposición A su vez las reacciones pueden clasificarse en heteropolares (cuando se originan iones) y homopolares (tienen lugar por medio de radicales libres) 1.1 Sustitución electrófila: Tiene su máximo interés en los hidrocarburos aromáticos. El reactivo, como su nombre indica, es electrófilo, es decir, que tiene tendencia hacia los electrones. Son reactivos electrófilos: • las partículas cargadas positivamente y que sean inestables. Por ejemplo Na+, H+, Br+, NO2+ son todos ellos electrófilos, pero solo el Br+ y NO2+ son buenos reactivos porque son muy inestables. • las estructuras, que aunque no tengan carga positiva, posean déficit de electrones para completar su octete, por ejemplo CO, BF3, AlCl3 Vamos a ver la cloración del benceno catalizada por AlCl3 El mismo mecanismo tiene lugar cuando se trata benceno con ácido nítrico en presencia de sulfúrico. El sulfúrico con el nítrico da lugar a NO2+ que es un reactivo electrófilo y ataca al núcleo del benceno dando nitrobenceno y agua: 1.2 Sustitución nucleófila: El reactivo, como su nombre indica, es nucleófilo, es decir, que tiene tendencia hacia las cargas positivas. Son reactivos nucleófilos X–, OH–, CN–, y moléculas neutras en las que hay pares de electrones no enlazantes, como el H2O, NH3. CH3CH2–Cl + HBr → CH3CH2–Br + HCl CH3CH2–Cl + H2O ——→ CH3–CH2OH + HCl CH3CH2–Cl + AgOH ——→ Ampliación El mecanismo de la reacción es el siguiente: Comienza por el ataque del cloro al AlCl3, donde el aluminio con solo 3 pares de e– acepta un Cl– pasando así a formar la estructura AlCl4– con la que el aluminio obtiene su octete, y formándose de paso Cl+ que es el reactivo eletrófilo, muy inestable: ahora el Cl+ ataca el anillo bencénico porque tiene una alta densidad electrónica. (Lo mismo haría con un doble enlace aunque en este caso daría lugar a una adición en lugar de una sustitución.) CH3–CH2OH + AgCl ↓ base débil CH3–CH2OH + KCl CH3CH2–Cl + KOH base fuerte CH2=CH2 + KCl + H2O Ampliación Debido a que el halógeno es muy electronegativo el enlace con el carbono está muy polarizado, pudiendo llevarse el par de electrones del enlace y dejando un radical cargado positivamente llamado carbanión. El bromuro se une al carbanión y el protón al ión del halógeno: por último el H+ reacciona con el AlCl4– dando cloruro de hidrógeno y devolviendo el catalizador: AlCl4– + H+ → AlCl3 + HCl 255 256 2. Adición: Las reacciones de adición tienen lugar a doble o triple enlace. Debido a la alta densidad elecrónica del doble y triple enlace, éste es atacado por reactivos electrófilos ya que tienen tendencia hacia los electrones. Los tres ejemplos típicos son la reacción de alqueno con X2, HX y H2O catalizada por ácido. 3. Eliminación: Las reacciones de eliminación son aquellas en las que normalmente se eliminan dos sustituyentes de carbonos contiguos dando lugar a doble o triple enlace. Entre ellas está las que dan los haluros del alquilo catalizadas por bases , o la deshidratación de un alcohol en medio ácido o la deshidrogenación de un alcano catalizada por metales. KOH/Etanol CH3CH2–Cl CH2=CH2 + Cl2 → Cl–CH2–CH2–Cl ——→ CH2=CH2 + KCl + H2O KOH/Etanol Cl–CH2CH2–Cl ——→ CH≡CH + 2 KCl + 2 H2O (es igual a la anterior, pero en dos pasos) CH2=CH2 + HCl → CH3–CH2–Cl H+ H2SO4 CH2=CH2 + H2O → CH3–CH2–OH CH3CH2–OH ——→ CH2=CH2 + H2O Pt / Pd CH3CH3 Ampliación La adición electrófila siempre tiene lugar en trans. Esta reacción tiene una primera fase muy lenta. Mejora catalizada por AlCl3 ya que Cl2 + AlCl3 → Cl+ + AlCl4– y, como hemos visto antes, el Cl+ que es muy reactivo y ataca fácilmente el doble enlace de la misma manera que en el ejemplo anterior atacó al núcleo bencénico. ——→ CH2=CH2 + H2 Ampliación Las reacciones de eliminación pueden ser monomoleculares, bimoleculares y deshidrogenación La reacción de eliminación en derivados halogenados es monomolecular Cuando se adiciona un haluro de hidrógeno a doble enlace, de acuerdo con la regla de Marconicof, el halógeno se une al carbono que tiene el radical mayor y que está más sustituido por grupos R. Esta reacción de eliminación en derivados halogenados es mucho más rápida si se cataliza por una base, por ejemplo KOH en etanol, en cuyo caso es bimolecular. Tiene lugar en trans. poniendo una base general, la misma reacción en el espacio sería la siguiente: La adición de agua catalizada por un ácido da lugar a un alcohol. Sería: La deshidratación de un alcohol para dar el compuesto etilénico y agua es: esta reacción, en lugar de catalizarla una base va mejor cuando la cataliza un ácido ya que el enlace C–OH no está tan polarizado como en el caso del halógeno. De esta manera el ácido acepta los pares no enlazantes del oxígeno polarizando mucho el enlace hasta romperse: 257 258 HIDROCARBUROS La eliminación de hidrógeno para dar un alqueno, lo mismo que la hidrogenación. Se catalizan por metales como platino o paladio y son siempre en cis Son compuestos formados exclusivamente de carbono e hidrógeno. El petróleo es una mezcla de hidrocarburos, y de él se obtienen por destilación fraccionada • Sus puntos de fusión y ebullición aumentan con la longitud de la cadena, debido a al aumento de las fuerzas de Van der Waals. Los 4 primero son gases, entre 5 y 15 carbonos líquidos y los demás sólidos. • Los que tienen moléculas planas, como el CH2=CH2 o el benceno se empaquetan fácilmente y tienen untos de fusión anómalamente superiores a lo esperado, por el contrario los hidrocarburos ramificados tienen puntos de fusión más bajos debido a lo contrario. • Son compuestos apolares y por tanto muy poco solubles en agua, aunque se disuelven en disolventes orgánicos. Al calentar el acetato de etilo y otros ésteres (pirólisis) se produce una eliminación en cis: Los hidrocarburos se clasifican en: 4. Transposición: Son reacciones en las que los átomos solamente cambian de lugar, dando lugar a un isómero. Un ejemplo típico lo tenemos en la transposición ceto−enólica en la que un enol da lugar a un aldehído: • • • • • Saturados o alcanos (CnH2n+2) Alquenos (CnH2n) Alquinos (CnH2n−2) Cicloalcanos (CnH2n) Aromáticos (derivados del benceno) Hidrocarburos saturados: En ellos el carbonos están unidos por enlaces simples y saturados de hidrógeno. A partir del butano pueden presentar isomería de cadenas y algunos isomería óptica, aumentando el número de isómeros con la longitud de la cadena. Reacciones homopolares o por radicales libres. Tienen lugar cuando una molécula se rompe homolíticamente y da lugar a dos restos muy inestables y muy reactivos. Por ejemplo, la luz solar puede romper la molécula de cloro, dando lugar a dos átomos de cloro muy reactivos: Cl2 → 2 Cl. Síntesis de alcanos: Aunque se obtienen a partir del petróleo, pueden sintetizarse por: 1. Hidrogenación de haluros del alquilo, de alcoholes o de alquenos. (El hidrógeno se requiere en forma monoatómica por eso se hace con hidrógeno naciente o en presencia de catalizadores) R–X + H2 → R–H + HX Estos cloros pueden chocar con una molécula de alcano y adicionarse a la molécula: R–OH + H2 → R–H + H2O Luz CH4 + Cl2 ——→ CH3Cl CH2=CH2 + H2 → CH3CH3 Luz 2 CH3CH2Cl ——→ CH3CH2CH2CH3 + Cl2 Las reacciones por radicales libres tienen lugar en tres fases: 1− Iniciación, que requiere un aporte energético para romper la molécula, 2− Propagación, que tiene lugar en cadena y 3− Finalización. Las reacciones por radicales libres son muy inespecíficas porque dependiendo de por donde tenga lugar el choque entre las moléculas se forma un compuesto u otro. En el caso concreto de la cloración del metano se forma una mezcla de CH3Cl, CH2Cl2, CHCl3 y CCl4 y la proporción depende de la proporción en la que estén los reactivos. 259 2. La acción de metales alcalinos sobre haluros del alquilo es muy importante porque permite adicionar cadenas: 2 R–X + 2 Na → R–R + 2 NaX R–X + R´–X + 2 Na → R–R´ + 2 NaX 260 Hidrocarburos insaturados: Son los que contienen dobles o triples enlaces. Al contrario que los alcanos Reacciones de los alcanos: Los alcanos son bastante estables, de ahí que también se les llame parafinas. 1. Combustión. Como todos los hidrocarburos, al arder dan CO2 y vapor de H2O y gran cantidad de energía: En primer lugar enlaces están formados por un enlace σ y uno o dos π que son mucho más débiles, por lo que se rompen más fácilmente. Además la alta densidad electrónica del doble y triple enlace hace que se ataque fácilmente por reactivos electrófilos dando reacciones de adición. 2. Craking o pirólisis: Consiste en partirlos (de ahí su nombre) en otros de cadenas más pequeñas. El craking se hace a unos 500º, en ausencia de aire para evitar su combustión y en presencia de catalizadores. El resultado suele ser una mezcla compleja. Síntesis de alquenos y alquinos: Por reacciones de eliminación: Q KOH/Etanol CH3CH2CH2CH3 → CH3CH=CH2 + CH4 CH3CH2–Cl ——→ CH2=CH2 + KCl + H2O Q KOH/Etanol CH3CH2CH2CH3 → CH2=CH2 + CH3CH3 Cl–CH2CH2–Cl ——→ CH≡CH + 2 KCl + 2 H2O Cl–CH2CH2–Cl ——→ CH2=CH2 + ZnCl2 Zn 3. Sustitución: Como los alcanos son muy estables solo dan reacciones de sustitución por reacción homopolar con radicales libres (Cl. o NO2.) ya que estos sí que son muy inestables. H2SO4 CH3CH2–OH ——→ CH2=CH2 + H2O Pt / Pd La halogenación de un alcano se hace en presencia de luz. La luz rompe la molécula de cloro o de bromo formando dos radicales libres muy reactivos y produciendo una reacción en cadena. CH3CH3 ——→ CH2=CH2 + H2 Reacciones de alquenos y alquinos: 1. Reacciones de adición electrófila: de halógenos, haluros de hidrógeno y agua en medio ácido. La adición de bromo CH2=CH2 + Cl2 → Cl–CH2–CH2–Cl En realidad se forma una mezcla de productos: CH3Cl, CH2Cl2, CHCl3 y CCl4, dependiendo de la proporción de los reactivos: CH≡CH + 2 Cl2 → Cl2CH–CHCl2 La nitración es la reacción con ácido nítrico en caliente, en presencia de ácido sulfúrico concentrado, y da lugar a nitro−derivados y agua: CH2=CH2 + HCl → CH3–CH2–Cl CH≡CH + HCl → CH2=CHCl (Cloruro de vinilo) H+ CH2=CH2 + H2O → CH3–CH2–OH 2. Oxidación. Además de arder dando CO2 y agua como todos los hidrocarburos, se oxidan fácilmente con KMnO4 o con K2Cr2O7 , en medio ácido. Cuando la oxidación es suave dan lugar a alcoholes dihidroxilados llamados glicoles y si la oxidación es fuerte el doble enlace se rompe y dan lugar a ácidos. 4. Los cicloalcanos dan reacciones de adición, especialmente el ciclopropano y ciclobutano, ya que al ser ciclos muy pequeños las repulsiones hacen que no sean estructuras muy estables. 261 262 3. Polimerización: Un polímero es un compuesto de elevado peso molecular, cuya estructura puede considerarse constituido por muchas partes idénticas más pequeñas llamadas monómeros. Los alquenos se polimerizan por adición en presencia de catalizadores. ALCOHOLES Y FENOLES Por ejemplo, al calentar etileno por encima de los 100 ºC y a presión de 100 atm. en presencia de pequeñas cantidades de oxigeno es convertido en polietileno Síntesis de alcoholes: Contienen el grupo hidroxilo –OH. Cuando está unido a un radical alifático se llaman alcoholes R–OH y cuando está unido a un grupo aromático se llaman fenoles Ar–OH. 1. Sustitución nucleófila de un haluro, donde se sustituye X– por OH– por reacción de agua o con una base débil CH3CH2–Cl + H2O ——→ CH3–CH2OH + HCl CH3CH2–Cl + AgOH ——→ CH3–CH2OH + AgCl ↓ si el haluro reacciona con una base fuerte como KOH da alcohol, pero también se produce la eliminación dando un alqueno: CH3–CH2OH + KCl CH3CH2–Cl + KOH 4. El hidrógeno terminal de los alquinos es ácido y puede ser sustituido por metales activos como el sodio: CH2=CH2 + KCl + H2O 2. También pueden obtenerse por reducción con hidrógeno de aldehídos o cetonas: R–C≡C–H + Na → R–C≡C–Na + ½ H2 esto se utiliza para obtener otros alquinos distintos haciéndolo reaccionar con un haluro del alquilo: R–C≡C–Na + X–R´ → R–C≡C–R´ + NaX CH3COCH3 + H2 ——→ Reacciones de sustitución aromática: La alta densidad electrónica del anillo bencénico hace que se ataque por reactivos electrófilos. Así las sustituciones mas importantes son la halogenacion y nitración CH3–CHOH–CH3 Reacciones de alcoholes: Tienen unas propiedades parecidas al agua. 1. Con los metales alcalinos reaccionan de forma parecida a como lo hace el agua, dando hidrógeno y un etóxido. CH3–CH2OH + Na ——→ CH3–CH2ONa + ½ H2 2. Sustitución: Reaccionan con haluros de hidrógeno CH3–CH2OH + HCl ——→ CH3–CH2–Cl + H2O 3. Eliminación: Con un deshidratante como el ácido sulfúrico dan alquenos: También, como los alcanos, por reacción de haluros con metales alcalinos permite adicionar cadenas 263 264 4.Si arden dan lugar a CO2 y agua, pero por oxidación suave dan aldehídos (o cetonas si son alcoholes secundarios) y si continúa la oxidación dan lugar a ácidos. Por ese motivo cuando el alcohol del vino se oxida al aire finalmente forma ácido etanoico o acético y se dice que se ha avinagrado. Como oxidante también puede utilizarse por ejemplo KMnO4 o K2Cr2O7 ambos en medio ácido. CH3–CH2OH + Ox ——→ CH3–CHO + H2O Contienen el grupo carbonilo >C=O. Si uno de los sustituyentes es el hidrógeno resulta un aldehído y si los dos sustituyentes son radicales es una cetona. Reacciones de aldehídos y cetonas: El grupo carbonilo se encuentra polarizado debido a la mayor electronegatividad del oxígeno. Además tiene una gran densidad electrónica por lo que puede dar lugar a reacciones de adición electrófila por ataque al oxígeno, pero también de adición nucleófila por ataque al carbono. si, por ejemplo utilizamos el dicromato potásico, que es de color naranja. se reducirá a Cr3+ de color verde y oxidará el etanol a etanal o a ácido acético si se pone exceso de dicromato. 1. La adición de un alcohol a un aldehído da lugar a acetales. Se cataliza en medio ácido: 5. Con los ácidos dan ésteres. A la reacción, que es similar a la neutralización de un ácido por una base, se le conoce como esterificación: 2. El mismo mecanismo tiene la adición de ácido cianhídrico (no necesita de un medio ácido porque el HCN ya lo es) para dar un α−hidroxinitrilo,. Ampliación Ajuste de la reacción redox del etanol con permanganato potásico en medio ácido para dar enatal: CH3–CH2OH + KMnO4 + H2SO4 → CH3–CHO + K2SO4 + MnSO4 + H2O Las semireacciones que son: Para obtener el número de oxidación del carbono es mejor escribir las fórmulas en su forma molecular y seguir las reglas, y recuerda que el número de oxidación, aunque normalmente coincide con la valencia, no es lo mismo y en este ejemplo el carbono pasa de –2 a –1. –4 +6 –2 3. Los aldehídos por reducción dan alcoholes, y por oxidación ácidos carboxílicos (esta ultima reacción es la que tiene lugar cuando se oxida el vio y se transforma en vinagre) –2 +4 –2 5 * ( C2H6O – 2e– – 2 H+ → C2H4O ) +7 +2 2 * ( MnO4– + 5 e– + 8 H+ → Mn2+ + 4 H2O ) −−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−−− 5 C2H6O +2 MnO4– + 6 H+ → 5 C2H4O + 2 Mn2+ + 8 H2O ÁCIDOS CARBOXÍLICOS la reacción es su forma molecular sería: Contienen el grupo carboxilo 5 C2H6O + 2 KMnO4 + 3 H2SO4 → 5 C2H4O + K2SO4 + 2 MnSO4 + 8 H2O La oxidación del etanol hasta ácido acético sería: El carácter ácido se explica porque el doble enlace del oxígeno está deslocalizado entre los dos oxígenos, como prueba que la longitud de enlace entre los dos oxígenos y el carbono sea la misma. El resultado son dos estructuras resonantes que le dan mucha estabilidad a la vez que hacen que el protón se encuentre muy suelto y de ahí su carácter ácido: C2H6O + KMnO4 + H2SO4 → C2H4O2 + K2SO4 + MnSO4 + H2O La semireacción de oxidación del carbono sería: –4 +6 –2 0 +4 –4 C2H6O – 4e– + H2O – 4 H+ → C2H4O2 5 C2H6O + 4 KMnO4 + 6 H2SO4 → 5 C2H4O2 + 2 K2SO4 + 4 MnSO4 + 11 H2O ALDEHÍDOS Y CETONAS 265 266 Son ácidos débiles, aunque su acidez depende de la composición del radical R. Así por ejemplo el ácido cloroacético es bastante más fuerte que el acético debido a que la electronegatividad del cloro provoca un corrimiento de los electrones hacia él cloro y como consecuencia el protón está más suelto: Ampliación Los lípidos, también llamados grasas cuando son sólidos y aceites cuando son líquidos, se forman por esterificación de ácidos grasos (ácidos de cadena larga) y glicerina (propano−1,2,3−triol). Reacciones de los ácidos carboxílicos: 1. Reaccionan con los metales (los que están por encima del hidrógeno en la tabla de potenciales de reducción) exactamente igual que los ácidos inorgánicos, es decir, dando una sal y desprendiendo hidrógeno: Cuando el ácido graso es el oleico: CH3–(CH2)7–CH=CH–(CH2)7–COOH tenemos el aceite de oliva. Como puedes ver, tiene un doble enlace y eso hace que sea más fácil de asimilar por el organismo al ser más reactivo que los aceites saturados, como el de palma o de coco, que contienen el ácido palmítico CH3–(CH2)14–COOH. Se llama Saponificación a la reacción de aceites (o de grasas) con bases como el NaOH, dando lugar a una sal de ácido graso, que se denomina jabón, y glicerina. 2. Dan reacciones de neutralización con las bases dando sal y agua, exactamente como lo hacen los ácidos inorgánicos: Los jabones tienen la propiedad de ser anfipáticos, es decir que tienen un extremo hidrofílico (soluble en agua) y otro extremo hidrófobo (repele el agua). En efecto, son solubles por la polarización del enlace RCOO–Na+ , pero además como tienen una cadena muy larga que es apolar. Como ves en la figura, las gotas de grasa son rodeadas por la parte hidrófoba del jabón formando micelas. Las micelas son solubles en agua porque ofrecen hacia fuera los grupos COO– y de esa forma es como un jabón disuelve a la grasa. 3. Con los alcoholes reaccionan de forma parecida y dan ésteres. La reacción entre un ácido y un alcohol se le llama “esterificación”: 4. Por reacción con el amoníaco o con una amina dan lugar a amidas: 267 268
© Copyright 2026