TEMA 2: VOLUMETRÍAS ÁCIDO BASE
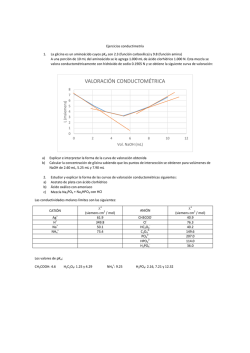
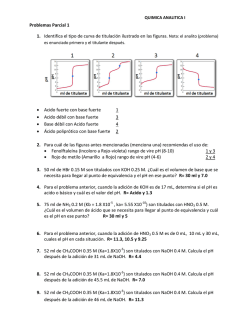
QUÍMICA - I.N.E.A. TEMA 2: VOLUMETRÍAS ÁCIDO BASE 2.1.- FUNDAMENTOS Y CLASIFICACION En análisis volumétrico se trata la solución de la sustancia problema con una solución de un reactivo adecuado de concentración exactamente conocida. Se añade el reactivo hasta que la cantidad del mismo sea equivalente a la cantidad de sustancia que se analiza (en general no se usa un exceso de reactivo). La solución de la concentración exactamente conocida que se utiliza para determinar la concentración de sustancia desconocida se llama solución valorada o patrón. Para señalar el punto en el que la cantidad de reactivo añadido es equivalente a la de la sustancia que se determina, se pone en el sistema un reactivo auxiliar conocido como indicador. Cuando ha concluido prácticamente la reacción entre la sustancia valorada y la sustancia que se titula, el indicador experimenta un cambio visible, este punto se llama punto final de la titulación que no tiene porque coincidir necesariamente con el punto de equivalencia, es el punto final teórico. El indicador debe escogerse de tal forma que la diferencia entre el punto de equivalencia y el punto final sea la menor posible. El error cometido en la valoración puede determinarse mediante un ensayo en blanco del indicador. CLASIFICACION Y METODOS VOLUMETRICOS 1.- Métodos que se basan en la combinación de iones. Existen dos casos: H+ + OH- → H2O Volumetrías de neutralización. H+ + A- → HA ↓ OH- + B+ → BOH ↓ Volumetrías de precipitación. 2.- Métodos que se basan en la transferencia de electrones: Valoraciones oxido reducción. Dependiendo del agente oxidante o reductor las volumetrías reciben nombres característicos, como son las perganganometrías, dicromatometrías, iodometrías, etc. 101 QUÍMICA - I.N.E.A. 2.2.- BASES DE LOS METODOS VOLUMETRICOS 1.- Medida de volúmenes 2.- Preparación de soluciones valoradas 3.- Determinación del punto estequiométrico 2.2.1.- Medida de volúmenes Los instrumentos volumétricos que se emplean son fundamentalmente: la pipeta, la probeta y el matraz aforado. o La pipeta: es un instrumento de medida que mide el volumen que puede verter (no el que puede contener) de forma que el líquido caiga espontáneamente. o La probeta: es un instrumento de medida para verter. o El matraz aforado: es un instrumento que mide lo que contiene y no lo que vierte, sirve para preparar disoluciones valoradas. 2.2.2.- Preparación de soluciones valoradas Se pueden preparar soluciones con normalidad conocida mediante 2 métodos: a) método directo b) método indirecto a) Método directo Se pesa exactamente la cantidad de sustancia que corresponda y se disuelve en un volumen determinado. Este método solamente es válido para determinados tipos de sustancias, de tipo primario, que son sustancias que se pueden pesar, de forma que se conoce exactamente la cantidad de sustancia que se disuelve. Las condiciones que debe cumplir una sustancia de tipo primario: 1. Que su composición corresponda a la fórmula que le atribuimos. Por ejemplo el K2Cr2O7. 2. Sustancias que se puedan secar sin descomponerse a una temperatura de 110 ºC. La humedad es un componente habitual de las sustancias que se manejan en el laboratorio, no es fijo, es aleatorio y depende de la humedad del ambiente. 3. No debe de tener agua de cristalización ya que ésta casi nunca es propiedad rigurosa y exacta. 4. Sustancia fácil de preparar en estado puro. 102 QUÍMICA - I.N.E.A. 5. Tener un peso equivalente elevado, cuanto más alto sea el peso equivalente mayor cantidad hay que pesar lo que implicará un menor error relativo. 6. Que sea estable al aire. Ejemplo: Preparar 1L de disolución 0,1 N de K2Cr2O7, su Pm es de 294,22 g/mol La reacción redox es la siguiente: Cr2 O7= + 14 H+ + 6e- → 2Cr+++ + 7 H2O Pequiv PM 294 ,22 49 ,037 nº Oxidación 6 Es decir para preparar 1 litro de disolución 1 N, se necesitarán 49,037 g Es decir para preparar 1 litro de disolución 0,1 N, se necesitarán 4,9037 g Si por error pesamos una cantidad ligeramente diferente (Por ejemplo 4,925), puede utilizarse la disolución preparada, pero utilizando un factor de corrección “f” que se calculará de la forma: f Peso real 4,9250 1,004 Peso teórico 4,9037 b) Método indirecto Cuando se quiere preparar una solución valorada de una sustancia que no es tipo primario es preciso preparar una solución que aproximadamente proporciona la concentración requerida y luego se valora la esta con una solución de tipo primario. Por ejemplo: queremos preparar 1 L de una solución 0,5 N de HCl partiendo de una disolución concentrada de HCl, de densidad 1,19 g/L y un tanto por ciento en peso de HCl de 37,9. 103 QUÍMICA - I.N.E.A. HCl ρ= 1,19 g/L 37,9 % PM = 36,5 g/mol 1190 g de disolución M 37 ,9 g de HCl 451,01 g de HCl 100 g de disolución 451,01 g de HCl 12 ,36 mol / L 36,5 g / mol N M Valencia 12,36 VN = V´N´ V · 12,36 = 0,5 N · 1000 cm3 V = 40,45 cm3 Debemos añadir 40.45 cm3 de ácido clorhídrico concentrado de un 37.9 % de pureza en 1 L de agua, para obtener una disolución de HCl 0.5 N. Este HCl obtenido es aproximadamente 0,5N. Para obtener una concentración exacta es necesario valorarlo con una base que sea tipo primario. Se puede aplicar entonces la fórmula: VB NB fB = VA NA fA Y determinar el valor de corrección fA para el HCl. 2.2.3. Determinación del punto estequiométrico El conocimiento del punto final en un método volumétrico es fundamental y esto se consigue mediante la utilización de indicadores que pueden ser químicos o físicos Químicos: Son sustancias químicas que a la vez pueden ser: indicadores externos, internos y autoindicadores. o INTERNOS Son sustancias extrañas a la reacción de la valoración sólo capaces de modificarse con un ligero exceso de reactivo de tal forma que hacen perceptible el punto final por la aparición, desaparición o cambio notable de color. o EXTERNOS Son sustancias que no se incorporan a la solución problema sino que es preciso extraer de vez en cuando una gota de la solución para hacerla reaccionar con el indicador. 104 QUÍMICA - I.N.E.A. o AUTOINDICADORES Son aquellas sustancias o disoluciones valoradas que tienen un color característico y que por tanto permiten apreciar enseguida un ligero exceso de la misma. Por ejemplo el KMnO4. Fisicos: Basados en el cambio de alguna propiedad física durante la valoración, las más utilizadas son las eléctricas y ópticas. Utilizando propiedades eléctricas como sistema indicador se obtiene una serie de métodos volumétricos; dependiendo en qué propiedad esté basada recibe un determinado nombre: por ejemplo: el cambio de conductividad en la solución da lugar a las conductimetrías, si se mide la diferencia de potencial – potenciometría, si mide la variación de la intensidad de corriente se llama amperiometría, etc . 2.3. METODOS VOLUMETRICOS DE NEUTRALIZACION 2.3.1. Generalidades Comprenden las acidimetrías y las alcalimetrías. Las primeras tienen por objeto titular bases y sales de ácidos muy débiles mediante un ácido valorado. Las alcalimetrías es el proceso inverso; tienen por objeto titular ácidos y sales de bases muy débiles con una base valorada. Tanto las alcalimetrías como las acidimetrías se basan en la reacción: H+ + OH- → H2O La volumetría de neutralización ideal sería aquella en la cual se enfrentan un ácido y una base fuerte cuyo pH = 7 pero cuando el ácido o la base son débiles intervienen fenómenos de hidrólisis y la neutralización no se produce a un pH = 7 2.3.3. Calculo de los % de pureza a partir de los valores de titulación Un equivalente alcalino que neutraliza un equivalente ácido; 1 ml de solución alcalina 1 N neutralizará un peso miliequivalente de ácido, dicho de otra forma, el número de mililitros multiplicado por la normalidad de la solución dará el número de miliequivalentes de la sustancia sobre la que reacciona. El nº de miliequivalentes así encontrado multiplicado por el peso miliequivalente de la sustancia sobre la cual reacciona nos dará el número de gramos de la sustancia. gramos x ml s N s Peso miliequivalente de x 105 QUÍMICA - I.N.E.A. Si se desea conocer el % tendremos que dividir este peso entre el peso de la muestra tomada y multiplicarlos por 100 % de x mls ·Ns ·peso mequivalente x 100 Peso muestra tomada 2.4. APLICACIONES DE VOLUMETRIAS 2.4.1. Valoración de mezclas de carbonatos e hidróxidos alcalinos a) Método de Warder: Se utiliza como reactivo valorante HNO3 o HCl. Los indicadores que se utilizan son la fenoftaleina y el naranja de metilo. Las reacciones son: 1º (Fenoftaleína) NaOH + HCl NaCl + H2O Na2CO3 + HCl NaHCO3 + NaCl V1 Método operativo Inicialmente se añade a la mezcla fenoftaleina, después se neutraliza con ácido. Hasta el viraje de la fenoftaleina, se producen las reacciones que se indican arriba en el primer paso. (Se neutraliza el NaOH y el carbonato se transforma en bicarbonato). A continuación se añade a la mezcla naranja de metilo y se sigue añadiendo ácido, se producen las reacciones indicadas en el 2º paso. (El bicarbonato se transforma en ácido carbónico (H2CO3)) Cálculos Si se resta el volumen consumido en la 2ª valoración del consumido en la 1ª, la diferencia es el volumen necesario para neutralizar el hidróxido. (Si por ejemplo la 1ª reacción gasta 5 ml y la 2ª 2 ml lo correspondiente al OH- sería 3 ml) Lo correspondiente al CO3 2V2 = 4 ml b) Método Winklen: Al igual que en el caso anterior los indicadores que se utilizan son la fenoftaleina y el naranja de metilo. En este caso las reacciones son las siguientes: 106 QUÍMICA - I.N.E.A. Método operativo Se pretende determinar inicialmente solamente el NaOH, se procede por tanto a añadir un reactivo que elimine los carbonatos de la disolución. Para ello se añade a la mezcla cloruro de Bario (BaCl2), que forma un precipitado de carbonato de Bario (BaCO3) procedente del carbonato sódico (Na2CO3) e hidróxido de Bario (Ba(OH)2) procedente del NaOH. Sin filtrar se valora la solución resultante con HCl, de forma que se neutraliza solamente el Ba(OH)2 producido. Se utiliza fenolftaleina como indicador, gastando un volumen V1. Por otra parte y en otra muestra distinta se valora la mezcla de carbonatos e hidróxidos con HCl utilizando naranja de metilo como indicador, gastando un volumen V2. En este caso el ácido se utiliza para neutralizar el NaOH y el Na2CO3. Cálculos La diferencia entre el volumen gastado en la 2ª valoración y la 1ª, representa el volumen necesario para la neutralización del CO3= siendo el volumen gastado en la 1ª valoración el que corresponde a la neutralización del NaOH. OH- V1 CO3= V2 – V1 2.4.2 Valoración de mezclas de carbonatos y bicarbonatos Los indicadores que se utilizan son la fenoftaldeina y el naranja de metilo y las reacciones son: 1. Na2CO3 + HCl NaHCO3 + NaCl V1 2. NaHCO3 + HCl H2CO3 + NaCl V2 Método operativo En la primera valoración y utilizando la fenoftaldeina como indicador neutralizamos los carbonatos (CO3=) hasta bicarbonatos (HCO3-). En la segunda valoración neutralizamos tanto los bicarbonatos que existían inicialmente como los que se han producido en la 1ª valoración. 107 QUÍMICA - I.N.E.A. 1ª Valoración: Na2CO3 + HCl Na HCO3 + NaCl V1 (por ejemplo 2 ml) 2ª Valoración: NaHCO3 + HCl H2CO3 + NaCl V2 (por ejemplo 5 ml) Cálculos El bicarbonato neutralizado en la 2ª valoración es una mezcla del inicialmente existente y el formado en la primera valoración. Este último requerirá el mismo volumen de ácido que el consumido en la 1ª valoración por consiguiente si se resta el volumen del ácido gastado en la 2ª valoración, la diferencia es el volumen requerido por el bicarbonato existente en la disolución inicial (no procedente del carbonato). CO3= 2V1 = 4 ml. NaHCO3 V2 – V1 = 3 ml. 108 QUÍMICA - I.N.E.A. 2.4.3. Método de Kjeldahl para la determinacion del Nitrógeno. Este método sirve para valorar el N de muchas sustancias, entre ellas sustancias orgánicas, sirviendo por lo tanto como procedimiento para valorar proteínas ya que de la cantidad de N presente puede deducirse la de proteínas sin más que multiplicar el % de Nitrógeno por un factor numérico. Para valorar el Nitrógeno, este tiene que encontrarse en forma amoniacal, si no lo está es necesario transformarlo primero hasta forma amoniacal para después llevar a cabo la valoración. 1.- Determinación de nitratos. 2.- Determinación de N en compuestos orgánicos. 3.- Determinación del ión NH4+ 1.- DETERMINACION DE NITRATOS El nitrato tiene que reducirse a una sal amónica la cual se determina por el procedimiento de destilación y valoración. El agente reductor más usado es la aleación Dewarda que está compuesta por el 50% de Cu, 45% de Al y 5% de Zn. Al ΝΟ Cu NH 4 Zn 3 2.- DETERMINACION DEL NITRÓGENO EN COMPUESTOS ORGÁNICOS El N se presenta en una gran variedad de sustancias orgánicas como proteínas, fertilizantes, etc. Para su determinación se utiliza el método de KJELDAHL que consiste primero en una oxidación de la muestra con H2SO4 concentrado y caliente de tal forma que el N orgánico se convierte en (NH4)2SO4 H2SO4 + (sustancia orgánica) (NH4)2SO4 3. DETERMINACION DEL ION NH4+ Tenemos una sal de NH4+ y queremos determinar la cantidad de NH4+ que contiene. Comprende 3 etapas. 1.- La sustancia se descompone con exceso de base fuerte. 2.- El NH3 liberado es destinado y recogido cuantitativamente 3.- Finalmente la cantidad de NH3 se determina por valoración de neutralización ETAPAS: 1. La sustancia se descompone con exceso de base fuerte (NaOH). 109 QUÍMICA - I.N.E.A. (NH4)2SO4 + NaOH + calor Na2SO4 + H2O + NH3↑ (DESTILACION) 2. El NH3 producido se destila y se recoge sobre un exceso de ácido sulfúrico. 2 NH3 + H2SO4 (exceso) (NH4)2SO4 3. Finalmente la cantidad de NH3 se determina mediante una valoración de neutralización. Valorando el exceso de H2SO4 que queda sin reaccionar con NaOH y conociendo el H2SO4 que se añadió inicialmente, se puede determinar la cantidad de amoniaco que hay en la muestra. H2SO4 + 2 NaOH Na2SO4 + H2O Se considera que se ha terminado la valoración cuando se ha destilado aproximadamente la mitad del NH4+ que tenía en un principio. ¿Cuál serán los miliequivalentes de ión amonio? mequiv NH 4 mequiv ácido meequiv base mequiv NH 4 V A N A VB N B mg N mequiv NH 4 Pequiv N %N ( V A N A f A VB N B f B ) mequiv N 100 PESO MUESTRA mg Los factores de conversión para transformar el porcentaje de N a proteína son los siguientes en función del producto: 6,25 Lácteos y derivados 6,38 Carnes Cereales 5,7 110
© Copyright 2026