Antigua Mecánica Cuántica Las reglas de Bohr fueron
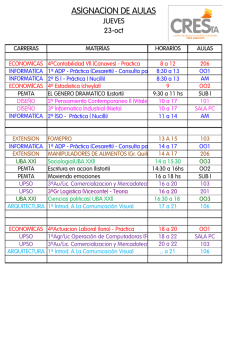
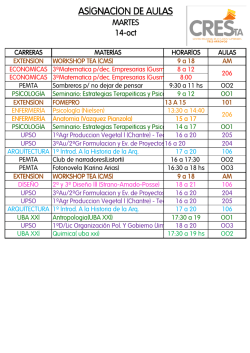
Antigua Mecánica Cuántica Las reglas de Bohr fueron generalizadas a sistemas con más grados de libertad por Arnold Sommerfeld. Sommerfeld basó su generalización en las variables acción-ángulo de la Mecánica Clásica. Consideremos un sistema de n grados de libertad y un sistema de coordenadas canónicas donde la ecuación de Hamilton-Jacobi es separable. Sean las coodenadas canónicas qi , pi. Supongamos además que en este sistema las coordenadas y momentums son funciones H periódicas del tiempo. La variable de acción, asociada al grado de libertad i es Ai = pid qi. La integral se extiende sobre los valores clásicos permitidos de qi. Ai es el área en espacio de fases correspondiente al movimiento clásico de la coordenada qi. Reglas de Bohr Sommerfeld: H pidqi = nih Oscilador armónico 2 s 1 2m E − mω 2x2 2 p 1 + mω 2x2 = E p= x± = ± 2m 2 Z x+ s 1 4 2m E − mω 2x2 dx = nh 2 0 r r Z π 2 √ √ 2 mω 2E x = E cos α, α(x+) = 0 4 2mE dαsen 2α = 2 2 mω 0 Eπ cos 2α = 1 − 2sen2α 8 = nh ω4 E = nhν H= r 2E mω 2 La integral de acción se puede encontrar de manera directa usando variable compleja. Miremos el plano complejo x. La integral de acción corresponde a la trayectoria que encierra los dos puntos de ramificación de p(x) con un corte entre ellos. En el plano complejo, calculamos la integral de acción, mirando el plano complementario. Allí no hay corte: La función es analítica en todas partes excepto por un polo en x = ∞. Usando el teorema de Cauchy, se tiene: I pdx = 2πi Res(p(x)) x=∞ s 1 1 1 x = t−1 dx = − 2 dt, 2m E − mω 2t−2 2 dt t t 2 s s 1 1 mωi 2E 2m E − mω 2t−2 2 = 3 1− t2 = 2 2 t t=0 t mω E mωi E 2 Res = − 1 − t i ω t3 mω 2 I 2πE pdx = ω Atomo de Hidrógeno Dada la conservación del momentum angular para potenciales centrales, el movimiento es planar. p2ϕ p2r α E= + − 2m 2mr2 r H p ϕdϕ = n ϕh = 2πp ϕ, p ϕ = n ϕ h pr = r p2ϕ α 2m E − 2m r2 + r pr tiene dos puntos de ramificación. Cortamos el plano uniendo estos dos puntos a lo large del eje Re r. En el plano complementario sólo hay: un polo en infinito y un polo en r = 0. r q √ p2ϕ 2 α 1 1 2 2 2mE − p ϕt + 2mαt = 2 2mE 1 − t + t t 2mE q E t2 √ 1α m Res∞ = 2mE =α I q 2 E 2E m prdr = 2πi α + p ϕi = nrh 2E m 2 = (nr + n ϕ)2h −α2 2E Res0 = p ϕi mα2 E =− 2 2(nr + n ϕ)2h El espectro es degenerado. La energía sólo depende del número cuántico principal n = nr + n ϕ, lo que corresponde a varios valores de nr , n ϕ. Esto se manifiesta en el espectro como lineas gruesas, que con mayor resolución aparecen como dos líneas delgadas muy cercanas(Estructura fina). Figura 1. Estructura Fina Atomo de Hidrógeno Relativista: L = −mc2 pr = mγṙ, p2ϕ 2 pr + r 2 q 1− ~ v2 c2 a ∂L + r , v 2 = ṙ 2 + r 2 ϕ̇ 2, p ϕ = ∂ϕ̇ = mγr 2 ϕ̇ −m2c4 + K 2 2 2 2 2 2 2 2 2 2 2 = m γ ṙ + m γ r ϕ̇ = m γ v = c2 p ϕ = n ϕh. E = K − a , r pr = q −m2c2 + E+ c2 a 2 r − =m γ c p2ϕ r2 2 2 2 1−1+ v2 c2 . • Dos puntos de ramificación. Corte a lo largo del eje Re r. q 2 a • Polo en r = 0. Res = c2 − p2ϕ q (E + at)2 • r = −m2c2 + − p2ϕt2 = c2 q aE E2 i aE −i (m2c4 − E 2) m2c2 − c2 = − r 1 1 , t t2 c2 • • aE r c2 m2c2 − E2 c2 a 2 2 E = c2 − q m2c2 − 1 t2 q 2 2 −m c + E2 c2 a2 − c2 + p2ϕ = nrh nr h + q a2 − c2 + p2ϕ 2 2 2 m c − E2 c2 E2 c2 1 + aE t 2 (−m c4 + E 2) , Res = m2c2 nrh + E2 = a c2 2 + r nr h + − s a2 c2 + p2ϕ !2 2 a2 − + p2 ϕ c2 c2 m c2 nrh + , E=v u r u a2 t + nr h + 2 c − r a2 c2 − + p2ϕ a2 c2 ! + p2ϕ !2 m c 2 nr h + E=v u r u a2 t + nr h + 2 c a2 − 2 c r − + p2ϕ a2 c2 + ! p2ϕ !2 =v u m c2 u 1 + a2 u c2 t 1 nr h + s 2 a2 2 − + pϕ c2 mc2 E= v u 2 u1 + a2 t c ∼ 1 nr h + r a2 − 2 c 2 + n2ϕh !2 m −1 − 4 a4 c2 4 )4h nr nϕ ma2 mc − + 2+ 8 (nr + n ϕ 2(nr + n ϕ)2h " # 2 2 ma 2a 1 1 nr mc2 − 1 + , n = nr + n ϕ + 2 2 2 2 2 8 2 n ϕ 2(nr + n ϕ) h c h (nr + n ϕ) # " n − nϕ 1 a2 ma2 2 + = 1 + E = mc − 2 2 n ϕn c2h n 4n 2n2h " # 2 2 a ma 1 3 1 + mc2 − = − 2 2 2 2 n 4n ϕ ch n 2n h 2 2 ma α 1 3 E = mc2 − − 2 1+ n n ϕ 4n 2n2h 2 El espectro depende de nr , n ϕ por separado. La degeneración se ha eliminado. α=k e2 = hc 1 constante de estructura fina=7.297 × 10−3 ≃ 137 Estructura Fina Del Hidrógeno Cuando se examinan las líneas del espectro del hidrógeno a una resolución muy alta, se encuentran que son dobletes poco espaciados entre sí(∼10−4 veces la separación entre líneas adyacentes). Esta división se llama estructura fina. Figura 2. La separación (estructura fina) de algunos niveles del átomo de H. Las transiciones posibles se denotan por una flecha sólida. • Las transiciones correspondientes a flechas sólidas se observan. • Las transiciones correspondientes a flechas punteadas no se observan. • Las transiciones ocurren sólo si n ϕi − n ϕf = ±1. Regla de selección.
© Copyright 2026